- 619.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第五讲 定量研究化学反应
姓名:________ 班级:________ 限时:______分钟
1.(2018·长沙中考)根据化学方程式不能获得该反应的信息是( )
A.化学反应的快慢 B.生成物
C.反应条件 D.反应物
2.(2018·台州中考)电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是SiO2)为原料制取,其中一步反应为SiO2+2CSi+2CO↑。对该反应分析正确的是( )
A.该反应属于置换反应
B.碳发生了还原反应
C.碳元素化合价由0价变为+4价
D.该反应利用了CO的还原性
3.(2018·潍坊中考)某矿石样本只含有如图所示的四种元素,该矿石中可能含有的物质是( )
A.CaCO3 B.SiO2
C.Al2O3 D.CuFeS2
4.(2018·淄博淄川一模)化学方程式是重要的化学用语。观察化学方程式“2Al+Fe2O32Fe+Al2O3”可得到很多信息。下列有关信息正确的是( )
A.铁的金属活动性比铝强
B.生成物Al2O3属于氧化物
C.反应前后铝元素的化合价不发生改变
D.该反应属于复分解反应
5.(2018·淄博淄川二模)下列关于2CO+O22CO2的叙述中正确的是( )
A.一氧化碳加氧气点燃等于二氧化碳
B.一氧化碳和氧气在点燃条件下反应生成二氧化碳
C.两个一氧化碳分子加一个氧分子等于两个二氧化碳分子
D.2 g一氧化碳和1 g氧气反应生成2 g二氧化碳
12
6.(2018·淄博高青一模)CH4和某种氮氧化物反应的化学方程式为CH4+2===N2+CO2+2H2O,则框内物质的化学式是( )
A.NO B.NO2
C.N2O D.N2O5
7.(2019·原创题)镁条在CO2中也能燃烧,反应现象为剧烈燃烧,放出大量的热,产生耀眼的白光,生成白色固体和黑色颗粒,该反应属于( )
A.化合反应 B.分解反应
C.复分解反应 D.置换反应
8.(2018·淮安中考)氢氟酸(HF)可用于在玻璃上雕刻各种精美图案,发生反应的化学方程式可表示为SiO2+4HF===X↑+2H2O,则物质X为( )
A.SiO B.O2 C.SiF4 D.SiF
9.(2018·淄博高青县一模)下列化学方程式书写正确的是( )
A.NaCO3+2HCl===NaCl+H2O+CO2↑
B.CuSO4+2NaOH===CuOH↓+Na2SO4
C.CO2+Ca(OH)2===CaCO3↓+H2O
D.Fe2O3+6HCl===2FeCl2+3H2O
10.(2018·泸州中考)下列有关反应的化学方程式正确,且反应前后有元素化合价升高和降低的是( )
A.碳酸铵与熟石灰混合: (NH4)2CO3+Ca(OH)2===CaCO3+2H2O+2NH3↑
B.MgCl2熔融电解制Mg:MgCl2Mg+Cl2↑
C.铝置换银:Al+AgNO3===Ag+AlNO3
D.氧化亚铁和盐酸混合:FeO+2HCl===FeCl2+H2O
11.(2018·淄博张店二模)下列四个化学反应,对其反应类型的判断,正确的是( )
A.2H2O22H2O+O2↑是分解反应
B.Fe2O3+6HCl===2FeCl3+3H2O是置换反应
C.2CuO+C2Cu+CO2↑是复分解反应
D.CH4+2O2CO2+2H2O是化合反应
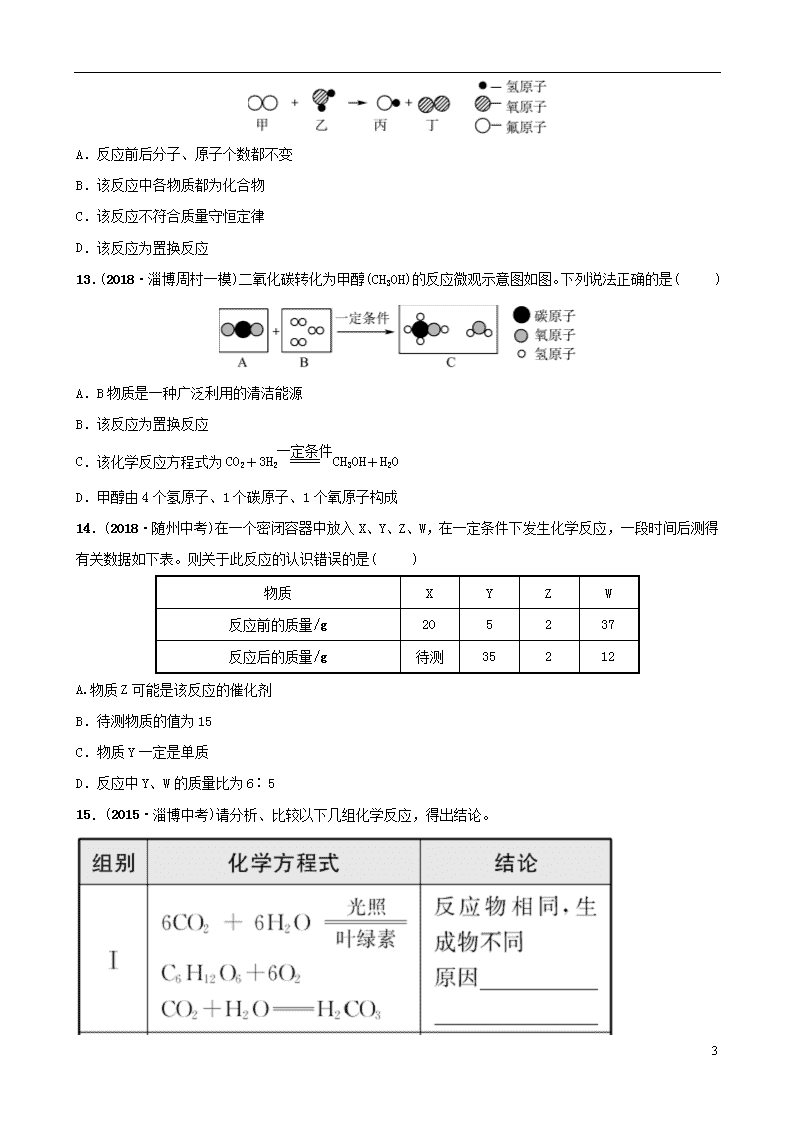
12.(2018·淄博临淄一模)下列图示可表示一定物质在一定条件下发生化学反应的微观过程,则下列说法正确的是( )
12
A.反应前后分子、原子个数都不变
B.该反应中各物质都为化合物
C.该反应不符合质量守恒定律
D.该反应为置换反应
13.(2018·淄博周村一模)二氧化碳转化为甲醇(CH3OH)的反应微观示意图如图。下列说法正确的是( )
A.B物质是一种广泛利用的清洁能源
B.该反应为置换反应
C.该化学反应方程式为CO2+3H2CH3OH+H2O
D.甲醇由4个氢原子、1个碳原子、1个氧原子构成
14.(2018·随州中考)在一个密闭容器中放入X、Y、Z、W,在一定条件下发生化学反应,一段时间后测得有关数据如下表。则关于此反应的认识错误的是( )
物质
X
Y
Z
W
反应前的质量/g
20
5
2
37
反应后的质量/g
待测
35
2
12
A.物质Z可能是该反应的催化剂
B.待测物质的值为15
C.物质Y一定是单质
D.反应中Y、W的质量比为6∶5
15.(2015·淄博中考)请分析、比较以下几组化学反应,得出结论。
12
16.(2018·天津中考)写出下列反应的化学方程式。
12
(1)碳在氧气中充分燃烧生成二氧化碳__________________________________
__________________________________________________________________
_________________________________________________________________。
(2)氢氧化钠溶液与稀盐酸混合_______________________________________
_______________。
(3)镁与稀硫酸反应____________________________________________。
17.(2018·淄博周村一模)“三效催化转换器”可将汽车尾气中的有毒气体处理为无毒气体,该反应前后的微观示意图如图所示。
请回答下列问题:
(1)A分子、B分子、C分子的相同点是________________。
(2)A物质中氮元素与氧元素的质量比是____________。
(3)写出该反应的化学方程式________________________________________
_________________________________________________________________。
18.(2018·长沙中考)小英同学用某铁合金样品做了如下实验:称量11.4 g样品,放入质量为40 g的烧杯中,再往烧杯中加入200 g稀硫酸,恰好完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称量,烧杯及烧杯内物质总质量为251 g。求:
(1)反应产生的氢气质量为__________g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
19.(2018·淄博高青一模)纯碱在生成过程中常混有少量氯化钠,实验中学化学兴趣小组的同学要测定某品牌纯碱样品中碳酸钠的质量分数。他们称取11 g 样品放入烧杯中,逐滴加入
12
稀盐酸至不再产生气泡为止,共消耗稀盐酸64.7 g,烧杯中没有残留物,称得反应后溶液的质量为71.3 g。
(1)生成二氧化碳的质量为__________g。
(2)计算样品中碳酸钠的质量分数。(写出计算过程)
20.(2017·滨州中考)小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5 g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次序
第一次
第二次
第三次
第四次
剩余固体质量/g
10.8
9.6
8.1
8.1
试计算:
(1)完全反应后生成二氧化碳的质量为__________g。
(2)求该珍珠粉中碳酸钙的质量分数。
12
21.(2018·淄博桓台一模)进行合理的资源勘探,开发利用好资源对国家经济建设意义重大。某兴趣小组的同学对我市南部山区的石灰岩进行组成分析,取样品50 g平均分成两份,一份敲打成小颗粒,另一份为大颗粒,然后分别同时投入到各盛有150 g相同溶质质量分数稀盐酸的烧杯中(烧杯质量是75 g)并开始计时,至不再产生气泡为止(反应后盐酸有剩余),记录时间为100 s和 230 s,将反应后的甲烧杯放到托盘天平上称量,发现总质量是241.2 g(包含烧杯质量且两烧杯质量相等,杂质与稀盐酸不反应)。请分析并回答下列问题:
(1)将石灰石敲打成颗粒的目的是_______________________________________
_______________________。甲烧杯中的反应时间是__________s,反应后称重乙烧杯的总质量应为______________g。
(2)乙烧杯内总共产生二氧化碳的质量是__________g。(以上直接填写结果)
(3)计算该石灰石样品中碳酸钙的纯度(即石灰石中碳酸钙的质量分数)。
22.(2018·娄底中考)某有机物在9.6 g氧气中恰好完全燃烧,生成8.8 g CO2和5.4 g H2O,下列说法正确的是( )
A.该有机物只含碳、氢两种元素
12
B.该有机物中一定含有碳、氢元素,可能含有氧元素
C.该有机物中一定含有碳、氢、氧三种元素
D.无法确定
23.(2019·原创题)在一密闭容器中加入A、B、C、D四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中正确的是( )
A.该反应为复分解反应
B.该反应的化学方程式为A+3B===C+2D
C.t1时,该反应结束
D.该反应中,B、D的质量变化之比为4∶3
24.(2018·南京中考)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是( )
A.a=56% B.b=6%
C.c=17% D.d=8%
25.(2017·滨州七校联考)以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】 化学反应前后各物质的质量总和是否相等?
【猜想与假设】 猜想1:不相等;猜想2:相等。
【实验探究】 甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
12
组别
甲组
乙组
实验方案
(反应后略)
实验
现象
有气泡产生,天平指针向右偏转
铁钉表面有红色物质生成,溶液颜色发生改变,天平指针没有偏转
结论
猜想1正确
反应的化学方程式:
______________________________________________
猜想2正确
【反思评价】 究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。
【得到启示】 在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在____________中进行。
【优化装置】 同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是______(填序号),从另外两种装置中任选一种指出其不足_________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
__________________________________________________________________。
【得出结论】 同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】 解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由__________________元素组成。
12
26.(2018·绥化模拟)取氯化镁和稀盐酸的混合液100 g,向混合液中逐滴加入溶质质量分数为20%氢氧化钠溶液至过量,反应过程中产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示:
(1)求出a的数值为____________。
(2)恰好完全反应后,将溶液蒸发掉19.2 g水,求此时溶液的溶质质量分数。
参考答案
1.A 2.A 3.B 4.B 5.B 6.B 7.D 8.C 9.C 10.B 11.A 12.D 13.C 14.C
15.反应条件不同 反应物的浓度不同 氧气的浓度不同 催化剂能够改变化学反应速率 C2H4
16.(1)C+O2CO2 (2)NaOH+HCl===NaCl+H2O
(3)Mg+H2SO4===MgSO4+H2↑
17.(1)都含有氧原子 (2)7∶16 (3)2NO2+4CO4CO2+N2
18.(1)0.4
(2)解:设参加反应的H2SO4的质量为x。
Fe+H2SO4===FeSO4+H2↑
98 2
x 0.4 g
=
x=19.6 g
所用稀硫酸的溶质质量分数为×100%=9.8%
12
答:所用稀硫酸的溶质质量分数为9.8%。
19.(1)4.4
(2)解:设样品中碳酸钠的质量为x。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 4.4 g
=
x=10.6 g
样品中碳酸钠的质量分数为×100%=96.4%
答:样品中碳酸钠的质量分数为96.4%。
20.(1)4.4
(2)解:设12.5 g珍珠粉中碳酸钙的质量为x。
CaCO3CaO+CO2↑
100 44
x 4.4 g
=
x=10 g
该珍珠粉中碳酸钙的质量分数为×100%=80%
答:该珍珠粉中碳酸钙的质量分数为80%。
21.(1)增大石灰石与稀盐酸的接触面积,加快反应速率 100 241.2 (2)8.8
(3)解:设25 g石灰石中碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 8.8 g
=
x=20 g
该石灰石样品中碳酸钙的纯度为×100%=80%。
答:该石灰石样品中碳酸钙的纯度是80%。
12
22.C 23.C 24.A
25.【实验探究】 Na2CO3+2HCl===2NaCl+H2O+CO2↑
【得到启示】 密闭容器
【优化装置】 B A装置中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大,因此反应后天平不能平衡(或C装置中碳酸钠粉末与盐酸反应太快,橡皮塞易弹出)
【解释应用】 铜、碳、氧、氢
26.(1)120
(2)解:由图可知,生成氢氧化镁沉淀的质量为5.8 g。
设与氯化镁反应的氢氧化钠的质量为x。
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
80 58
x 5.8 g
=
x=8 g
与氯化镁反应的氢氧化钠溶液的质量为=40 g
所以a=80+40=120
设最后溶液中氯化钠的质量为y。
根据钠元素守恒可得关系式:
NaOH………………NaCl
40 58.5
120 g×20% y
=
y=35.1 g
将溶液蒸发掉19.2 g水,此时溶液的溶质质量分数为×100%=18%
答:恰好完全反应后,将溶液蒸发掉19.2 g水,此时溶液的溶质质量分数为18%。
12
相关文档
- 河北省初中毕业生升学文化课考试英2021-05-1316页
- 中考历史复习资料初中历史知识点大2021-05-1354页
- 2009年河北省初中毕业生升学文化课2021-05-1311页
- 初中数学突破中考压轴题几何模型之2021-05-135页
- 最全初中语文中考名著阅读水浒传复2021-05-1317页
- 教科九年级思想品德中考初中知识提2021-05-1320页
- 2010年赤峰市初中毕业升学统一考试2021-05-135页
- 初中 中考 平面几何 动点类问题 压2021-05-1312页
- 2009年浙江省舟山市初中毕业生学业2021-05-1311页
- 2020年青岛市初中学业水平考试语文2021-05-1310页