- 353.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
综合计算
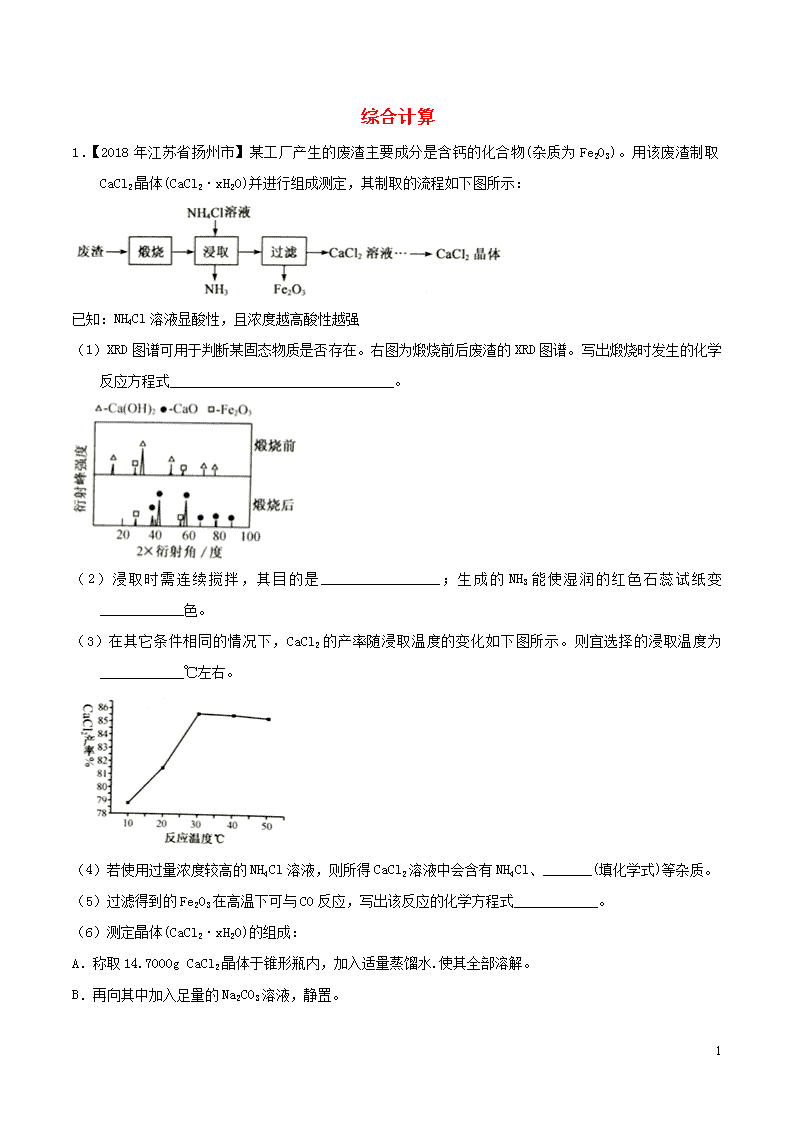
1.【2018年江苏省扬州市】某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe2O3)。用该废渣制取CaCl2晶体(CaCl2·xH2O)并进行组成测定,其制取的流程如下图所示:
已知:NH4Cl溶液显酸性,且浓度越高酸性越强
(1)XRD图谱可用于判断某固态物质是否存在。右图为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式________________________________。
(2)浸取时需连续搅拌,其目的是_________________;生成的NH3能使湿润的红色石蕊试纸变____________色。
(3)在其它条件相同的情况下,CaCl2的产率随浸取温度的变化如下图所示。则宜选择的浸取温度为____________℃左右。
(4)若使用过量浓度较高的NH4Cl溶液,则所得CaCl2溶液中会含有NH4Cl、_______(填化学式)等杂质。
(5)过滤得到的Fe2O3在高温下可与CO反应,写出该反应的化学方程式____________。
(6)测定晶体(CaCl2·xH2O)的组成:
A.称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水.使其全部溶解。
B.再向其中加入足量的Na2CO3溶液,静置。
8
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。______________________。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加__________,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值______(填“偏大”、“偏小”或“ 不变”。
2.【2018年山东省青岛市】侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品 12.5 g,将其放入干净的烧杯中,加入 100 g 水,使其完全溶解。向所得溶液中加入溶 质质量分数为 7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
(1)B 点时,烧杯中溶液里存在的阳离子为_____(填写离子符号)。
(2)在碳酸钠和氯化钠的混合物样品中,含碳酸钠的质量为_____(结果精确至 0.1 g)。
(3)A 点时,求此温度下所得不饱和溶液中溶质质量分数_______(写出具体计算过程,计算结果精确至0.1%)。
3.【2018年山东省济宁市】长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究 性学习小组为测定水垢中碳酸钙的质量分數利用图I装置将足量的盐酸加入到10.0g水垢中。随反应进行,装置C质量的变化如图I所示。请回答:
(1)向图I装置A中不断通入氮气的目的是_______________;
(2)若不考虑盐酸的挥发和水垢中含有其他成分,请根据图II数据计算:
水垢中碳酸钙的质量是________,水垢中氢氧化镁的质量分数是___________; (不要求计算过程,精确到0.1)
8
(3)若考虑盐酸的挥发,会造成水垢中碳酸钙质量分数的测量结果_______(填“增大” “减小”或“不变”)。
4.【2018年四川省巴中市】小华有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:
第1次
第2次
第3次
第4次
第5次
加入烯盐酸的质量(克)
10.00
10.00
10.00
10.00
10.00
充分反应后剩余固体的质量(克)
24.35
23.70
23.05
23.00
23.00
根据上表中数据分析,完成下列问题:
(1)手镯中银的质量是________克。
(2)所用稀盐酸中溶质的质量分数是多少________?
5.【2018年甘肃省平凉市】用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如下图所示。
请计算:
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水__________克.
(2)当a为80g时,所得溶液中溶质的质量分数是___________(结果精确到0.1%)?
6.【2018年四川省德阳市】某工厂利用废硫酸与废铁屑反应制取硫酸亚铁。现取废硫酸4.9 t 与足量的废铁屑反应,得到FeSO4 1.52 t。计算废硫酸中H2SO4的质量分数为_______________。
7.【2018年四川省达州市】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数
累计加入氯化钙溶液的质量/g
烧杯中溶液的总质量/g
一
40
134
二
80
168
三
120
202
8
四
150
232
(1)恰好完全反应时,生成沉淀的总质量为____g
(2)第四次测量时,所得溶液中的溶质有_______(填化学式)。
(3)计算氯化钙溶液的溶质质量分数为______________(写出计算过程)。
8.【2018年山东省威海市】向20g,铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请计算:
(l)合金中锌的质量分数为____。
(2)所用稀盐酸的溶质质量分数为_____________。(计算结果保留一位小数)
9.【2018年江西省】2018年5月18日我国第一艘国产航母试海成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次
第二次
第三次
第四次
加入稀硫酸的质量(g)
20
20
20
20
烧杯中剩余物的质量(g)
39.92
59.84
79.80
99.80
(1)黄铜粉末完全反应生成氢气的总质量为_______g。
(2)该黄铜中铜的质量分数为多少____________? (写出计算过程)
(3)第三次实验中溶质的种类为________________。
10.【2018年湖南省长沙市】小英同学用某铁合金样品做了如下实验:称量11.4g样品,放入质量为40g的烧杯中,再往烧杯中加入200g稀硫酸,恰好完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称量,烧杯及烧杯内物质总质量为251g。求:
(1)反应产生的氢气质量为__________g;
(2)所用稀硫酸的溶质质量分数________________(写出计算过程)。
11.【2018年江苏省连云港市】过氧化钙( CaO2
8
)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3为原料制备CaO2的一种工艺流程如下:
(查阅资料)I.Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
Ⅱ.CaCl2+2NH3·H2O+H2O2 +6H2O= CaO2·8H2O↓+ 2NH4Cl
Ⅲ.CaO2·8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是_______;Ca(OH)2的俗名为_______;“过滤1”所得滤渣的主要成分是_______。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、_______。生产过程中为了精确测定溶液的pH,常使用_______ (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)对其产率(w)的影响如图所示。
①平均反应速率最快的时间段为:_______ (填字母)。
a.0~10min b.10~20min c.20~30min D.30~40min
②30min后,w开始下降的主要原因是_______。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%)____。
12.【2018年湖北省咸宁市】现有一瓶敞口放置在空气中的NaOH固体,欲知其组成成分,取样品9.3克向其中逐渐加入一定质量分数的稀盐酸,产生气体的质量与加入稀盐酸质量关系如图所示,试回答:
(1)产生二氧化碳气体的质量为_______克。
8
(2)所用稀盐酸溶质质量分数为___________。
(3)求样品中氢氧化钠的质量分数为___________。(精确到0.1%)
13.【2018年湖北省咸宁市】为了测定一瓶硫酸铜溶液的溶质质量分数,取出50克该溶液,向其中逐滴加入溶质质量分数为16%的氢氧化钠溶淀液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示:
请你仔细分析此关系图,并进行计算。
(1)当滴入氢氧化钠溶液_____克时,硫酸铜与氢氧化钠恰好完全反应。
(2)计算此硫酸铜溶液中溶质的质量分数为_________(写出计算过程)。
14.【2018年广州市】金属钴(Co)在国防工业中有重要应用。某矿石中含钻的氧化物(CoO、Co2O3)研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件
(1)写出下列化合物中Co元素的化合价:CoO_________,Co2O3______________。
(2)酸浸时钻的氧化物发生如下反
反应I CoO+H2SO4===CoSO4+H2O
反应Ⅱ 2Co2O3+4H2SO 4===4CoSO4+O2↑+4H2O
反应Ⅲ Co2O3+2H2SO4+Na2SO3===2CoSO4+2H2O+Na2SO4
①反应后溶液中含钻元素的微粒是_________ (填化学符号)
②已知反应前矿石中CoO的质量为ag,Co2O3的质量为bg,则理论上可以生成CoSO4____g(用含a、b的式子表示)
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
8
①本实验研究了哪些因素对钴元素浸出率的影响__________________________________;
②根据上表数据,其他条件不变,温度升高,钻元素的浸出率___________________________;
③工业生产中采用实验______________(填编号)的提取条件更合理。
15.【2018年广州市】室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃)
0
20
25
40
50
60
80
溶解度(g)
69.2
74.5
76.4
81.8
85.5
89.4
98.0
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
16.【2018年广东省】用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。
(1)现有南方产的一种煤含硫8%。某火力发电厂燃烧100t这种煤,假设燃烧时煤中的硫全部转化为SO2,则产生SO2的质量是________?
(2) 如在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在图坐标中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。
8
________________
[已知]①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应;
②CaSO3和盐酸反应类似于CaCO3
(3)向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3。现用一万元分别购买两种原料来除去SO2,相关数据如下表:
方法
物质
相对分子质量
纯度
价格 (元/t)
除SO2的量 (t)
A
石灰石
100
90%
200
14.4
B
熟石灰
74
94%
500
14.6
方法B比方法A除SO2的量略大,而且工业上多数采用方法B。其原因分别是:_________
8