- 758.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012一模实验33
实验题:
1.(9分)化学课上第一小组的同学做了碳酸钠溶液和A溶液反应的实验,有沉淀产生,同学们对浑浊液过滤,得到澄清滤液。第二小组甲、乙、丙三位同学对该实验进行了一系列的探究。
探究一 A溶液中的溶质是什么?
【相关资料】Ⅰ.CaCl2 + Na2CO3 CaCO3↓+ 2NaCl Ⅱ.CaCl2溶液呈中性
(1)【提出假设】第二小组同学认为A溶液的溶质有两种可能:
①是__ __,②是 CaCl2 。
(2)【设计实验】第二小组同学设计了如下方案并进行实验:
实验操作
实验现象
实验结论
取少量A溶液于试管中,向其中滴加 溶液
__
假设①正确。 碳酸钠与其反应的化学方程式为__ 。
第一小组同学肯定了他们的实验结论。
探究二 过滤后澄清滤液中会有哪些溶质?
【提出假设】
(3)甲的合理猜想 ;丙的合理猜想 。
(4)【实验验证】乙同学针对自己的猜想进行了如下实验:
实验步骤
实验现象
实验结论
取样于试管中,滴入几滴稀盐酸
没有气体产生
猜想不成立
你认为乙同学的实验结论是否正确? ,其理由是 。
(5)【继续探究】请你设计实验方案确定滤液中溶质的组成。
实验操作
实验现象
实验结论
2.(9分)某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:[来源:Zxxk.Com]
HClLLLl来ll
Ca(OH)2
石蕊
酚酞
【提出问题】这瓶溶液是什么溶液?
【查阅资料】(1)酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳
酸钠。
(2)碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。
【提出猜想】猜想一:这瓶溶液是:氯化钠溶液;
猜想二:这瓶溶液是:碳酸钠溶液;
猜想三:这瓶溶液是:_________ 。
【实验验证】为了验证上述猜想是否正确,该兴趣小组的同学进行了如下实验探究活动
实验一:验证猜想一和猜想二
序号
实验操作
主要实验现象
实验结论和解释
①
取少量该溶液于一支试管中,向其中滴加2—3滴无色酚酞试液。
无色酚酞试液变红
该溶液不可能是____。理由是____。
②
另取少量该溶液于一支试管中,向其中滴加足量的稀盐酸。
__________________。
溶液中一定含有的溶质是碳酸钠,有关反应的化学方程式为_________。
由此,兴趣小组的同学得出结论:该溶液是碳酸钠溶液。你认为,该结论是否正确?理由是____________________________________________。
实验二:验证猜想三
实验操作
主要实验现象
实验结论和解释
_______________________。
_______________________。
该溶液是氢氧化钠溶液。
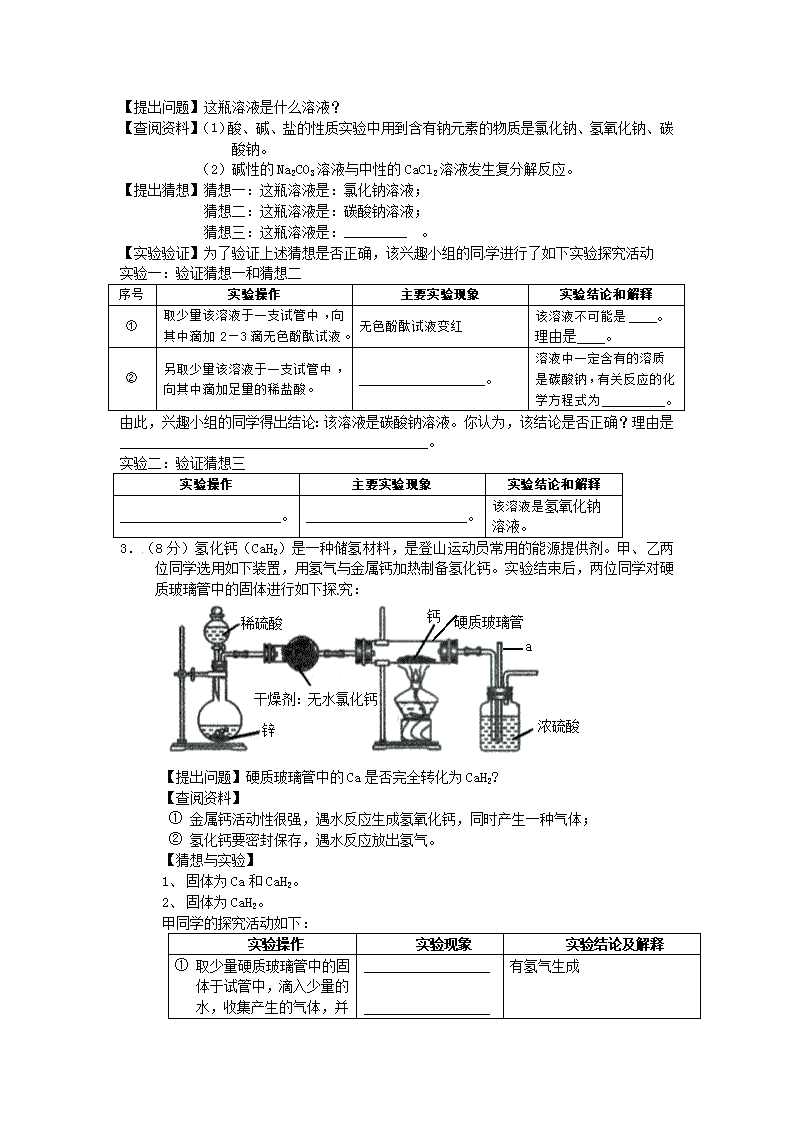
硬质玻璃管
3.(8分)氢化钙(CaH2)是一种储氢材料,是登山运动员常用的能源提供剂。甲、乙两位同学选用如下装置,用氢气与金属钙加热制备氢化钙。实验结束后,两位同学对硬质玻璃管中的固体进行如下探究:
干燥剂:无水氯化钙
浓硫酸
钙
锌
稀硫酸
a
【提出问题】硬质玻璃管中的Ca是否完全转化为CaH2?
【查阅资料】
① 金属钙活动性很强,遇水反应生成氢氧化钙,同时产生一种气体;
② 氢化钙要密封保存,遇水反应放出氢气。
【猜想与实验】
1、 固体为Ca和CaH2。
2、 固体为CaH2。
甲同学的探究活动如下:
实验操作
实验现象
实验结论及解释
有氢气生成
① 取少量硬质玻璃管中的固体于试管中,滴入少量的水,收集产生的气体,并用燃着的木条点燃
② 继续向溶液中滴加酚酞
呈红色
生成 (填化学式)
甲同学的结论:猜想1正确,固体为Ca和CaH2。
【实验反思】
乙同学认为由以上探究活动还不能得出猜想1正确,理由是 。请你帮助乙设计实验,写出主要的实验步骤、现象和相应的结论:
。
【反思讨论】
(1)写出CaH2与水反应的化学方程式 。
(2)登山运动员常用氢化钙固体作能源提供剂,与氢气相比,其优点是 。
4. (7分) 在化学实验技能考试中,有一题目是鉴别氢氧化钙溶液和氢氧化钠溶液,某同学进行了如下图所示的实验。
⑴写出试管②中反应的化学方程式: 。
⑵当看到不同现象时停止通气体,将两支试管中的废液倒入同一个干净的烧杯中,并将废液进行过滤,同学们对滤液成分进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【查阅资料】①氯化钙溶液呈中性;
②Na2CO3+CaCl2=CaCO3↓+2NaCl
【猜想假设】 甲同学认为:只含有氢氧化钠
乙同学认为:只含有碳酸钠;
丙同学认为:含有氢氧化钠和氢氧化钙;
丁同学认为:含有氢氧化钠、碳酸钠和氢氧化钙;
你认为还可能是 (写一种猜想)。
【分析讨论】你认为哪位同学的猜想不合理说明理由____________________________。
【实验设计】设计一个简单的实验证明你的猜想正确。
实验步骤
实验现象
实验结论
取滤液于试管中,
猜想正确
【实验分析】甲同学针对自己的猜想进行了如下实验:
实验步骤
实验现象
实验结论
取样于试管中,滴入少量稀盐酸
无明显现象
猜想成立
你认为甲同学对实验结果判断是否正确?请说明理由。
【反思拓展】
下列实验方法可以区分氢氧化钠和氢氧化钙两种固体的是 (填字母)。
A.放置在空气中 B.观察颜色 C.加水溶解 D.利用溶解性
5.(7分)漂白液是家庭常用的洗涤剂。化学兴趣小组的小明同学在家发现半瓶敞口放置的漂白液,对漂白液的漂白原理和该漂白液是否失效产生了疑问。他将该漂白液带到学校,在老师的指导下,与小组同学一起进行了探究。
【查阅资料】
① 漂白液的制取原理:Cl2+2NaOH NaClO+NaCl+H2O,其有效成分是NaClO。
② 漂白液的漂白原理:
NaClO在空气中发生反应:2NaClO+H2O+CO2 ==== Na2CO3+2HClO。
生成的HClO能使有色布条(含有机色素)褪色。
③ HClO不稳定,易分解,分解后丧失漂白作用。
④ 碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应,写出该反应的化学方程式 。
【提出问题1】该漂白液是否失效?
【实验探究1】请将下述实验报告填写完整。
实验操作
实验现象
实验结论
该漂白液已完全失效
【提出问题2】该漂白液的主要成分是什么?
【提出猜想】该漂白液的主要成分可能是:
① NaCl ② ③ NaCl、Na2CO3、NaOH
【实验探究2】[来源:学科网]
实验操作及实验现象
实验结论
取少量该漂白液于试管中,加入过量的稀盐酸。观察到
猜想①不合理
______________
猜想③不合理,②合理
【实验反思】漂白液开瓶后要尽快使用,每次使用后要拧紧瓶盖。
6.(8分)(1)某实验小组在研究二氧化碳的性质时,根据下图进行实验。
请回答:A中的现象是_______________,B中反应的化学方程式是___________________。
(2)该小组利用对比的方法研究二氧化硫的性质,
进行如下探究。
【提出问题】二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与某些有色物质(如品红溶液)反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在。
【实验探究】实验装置如右图所示。
置C中紫色石蕊溶液变红,是由于二 氧化硫与水反应生成了亚硫酸(H2SO3);装置D中澄清石灰水变浑浊,该反应的化学方程式是_____________________。
②装置E的试管中溶液变无色,取该溶液加热,溶液又变为红色,其原因是______。
③此装置有一个明显的不足之处是____________。
④活性炭也能使品红溶液褪色,其褪色原理与二氧化硫
使品红溶液褪色的原理不相同,其理由是__________。
【反思提高】某同学将二氧化硫通入到紫色的酸性高锰酸钾溶液中,观察到溶液由紫色变为无色,由此他得出的结论是:二氧化硫能将酸性高锰酸钾溶液漂白。请你设计实验证明此结论是否正确(要求写出操作、现象、结论):________________。
二氧化硫与二氧化碳有相似的化学性质,但二氧化硫还具有某些特殊的化学性质。
7.(8分)用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊。针对此现象,同学们提出了自己的想法。
[查资料]稀盐酸与AgNO3溶液发生复分解反应,AgCl为白色且难溶于水。
[假设] 小明的假设:澄清石灰水已变质。
小白的假设:气体X中除了有CO2外,还有 。
[实验探究](1)小明的探究:
实验目的
实验步骤
可能的实验现象
化学方程式和实验结沦
探究所用
澄清石灰
水是否变
质
①用一支试管另取少量原澄清石灰水
②取稀硫酸与碳酸钠反应制取CO2
③
步骤③中现象为:
步骤②中反应方程式为:
实验结论:所用的澄清石灰水没有变质。
(2)小白的探究
实验目的
实验步骤
实验现象
化学方程式和实验结论
探究小白的假设是否成立
将气体X通入AgNO3溶液
反应方程式为:
实验结论:小白的假设成立
[实验反思]
(3)同学们经过讨论发现,用下面实验装置就可以同时完成上述两个假设的探究。
A B C
A、B中都加AgNO3溶液,通X气体后:如果A浑浊、B澄清、C浑浊,结论是 ;如果看到 现象;小明和8.(8分)已知草酸(H2C2O4)在加热条件下会发生分解反应,同学们对生成物产生了浓厚的兴趣,于是用实验的方法对生成的物质进行探究。
【提出猜想】产生的气体是一氧化碳、二氧化碳和水蒸气的混合物。
【查阅资料】(1)碱石灰是固体氢氧化钠和氧化钙的混合物。(2)H2在高温条件下可以还原氧化铁。
石灰水
草酸
浓硫酸
Fe2O3
石灰水
碱石灰
【实验过程】同学们经过讨论设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。
A B C D E
(1)观察到装置D中产生的现象为 _______________。
(2)装置C的作用为吸收混合气体中的水和二氧化碳,其中氧化钙与水反应的化学方程式为 ___________ 。
(3)观察到装置B中澄清石灰水变浑浊,写出此反应的化学方程式 _______ ,由此得出的结论为 ________ 。又知装置C的质量增加了,E中石灰水变浑浊了,并结合上述实验现象,某同学得出了结论。
【得出结论】同学认为猜想正确,请写出草酸分解的方程式 _____________ 。
【反思与评价】
(1)根据上述实验现象,有的同学认为草酸分解不一定生成CO。你认为他的看法是否合理?
原因是 。
(2)有同学认为上述实验中还有不合理的地方,你认为下列建议正确的是 。(填数字序号)
①应在装置A、B之间增加检验水蒸气的装置
②应在装置E后增加尾气处理装置
③可将装置C换成装有浓硫酸的洗气瓶
④可在装置C、D之间增加盛有澄清石灰水的洗气瓶
9.(7分)学习了CO2的有关知识之后,同学们查阅资料发现Mg能在CO2中燃烧:
2Mg + CO2 ==== 2MgO + C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。
【提出猜想】钠能发生类似于CO2与镁的反应,可能的化学方程式为:
。
【实 验】将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧。
进一步【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH。
②室温下部分酸碱盐的溶解性表(氯化钡溶液呈中性)
Ba2+
Ca2+
Na+
Cu2+
OH–
溶
微
溶
不
CO32-
不
不
溶
不
Cl-
溶
溶
溶[来源:学科网]
溶
基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
① Na2O、C ② 、C ③ NaOH、C ④ Na2O、Na2CO3、C
通过理论分析,猜想 (填序号)肯定是错误的。
步骤
实验操作
主要实验现象
结论(燃烧产物判断)
(1)
取少量产物于试管中,加适量水中,振荡,静止
_______________
燃烧产物中肯定有炭
(2)
取(1)所得少量上层清液,加入
_______________
________________
(3)
_______________________________________________
_______________
________________
【验证猜想】(最终猜想④是正确的)
催化剂
△
在步骤(3)中也可以通过加入 试剂的方法进行检验(任写一种与(3)中所加不同种类的试剂)。
【结 论】猜想④正确。金属钠着火不能用二氧化碳灭火。
10.(6分)化学兴趣小组同学发现实验台上按如下顺序摆放着
7瓶不同的无色溶液(如图所示),其中4、5号试剂瓶标签破损。
1 2 3 4 5 6 7
【提出问题】这两瓶试剂的成分分别是什么?
【查阅资料】①碱性的亚硫酸钠(Na2SO3)溶液、Na2CO3溶液与中性的CaCl2溶液均可发生复分解反应,产生白色沉淀。
②Na2SO3 + 2HCl=2NaCl + SO2↑ + H2O。
③CO2与SO2均可以使澄清石灰水变浑浊。
【作出猜想】根据受损标签的信息,推测4、5号溶液可能分别是NaOH溶液、Na2CO3溶液、Na2SO3溶液或NaCl溶液中的一种。
【实施方案】各取少量4、5号溶液于试管中,分别进行下列两组实验。
实验操作
实验现象
实验结论
滴加适量___号溶液
实验1
溶液均由无色变成红色
4、5号溶液均不可能是上述猜想中的 溶液。
滴加适量3号溶液
实验2
均产生白色沉淀
4、5号溶液可能分别是Na2SO3溶液和Na2CO3溶液中的一种。写出其中一个反应的化学方程式 _______。
【继续实验】为了进一步确定4、5号溶液的成分,同学们分别取少量4、5号溶液于试管中继续实验。
实验操作
实验现象
实验结论
滴加适量2号溶液
__________________
4号溶液是Na2CO3溶液
5号溶液是Na2SO3溶液。
【实验反思】同学们经过分析认为4号溶液还可能是变质的NaOH
溶液。于是设计了以下实验方案进行验证。请完成下列实验报告。
实验操作
实验现象
实验结论
4号溶液是部分变质的NaOH溶液。
11.(7分)小立在家洗衣服时,发现一瓶刚过期的漂白液,对漂白液的漂白原理和该漂白液是否还有漂
白作用产生了疑问.于是将其带到学校,在老师的指导下,与小组同学一起展开探究.
【查阅资料】
①制取漂白液的原理:Cl2+2NaOH═NaClO+NaCl+H2O,其中有效成分是NaClO;
②漂白液的漂白原理:NaClO 在空气中很快发生反应:2NaClO+H2O+CO2═Na2CO3+2HClO
生成的HClO 能使有色布条(含有机色素)褪色;
③HClO 不稳定,易分解,分解后丧失漂白作用.
④Na2CO3 + CaCl2 ═ CaCO3↓ + 2NaCl
【提出问题】刚过期的漂白液是否失效?
【实验探究】该小组的实验报告如下:
实验操作
实验现象
实验结论
取适量该漂白液于试管中,_________________
_____________________
该漂白液已完全失效
小组同学对失效后漂白液的主要成分很感兴趣,纷纷提出猜想并作进一步探究.
【提出猜想】小立猜想有:NaCl
小英猜想有:NaCl、Na2CO3
小洁猜想有:NaCl、Na2CO3、NaOH
【设计方案】
小组同学经过讨论,认为用足量的稀盐酸就可以验证 的猜想是否成立.
为验证另两位同学的猜想,他们设计了如下方案:
实验步骤
预期实验现象
实验目的或预期结论
步骤①;取少量该漂白液于试管中,加入________ ,静置,观察
产生白色沉淀
目的:________________
步骤②:取上层清液于试管中, ______________,观察
________________________
结论:_________猜想成立;
否则,另一位同学猜想成立.
最后,他们综合小组同学的设计,经实验得出了结论.
12.(8分)氢氧化钠与酸、二氧化碳反应没有明显现象。小军和小晴两位同学想用实验证明氢氧化钠能与盐酸、二氧化碳反应,他们做了以下探究过程。
【查阅资料】通常状况下,1体积水能溶解1体积二氧化碳。
【设计实验】小军设计了两个实验进行验证,请你帮他完成下列实验报告。
【反思交流】小晴认为:小军设计的上述两个实验都有缺陷,不足以证明氢氧化钠能与盐酸和二氧化碳反应。请你分析:
(1)小军的第一个实验的缺陷是________________,应改为_____________。
(2)小晴用上述小军第二个实验的装置和药品,验证氢氧化钠可以与二氧化碳反应,她的设计方案是:分别量取40mLNaOH 和Ca(OH)2 溶液放入A、B 中,_______________________________________,
此实验可以说明氢氧化钠和二氧化碳发生了反应。。
【实验结论】通过小晴的实验,证明了氢氧化钠可以与盐酸和二氧化碳反应。