- 211.89 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017年福建省初中毕业暨高中阶段招生考试
化学试题
(满分:100分 考试时间:60分钟)
友情提示:请把所有答案填涂(写)到答题卡上!请不要错位,越界答题!!
姓名 准考证号
可能用到的相对原子质量:H-1 N-14 O—16 S-32 Fe-56 Cu-64
第I卷(选择题)
本卷共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一个选项符合题目要求。
1.下列可供人呼吸的气体是
A.氧气 B.氢气 C.氮气 D.二氧化碳
2.人体缺乏某种元素会导致骨质疏松症,该元素是
A.铁 B.碘 C.钙 D.锌
3.中药砒霜的主要成分为三氧化二砷( As2O3),可用于治疗肿瘤。其中砷元素的化合价为
A.-3 B.+3 C.-2 D.+2
4.下列人体体液中,酸性最强的是
A.唾液(pH约6.6~7.1) B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4) D.血液(pH约7.35~7.45)
5.下列四支试管小,铁钉锈蚀最快的是
6.欲配制10.0%的NaCI溶液50 g,部分操作如下图所示,正确的是
7.十八世纪,拉瓦锡用放大镜聚集日光使玻璃罩内的金刚石燃烧,得到二氧化碳。坦南特进一步研究确认金刚石仅由碳元素组成。下列说法错误的是
A.金刚石属于有机物 B.金刚石燃烧过程放出热量
C.金刚石具有可燃性 D.聚集日光使温度达到金刚石的着火点
8.炼铁炉中某反应的微观示意图(不同的球代表不同原子)如下所示。下列说法正确的是
A.该反应属于化合反应 B.反应前后原子数目发生变化
C.反应前后各元素化合价均不变 D.反应前后元素种类发生变化
9.右图是甲、乙两种固休物质的溶解度曲线。下列说法错误的是
A. t1℃时,25g甲充分溶解于100g水中,配得甲的饱和溶液
B. t2℃时,甲、乙饱和溶液的溶质质量分数相等
C.若甲中含有少量乙,可用溶解、过滤的方法提纯甲
D.将甲的饱和溶液从t2℃ 降温到t1℃,可析出晶体
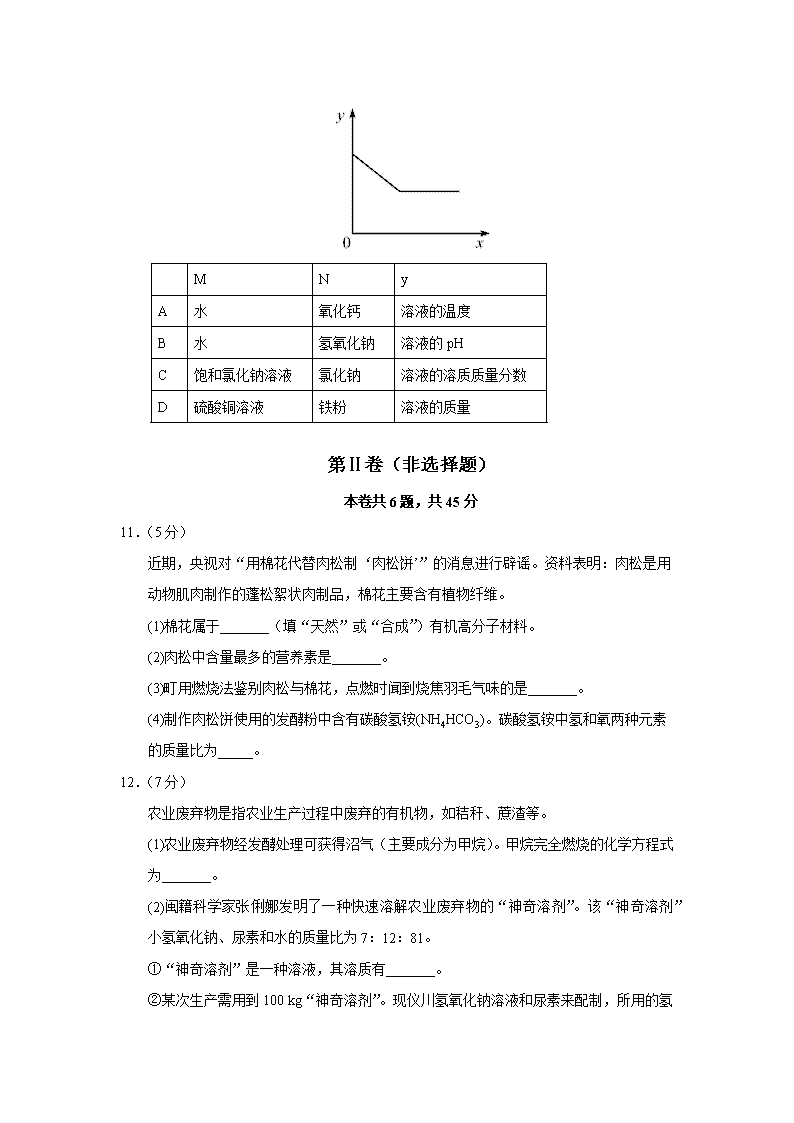
10.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。右下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是
M
N
y
A
水
氧化钙
溶液的温度
B
水
氢氧化钠
溶液的pH
C
饱和氯化钠溶液
氯化钠
溶液的溶质质量分数
D
硫酸铜溶液
铁粉
溶液的质量
第Ⅱ卷(非选择题)
本卷共6题,共45分
11.(5分)
近期,央视对“用棉花代替肉松制‘肉松饼’”的消息进行辟谣。资料表明:肉松是用动物肌肉制作的蓬松絮状肉制品,棉花主要含有植物纤维。
(1)棉花属于_______(填“天然”或“合成”)有机高分子材料。
(2)肉松中含量最多的营养素是_______。
(3)町用燃烧法鉴别肉松与棉花,点燃时闻到烧焦羽毛气味的是_______。
(4)制作肉松饼使用的发酵粉中含有碳酸氢铵(NH4HCO3)。碳酸氢铵中氢和氧两种元素的质量比为_____。
12.(7分)
农业废弃物是指农业生产过程中废弃的有机物,如秸秆、蔗渣等。
(1)农业废弃物经发酵处理可获得沼气(主要成分为甲烷)。甲烷完全燃烧的化学方程式为_______。
(2)闽籍科学家张俐娜发明了一种快速溶解农业废弃物的“神奇溶剂”。该“神奇溶剂”小氢氧化钠、尿素和水的质量比为7:12:81。
①“神奇溶剂”是一种溶液,其溶质有_______。
②某次生产需用到100 kg“神奇溶剂”。现仪川氢氧化钠溶液和尿素来配制,所用的氢
氧化钠溶液的溶质质量分数为_______(列出计算式即可)。
③利用该“神奇溶剂”溶解农业废弃物生产的新型纤维素膜,在土壤中能完全降解。利用此膜替代普通塑料,可缓解的环境问题是_______(写一点)。
13.(6分)
模型是联系宏观与微观的桥梁。
(1)右图是钠原子结构示意图。
①x的数值为_______。
②“11”指的是_______。
③钠原子在化学反应中易失去1个电子,形成_______(填离子符号)。
(2)下图是氢分子和氧分子运动的示意图。
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是______(填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与______有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例:________。
14.(7分)
右图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)A不可能是______(填标号)。
a.Mg b.Fe c.Ag d.Zn
(2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为______。
(3)若C为碳酸钠
①C与D的反应属于______(填基本反应类型)。
②D与盐酸反应的化学方程式为______(写一个)。
③将二氧化碳通入C溶液,可化合生成碳酸氢钠( NaHCO3),该反应的反应物有______种。
15.(15分)
(1)化学小组选用下图装置制取并收集氧气。
①仪器的名称:a是______,b是______。
②实验事制取氧气的化学方程式为______(写一个),实验时对应的气体发生和收集装置分别是______(填标号,下同)和______。
(2)碘化钾(KI)足白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料:
I.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2= 2K2CO3+2I2
乙:4KI+O2+2H2O=4KOH+2I2
Ⅱ.KOH与NaOH的化学性质相似。
为探究碘化钾变质原理的合理性,开展以下实验。
【实验过程】
[实验1]
取适量碘化钾固体暴露于空气小一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
①石灰水变浑浊的原冈是______(用化学方程式表示)。
②化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____。
[实验2]
按右上图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
③据此现象,可得出的结论是______。
[实验3]
按右下图所示装置进行实验,数日后,观察到碘化钾同体无泛黄现象。
查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。化学小组据此改进实验,很快观察到固体泛黄的现象。
④简述化学小组改进实验的具体措施:___________。
【实验结论】
⑤根据上述实验,化学小组得出结论:碘化钾固体泛黄变质是碘化钾与_____共同作用的结果。
16.(5分)
“人工固氮”每年能生产11.9亿吨氨(NH3),反应原理为:
N2+3H22NH3。
(1)根据化学方程式计算:“人工固氮”每年固定氮气的质量是多少?
(2)每年全球“雷电固氮”约能固定0.98亿吨氮气,“人工固氮”固定氮气的质量相当于“雷电固氮”的____倍。
2017年福建省初中毕业暨高中阶段招生考试
化学答案
第I卷(选择题)
本卷共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一个选项符合题目要求。
1.A 2.C 3.B 4.B 5.D 6.D 7.A 8.A 9.C 10.D
第Ⅱ卷(非选择题)
本卷共6题,共45分
11.(5分)
(1)天然 (2)蛋白质 (3)肉松 (4)5:48
12.(7分)
(1)CH4+2O2CO2+2H2O
(2)①氢氧化钠、尿素(或其他合理答案);②(或其他合理答案);③白色污染(或其他合理答案)
13.(6分)
(1)①8;②钠原子的质子数为11(或其他合理答案);③Na+
(2)①BC;②分子种类(或其他合理答案);③湿衣服在阳光下比在阴凉处干得快(或其他合理答案)
14.(7分)
(1)c;(2)Fe2O3+6HCl= 2FeCl3+3H2O;(3)①复分解反应;
②2HCl+Ca(OH)2= CaCl2+2H2O(或“2HCl+Ba(OH)2= BaCl2+2H2O”);③3
15.(15分)
(1)①试管 酒精灯
②2KMnO4K2MnO4+MnO2+ O2↑(或“2H2O22H2O+O2↑”等其他合理答案);
A(或“B”)
说明:气体发生装置与化学方程式相对应才得分:没写化学方程式只填气体发生装置不
得分
D
(2)①CO2+Ca(OH)2=CaCO3↓+H2O
②无法判断K2CO3是按反应甲原理产生,还是按反应乙原理生成的KOH吸收空气中的CO2而产生的(或其他合理答案)
③反应乙不是造成碘化钾泛黄的原因(或其他合理答案)
④往瓶中再加入少量水(或其他舍理答案)
⑤氧气、水和二氧化碳
16.(5分)(1)9.8亿吨;(2)10