- 180.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013年高考广东理综化学及答案
7.下列说法正确的是
A.糖类化合物都具有相同的官能团 B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇 D.蛋白质的水解产物都含有羧基和羟基
8.水溶解中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO B.H+、Na+、Fe2+、MnO
C.K+、Ca2+、Cl-、NO D. K+、NH、OH-、SO
9.设nA为阿佛加德罗常数的数值,下列说法正确的是
A.常温常压下,8gO2含有4nA个电子
B.1L0.1molL-1的氨水中有nA个NH
C.标准状况下,22.4L盐酸含有nA个HCl分子
D.1molNa被完全氧化生成Na2O2,失去个2nA电子
10.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项
叙述I
叙述I
A
NH4Cl为强酸弱碱盐
用加热法除去NaCl中的NH4Cl
B
Fe3+具有氧化性
用KSCN溶液可以鉴别Fe3+
C
溶解度:CaCO3<Ca(HCO3)2
溶解度:Na2CO3<NaHCO3
D
SiO2可与HF反应
氢氟酸不能保存在玻璃瓶中
11.下列措施不合理的是
A.用SO2漂白纸浆和草帽辫 B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅 D.用Na2S作沉淀剂,除去废水中Cu2+和Hg2+
12.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0molL-1
B.饱和小苏打溶液中:c(Na+)=c(HCO)
C.饱和食盐水中:c(Na+)+ c(H+)=c(Cl-)+c(OH-)
X T Z
R
Q
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
22.元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:ZQ
23.下列实验的现象与对应结论均正确的是
选项
操作
现象
结论
A
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有脱水性和强氧化性
B
常温下将Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
C
将一小块Na放入无水乙醇中
产生气泡
Na能置换出醇羟基中的氢
D
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
OH
CH=CHCHCH3
反应①:
CH3C-CHCOOCH2CH3
O
CH=CHCHCH3
一定条件
CH3C-CH2COOCH2CH3+
O
I
II
30.(16分)脱水偶联反应是一种新型的直接烷基化反应,例如:
‖
O
(1)化合物I的分子式为_____,1mol该物质完全燃烧最少需要消耗_____mol O2.
(2)化合物Ⅱ可使____溶液(限写一种)褪色;化合物III(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为
(3)化合物III与NaOH乙醇溶液共热生成化合物IV,IV的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1∶1∶1∶2,IV的结构简式为 .
与
CH
OH
Br
C≡CH
≡
(4)由CH3COOCH2CH3可合成化合物I。化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ. Ⅴ的结构简式为 ,Ⅵ的结构简式为 .
(5)一定条件下, 也可以发生类似反应①的反应,有机产物的结构简式为_____.
31.(16分)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+ H+(aq)=HOI (aq) △H2
③HOI (aq)+ I-(aq)+ H+(aq)=I2(aq)+H2O(l) △H3
总反应的化学方程式为 ,其反应△H=
(2)在溶液中存在化学平衡:I2(aq) + I-(aq)I(aq),其平衡常数表达式为 .
c(I-3) /10-3mol·L-1
(3,3.5)
(10,8.8)
(18,11.8)
(33,6.5)
第2组
第1组
t / s
(3)为探究Fe2+对氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I浓度和体系pH,结果见图14和下表。
编号
反应物
反应前
反应后
第1组
O3+ I-
5.2
11.0
第2组
O3+ I-+Fe2+
5.2
4.1
①Ⅰ组实验中,导致反应后pH升高的原因是 .
②图13中的A为 由Fe3+生成A的过程能显著提高I-的转化率,原因是 .
③第2组实验进行18s后,I下降。导致下降的直接原因有(双选) .
A.c(H+)减小 B.c(I-)减小 C.I2 (g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3-13s内第2组实验中生成I的平均反应速率(写出计算过程,结果保留两位有效数字)。
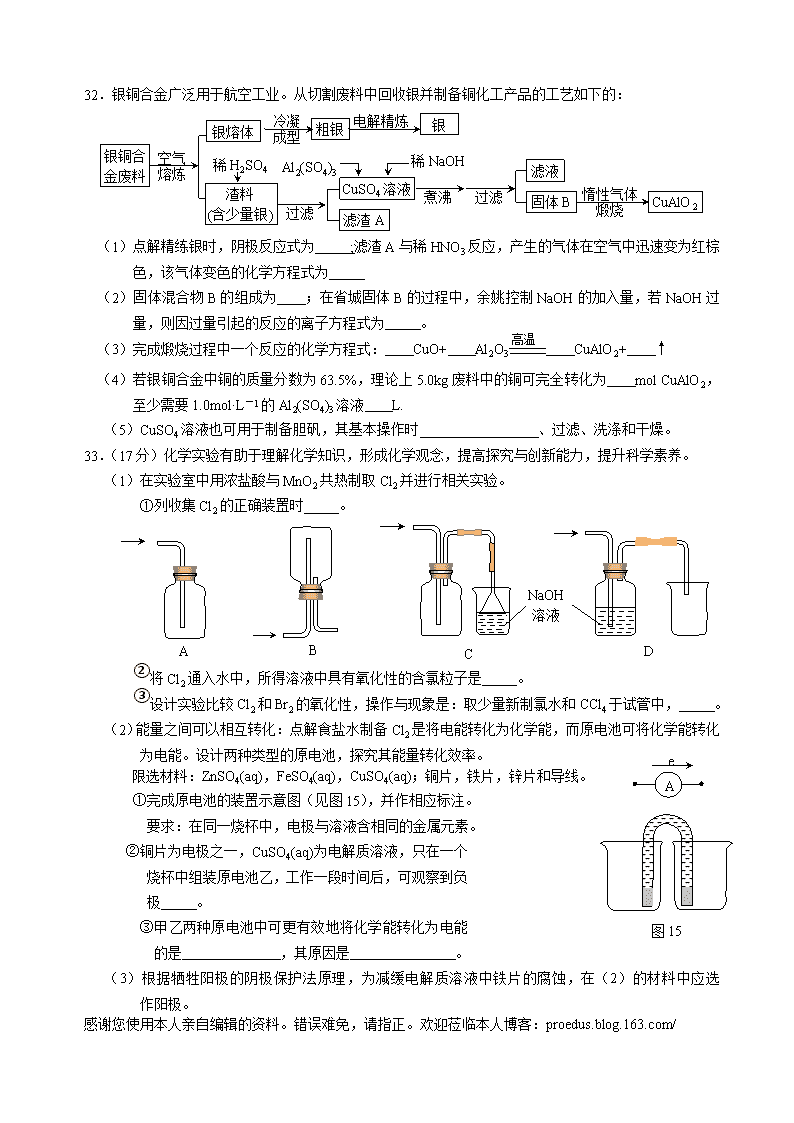
32.银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下的:
银熔体
银铜合金废料
空气
熔炼
粗银
银
冷凝
成型
电解精炼
渣料
(含少量银)
过滤
CuSO4溶液
煮沸
过滤
滤液
固体B
惰性气体
煅烧
CuAlO2
滤渣A
Al2(SO4)3
稀NaOH
稀H2SO4
(1)点解精练银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为
高温
(2)固体混合物B的组成为 ;在省城固体B的过程中,余姚控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3 CuAlO2+ ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L.
(5)CuSO4溶液也可用于制备胆矾,其基本操作时 、过滤、洗涤和干燥。
33.(17分)化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①列收集Cl2的正确装置时 。
A
B
NaOH
溶液
D
C
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
e-
A
图15
(2)能量之间可以相互转化:点解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
感谢您使用本人亲自编辑的资料。错误难免,请指正。欢迎莅临本人博客:proedus.blog.163.com/
7、B 8、C 9、A 10、D 11、B 12、C 22、BD 23、AC
30(1)C6H10O3,7mol
(2)酸性高锰酸钾溶液,+NaOH+NaCl
-CH
Br
C≡C
≡
CH=CHCH=CH2
(3)
OHCCH=CHCHO
OH
CH2CH=CHCH2
OH
(4) (5)
31、(1) O3+2I-+2H+=I2+ O2+ H2O,△H=△H1+△H2+△H3。
(2)
(3)反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;Fe3+,BD
(4)(计算过程略)5.5×104 mol/(L·s)
32、(1)Ag++e-= Ag,2NO+O2=2 NO2 (2)CuO和Al(OH)3,Al(OH)3+OH-= AlO-+2H2O
(3)4CuO+2Al2O34CuAlO2+O2↑ (4)25.0L (5)蒸发浓缩、冷却结晶
33、(1)C;Cl2、HClO和ClO-;取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加NaBr溶液,振荡静置,溶液下层呈橙色
(2)(装置图如下);电极逐渐溶解;甲;可以避免活泼金属如Zn和CuSO4的接触,从而提供稳定电流
(3)Zn
相关文档
- 专题04 弄懂功和能,物理大题不再愁-2021-05-1311页
- 三年高考20162018数学理真题分项版2021-05-134页
- (浙江专用)2020版高考物理大二轮复习2021-05-1313页
- 2011高考数学试卷分析2021-05-139页
- 高考数学—江苏卷Word含详细答案2021-05-1314页
- 对课改后高考物理试题的分析侧重新2021-05-137页
- 全国高考语文试题及答案新课标卷2021-05-1310页
- 2020版高考英语一轮基础达标选题 U2021-05-138页
- 高考物理考前三个月专题训练物理图2021-05-138页
- 巩固练习高考总复习主语从句及宾语2021-05-137页