- 372.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010年普通高等学校招生全国统一考试(重庆卷)
理科综合能力测试试题卷
以下数据可提供解题的参考:
相对原子质量:H1 C 12 O 16 Cu 40
第一部分(选择题共126分)
本部分包括21小题,每小题6分,共126分,每小题只有一个选项符合题意
6.减缓温室气体排放是2009年哥本哈根气候变化 会议的议题,下列反应不产生温室气体的是
A 用纯碱制玻璃 B,用煤炭作燃料
C 用铁矿石炼铁 D. 用氨制碳酸铵
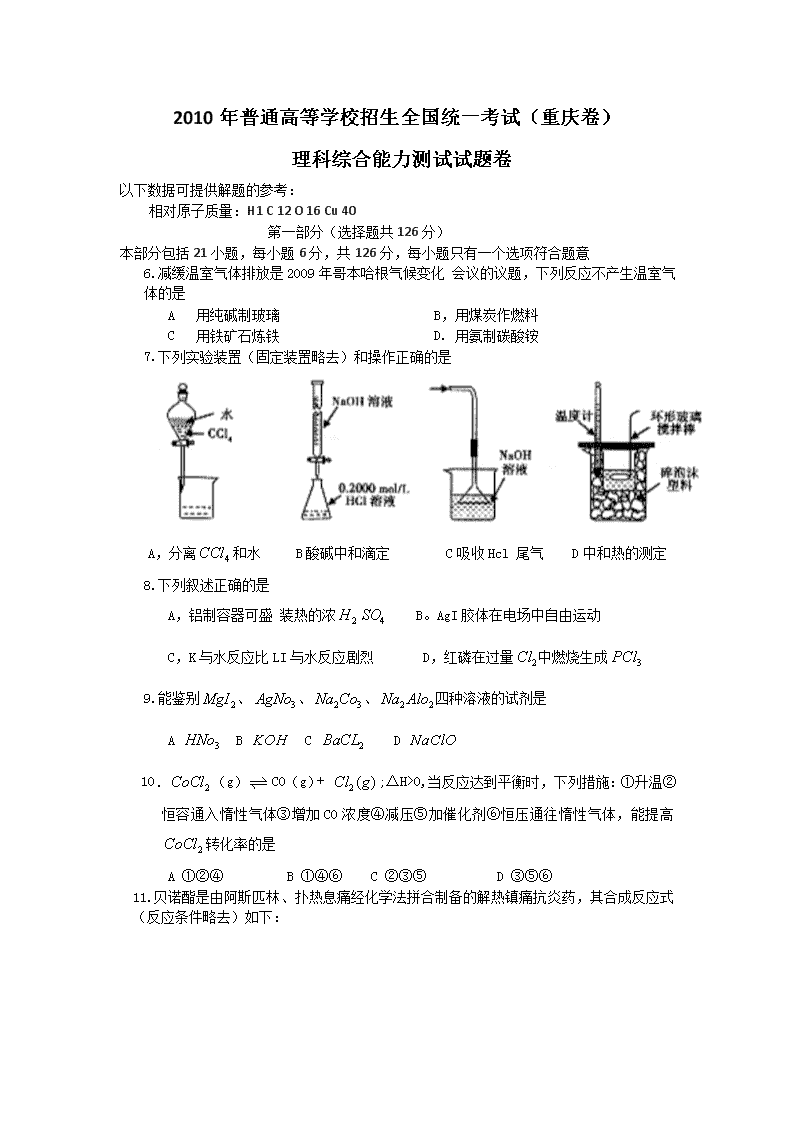
7.下列实验装置(固定装置略去)和操作正确的是
A,分离和水 B酸碱中和滴定 C吸收Hcl 尾气 D中和热的测定
8.下列叙述正确的是
A,铝制容器可盛 装热的浓 B。AgI胶体在电场中自由运动
C,K与水反应比LI与水反应剧烈 D,红磷在过量中燃烧生成
9.能鉴别、、、四种溶液的试剂是
A B C D
10.(g)CO(g)+ ;△H>0,当反应达到平衡时,下列措施:①升温②恒容通入惰性气体③增加CO浓度④减压⑤加催化剂⑥恒压通往惰性气体,能提高 转化率的是
A ①②④ B ①④⑥ C ②③⑤ D ③⑤⑥
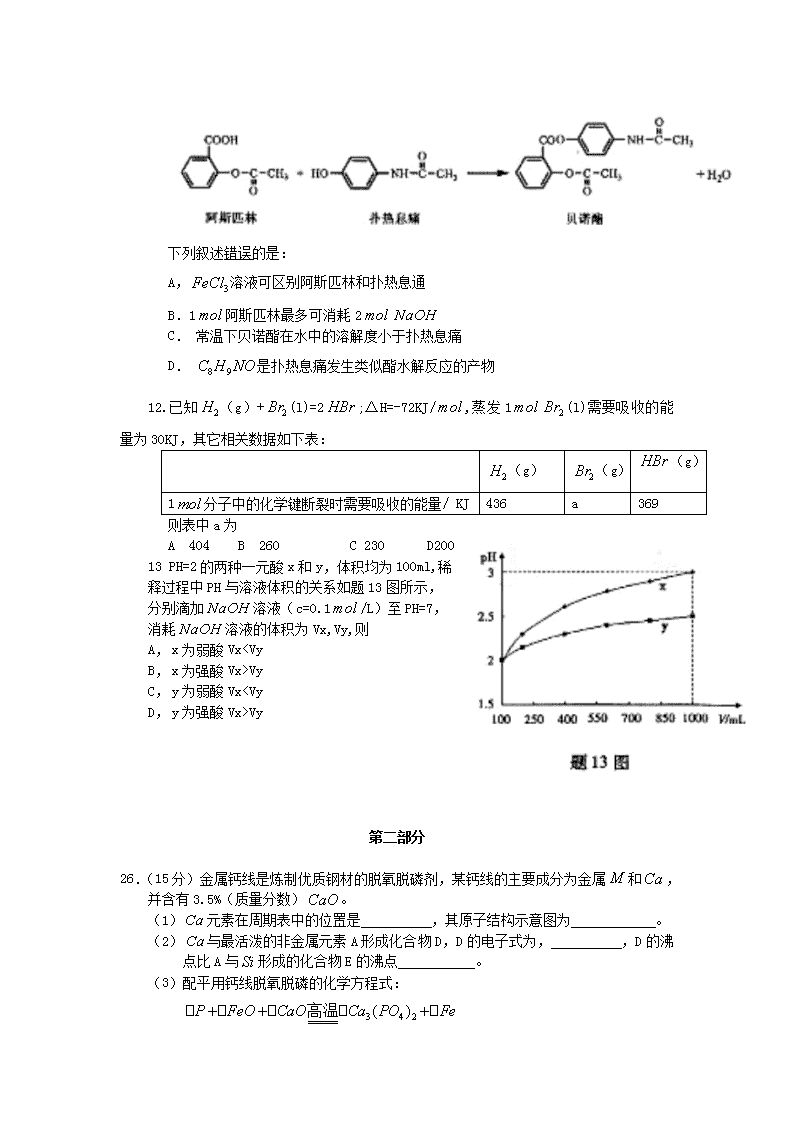
11.贝诺酯是由阿斯匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
下列叙述错误的是:
A,溶液可区别阿斯匹林和扑热息通
B.1阿斯匹林最多可消耗2
C. 常温下贝诺酯在水中的溶解度小于扑热息痛
D. 是扑热息痛发生类似酯水解反应的产物
12.已知(g)+(l)=2;△H=-72KJ/,蒸发1(l)需要吸收的能量为30KJ,其它相关数据如下表:
(g)
(g)
(g)
1分子中的化学键断裂时需要吸收的能量/ KJ
436
a
369
则表中a为
A 404 B 260 C 230 D200
13 PH=2的两种一元酸x和y,体积均为100ml,稀
释过程中PH与溶液体积的关系如题13图所示,
分别滴加溶液(c=0.1/L)至PH=7,
消耗溶液的体积为Vx,Vy,则
A, x为弱酸VxVy
C, y为弱酸VxVy
第二部分
26.(15分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属和,并含有3.5%(质量分数)。
(1)元素在周期表中的位置是 ,其原子结构示意图为 。
(2)与最活泼的非金属元素A形成化合物D,D的电子式为, ,D的沸点比A与形成的化合物E的沸点 。
(3)配平用钙线脱氧脱磷的化学方程式:
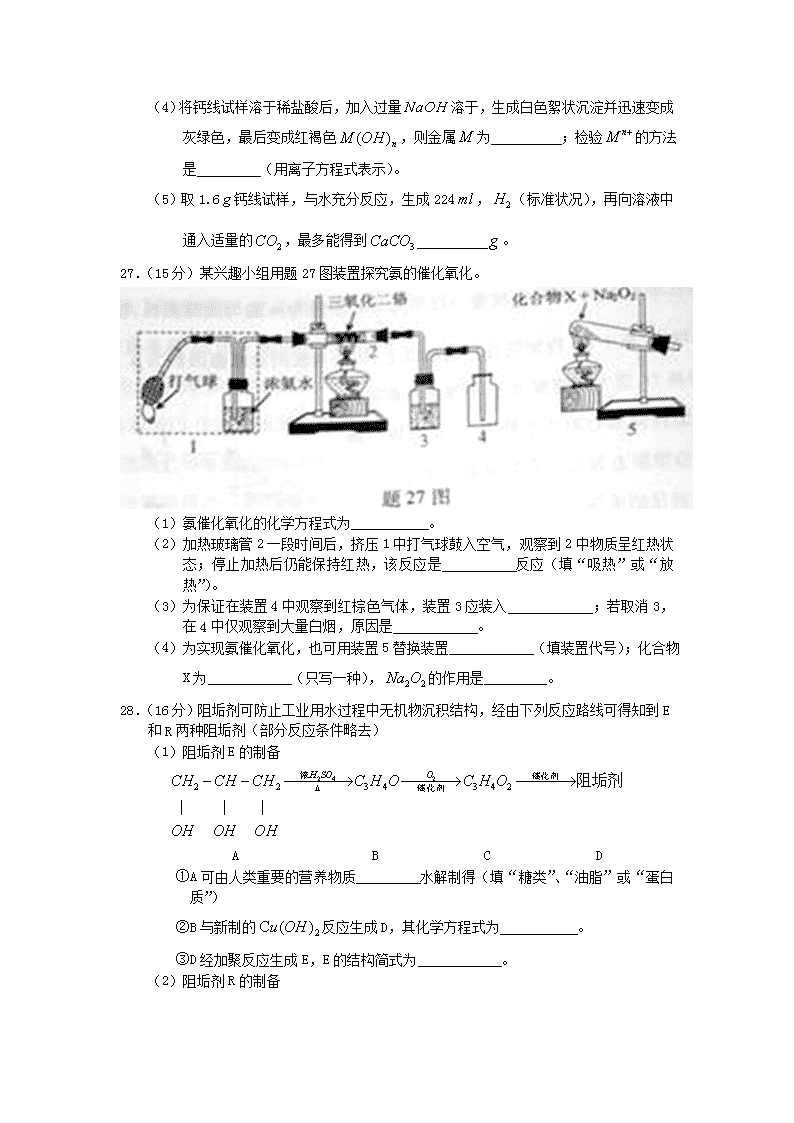
(4)将钙线试样溶于稀盐酸后,加入过量溶于,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,则金属为 ;检验的方法是 (用离子方程式表示)。
(5)取1.6钙线试样,与水充分反应,生成224,(标准状况),再向溶液中通入适量的,最多能得到 。
27.(15分)某兴趣小组用题27图装置探究氨的催化氧化。
(1)氨催化氧化的化学方程式为 。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是 反应(填“吸热”或“放热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入 ;若取消3,在4中仅观察到大量白烟,原因是 。
(4)为实现氨催化氧化,也可用装置5替换装置 (填装置代号);化合物X为 (只写一种),的作用是 。
28.(16分)阻垢剂可防止工业用水过程中无机物沉积结构,经由下列反应路线可得知到E和R两种阻垢剂(部分反应条件略去)
(1)阻垢剂E的制备
A B C D
①A可由人类重要的营养物质 水解制得(填“糖类”、“油脂”或“蛋白质”)
②B与新制的反应生成D,其化学方程式为 。
③D经加聚反应生成E,E的结构简式为 。
(2)阻垢剂R的制备
①G→J为取代反应,J的结构简式为 。
②J转化为L的过程中,L分子中增加的碳原子来源于 。
③由L制备M的反应步骤依次为:
、
(用化学方程式表示)。
④1mol Q的同分异构体T(碳链无支链)与足量溶液作用产生2mol ,T的结构简式为 (只写一种)。
29.(14分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)是接触法制硫酸的催化剂。
①一定条件下,与空气反5E94后,和物质的量浓度分别为a mol/L和b mol/L,则起始物质的量浓度为 mol/L;生成的化学反应速率为 mol/(L·min).
②全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29所示。
①当左槽溶液颜色逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和
;充电时若转移的电子数为3.01×10个,左槽溶液中的变化量为 。
答案
6---12 D A C A B B D
26.(15分)
(1)第四周期第ⅡA族,
(2) ,高
(3)2P+5FeO+3CaOCa3(PO4)2+5Fe
(4)Fe;Fe+3SCN-=Fe(SCN)3
(5)1.1g
27.(15分)
(1)4NH3+5O24NO+H2O
(2)放热
(2)浓H2SO4;生成的NO与O2反应生成NO,NO2与水反应生成HNO3,与HNO3反应生成了NH4NO3
29.(14分)
(1)②氨水
(2)①
②绿 紫
③参与正极反应,通过交换膜定向移动使电流通过溶液;0.5mol