- 153.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
原电池原理高考试题汇编
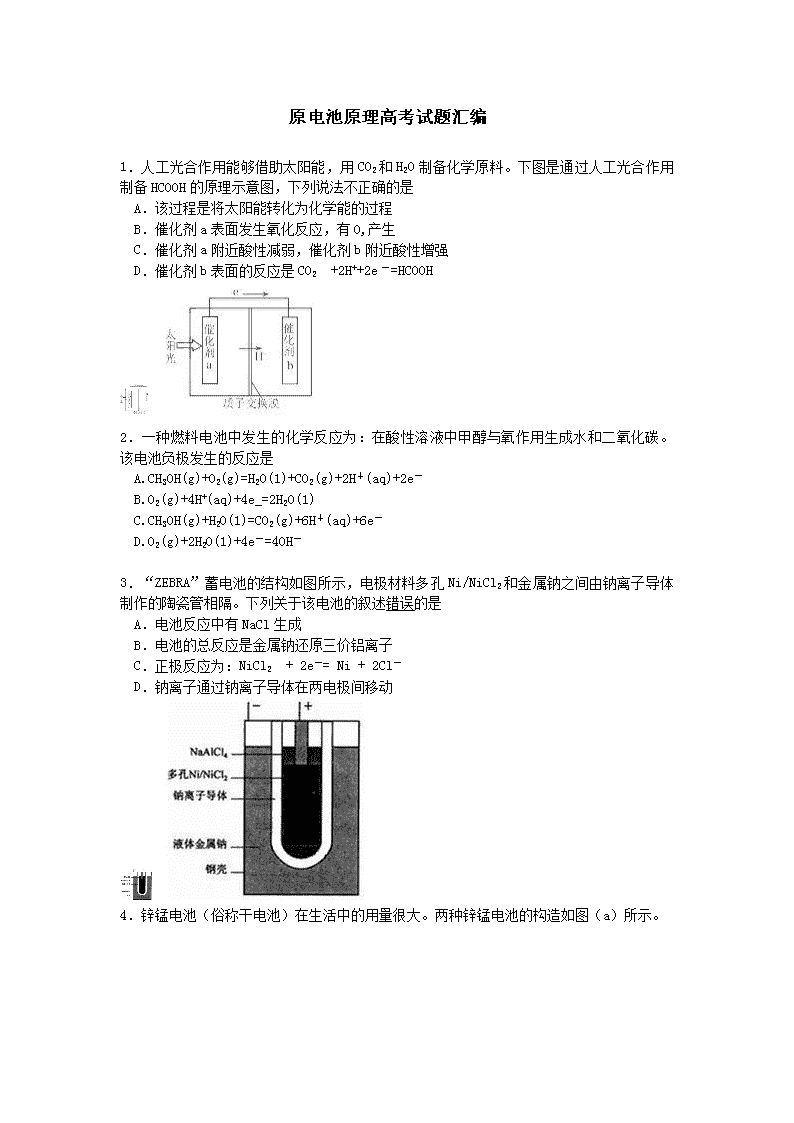
1.人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O,产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH
2.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。 该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e_=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
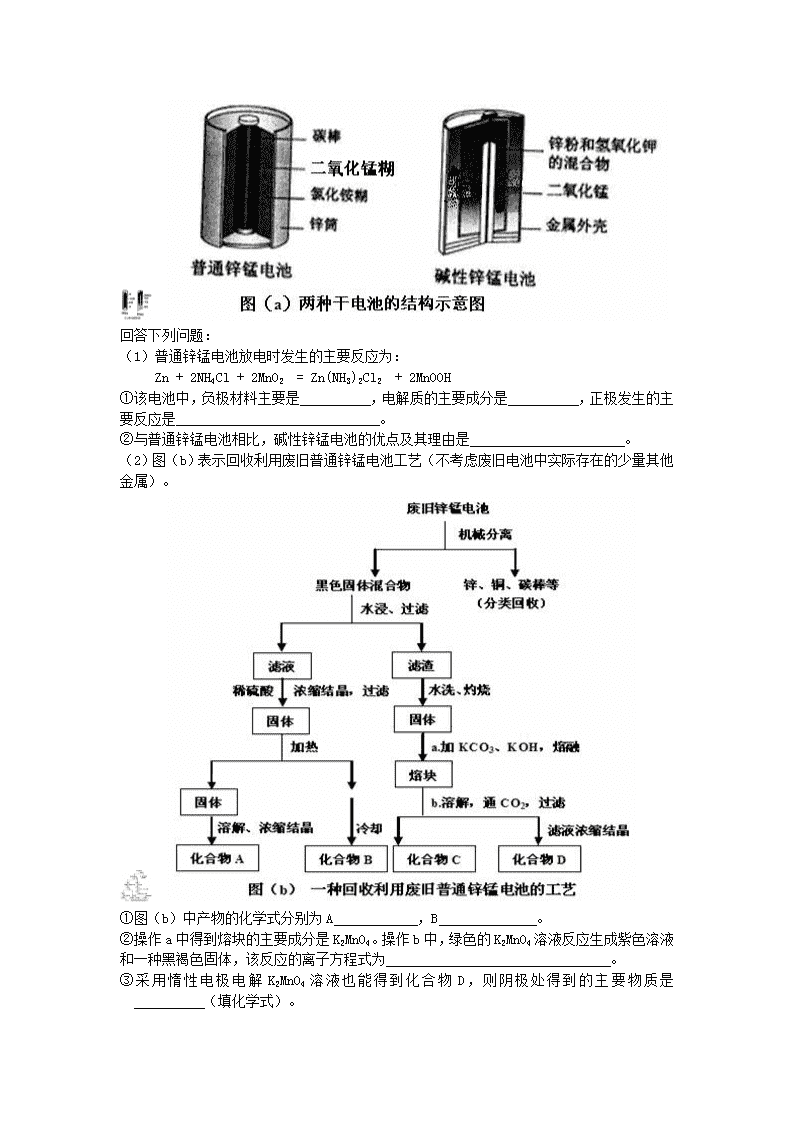
3.“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:NiCl2 + 2e-= Ni + 2Cl-
D.钠离子通过钠离子导体在两电极间移动
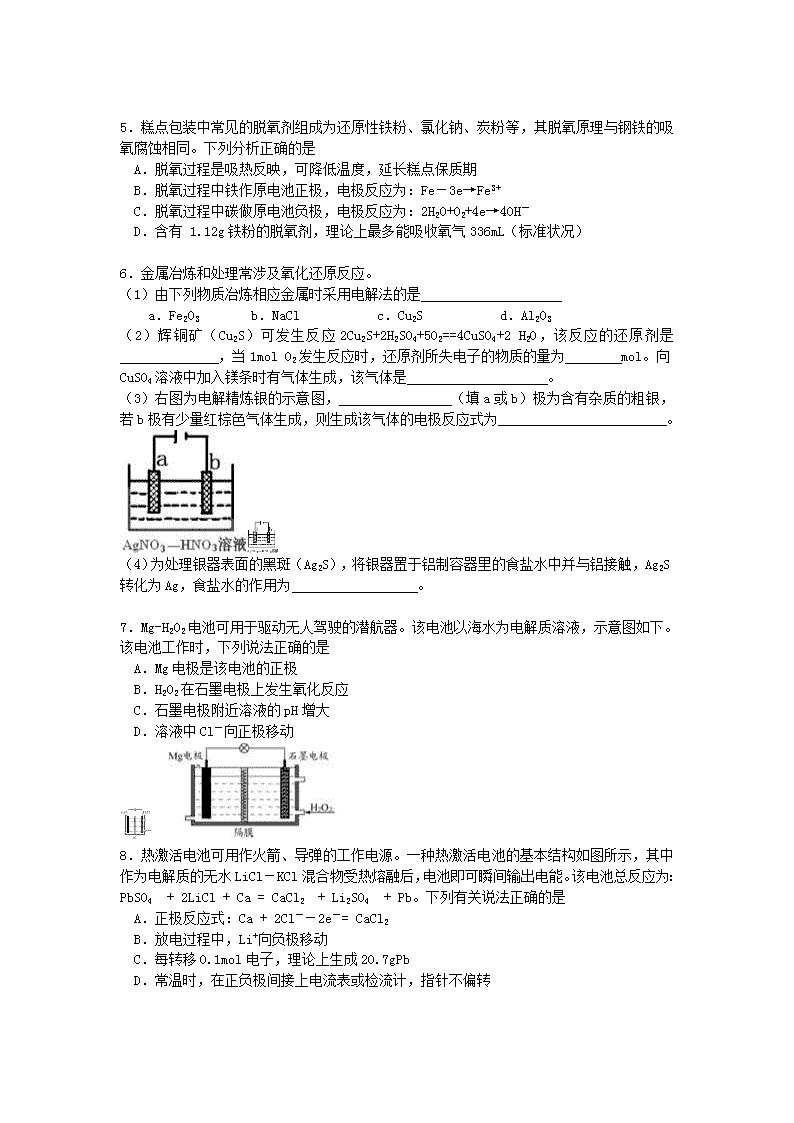
4.锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图(a)所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn + 2NH4Cl + 2MnO2 = Zn(NH3)2Cl2 + 2MnOOH
①该电池中,负极材料主要是 ,电解质的主要成分是 ,正极发生的主要反应是 。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是 。
(2)图(b)表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属)。
①图(b)中产物的化学式分别为A ,B 。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为 。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是 (填化学式)。
5.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反映,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH-
D.含有 1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
6.金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
7.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
8.热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4 + 2LiCl + Ca = CaCl2 + Li2SO4 + Pb。下列有关说法正确的是
A.正极反应式:Ca + 2Cl--2e-= CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
9.银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al + 3Ag2S = 6Ag + Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
10.将右图所示实验装置的K闭合,下列判断正确的是
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
11.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e– + H2O = CH3COOH + 4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗 4.48L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2 = CH3COOH+ H2O
D.正极上发生的反应为:O2+ 4e–+2H2O=4OH–
12.根据右图,下列判断中正确的是
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-=H2
D.烧杯b中发生的反应为2Cl--2e-=Cl2
13.铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
14.科研、生产中常涉及钠、硫及其化合物。
(1)实验室用无水乙醇处理少量残留的金属钠,化学方程式为_________。要清洗附着在试管壁上的硫,可用的试剂是_________。
(2)右图为钠硫高能电池的结构示意图。该电池的工作温度为 200℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为_________。M(由Na2O和Al2O3制得)的两个作用是________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池______倍。
(3)Na2S溶液中离子浓度由达到小的顺序为______,向该溶液中加入少量固体CuSO4,溶液pH______(填“增大”、“减小”或“不变”)。Na2S溶液长期放置有硫析出,是因为_______(用离子方程式表示)。
15.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl下列“水”电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 molNa2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
16.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂
B.放电时正确上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O===2LiOH+H2↑
17.Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3 溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
2AgNO3+4KOH+K2S2O8Ag2O2↓+2KON3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是 .
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设Ag2O2仅含和Ag2O) 2.558g,在一定的条件下完全分解为Ag 和O2 ,得到224.0mLO2(标准状况下)。计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位)。
18.某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2 + O2 == 2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2 +2H2O + 4e- == 4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
19.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li+FeS+2e-=Li2S+Fe。有关该电池的下列叙述中,正确的是
A. Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B. 该电池的电池反应式为:2Li+FeS=Li2S+Fe
C. 负极的电极反应式为Al-3 e-=Al3+
D. 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS
20.Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀.其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
21.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
22.右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
23.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.6/ 6 L
24.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。