- 165.80 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
黄浦区2018年高中学业等级考调研测试
化学试卷 2018.4
相对原子质量:H—1 C—12 N—14 O—16 S—32 Ba—137
一、选择题(共40分,每小题2分,每小题只有一个正确答案)
1. 19世纪中叶,门捷列夫的突出贡献是( )
A. 提出了原子学说 B. 提出了元素周期律
C. 提出了分子学说 D. 提出了化学平衡移动原理
2. 用物理方法就能从海水中直接获得的物质是( )
A. 钠、镁 B. 溴、碘 C. 食盐、淡水 D. 氯气、烧碱
3. 属于弱电解质的是( )
A. 一水合氨 B. 醋酸铵 C. 乙醇 D. 硫酸钡
4. 属于工业固氮的是( )
A. 用N2和H2合成氨 B. 闪电将空气中N2转化为NO
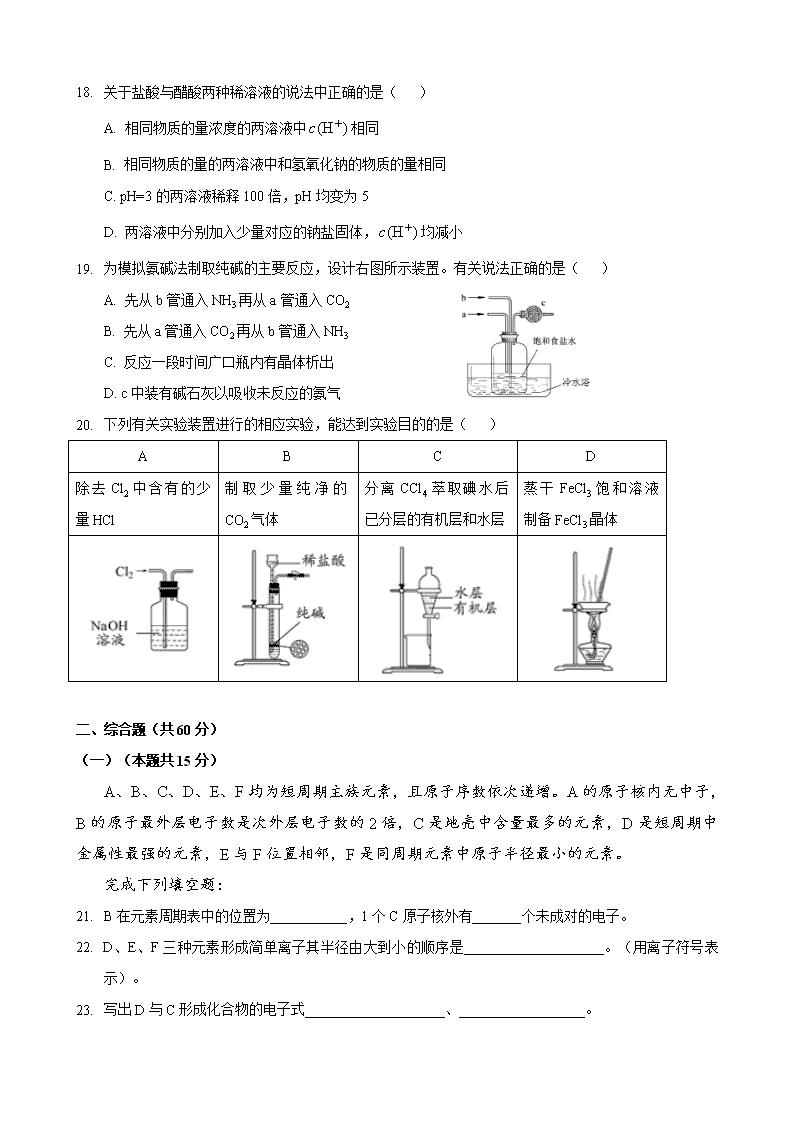
C. 用NH3和CO2合成尿素 D. 固氮菌将氮气变成氨
5. 某原子最外层电子排布为2s22p3,则该原子( )
A. 核外有5个电子 B. 核外有3种能量不同的电子
C. 最外层电子占据3个轨道 D. 最外层上有3种运动状态不同的电子
6. 一定条件下不能与苯发生反应的是( )
A. 酸性KMnO4 B. Br2 C. 浓HNO3 D. H2
7. 单质铁不同于铝的性质是( )
A. 遇冷的浓硫酸钝化 B. 能与氢氧化钠反应
C. 能与盐酸反应 D. 能在氧气中燃烧
8. 只用一种试剂即可区别NaCl、MgCl2、FeCl3、Al2(SO4)3四种溶液,这种试剂是( )
A. AgNO3 B. NaOH C. BaCl2 D. HCl
9. 熔化时需破坏共价键的晶体是( )
A. NaOH B. CO2 C. SiO2 D. NaCl
10. SO2催化氧化过程中,不符合工业生产实际的是( )
A. 采用热交换器循环利用能量 B. 压强控制为20~50MPa
C. 反应温度控制在450℃左右 D. 使用V2O5作催化剂
11. 能使品红溶液褪色的物质是( )
①漂粉精 ②过氧化钠 ③新制氯水 ④二氧化硫
A. ①③④ B. ②③④ C. ①②③ D. ①②③④
12. 无色透明的某强酸性溶液中能大量共存的离子组是( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
13. 关于钢铁电化学保护两种方法的说法错误的是( )
A. 牺牲阳极阴极保护法利用的是原电池原理
B. 外加电流阴极保护法利用的是电解原理
C. 牺牲阳极阴极保护法中钢铁为负极
D. 外加电流阴极保护法中钢铁为阴极
14. 催化加氢不能得到2—甲基戊烷的是( )
A. CH3CH=C(CH3)CH2CH3 B. (CH3)2C=CHCH2CH3
C. CH≡C(CH3)(CH2)2CH3 D. CH3CH=CHCH(CH3)2
15. 下列离子方程式书写错误的是( )
A. 铝粉投入到NaOH溶液中:
B. Al(OH)3溶于NaOH溶液中:
C. FeCl2溶液中通入Cl2:
D. AlCl3溶液中加入足量的氨水:
16. 用NaOH标准溶液滴定盐酸,以下操作导致测定结果偏高的是( )
A. 滴定管用待装液润洗 B. 锥形瓶用待测液润洗
C. 滴定结束滴定管末端有气泡 D. 滴定时锥形瓶中有液体溅出
17. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,可通过以下反应制得ClO2:
下列说法错误的是( )
A. KClO3在反应中得到电子 B. ClO2是还原产物
C. H2C2O4在反应中被氧化 D. 1mol KClO3参加反应有2mol电子转移
18. 关于盐酸与醋酸两种稀溶液的说法中正确的是( )
A. 相同物质的量浓度的两溶液中相同
B. 相同物质的量的两溶液中和氢氧化钠的物质的量相同
C. pH=3的两溶液稀释100倍,pH均变为5
D. 两溶液中分别加入少量对应的钠盐固体,均减小
19. 为模拟氨碱法制取纯碱的主要反应,设计右图所示装置。有关说法正确的是( )
A. 先从b管通入NH3再从a管通入CO2
B. 先从a管通入CO2再从b管通入NH3
C. 反应一段时间广口瓶内有晶体析出
D. c中装有碱石灰以吸收未反应的氨气
20. 下列有关实验装置进行的相应实验,能达到实验目的的是( )
A
B
C
D
除去Cl2中含有的少量HCl
制取少量纯净的CO2气体
分离CCl4萃取碘水后已分层的有机层和水层
蒸干FeCl3饱和溶液制备FeCl3晶体
二、综合题(共60分)
(一)(本题共15分)
A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电子数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
21. B在元素周期表中的位置为___________,1个C原子核外有_______个未成对的电子。
22. D、E、F三种元素形成简单离子其半径由大到小的顺序是____________________。(用离子符号表示)。
23. 写出D与C形成化合物的电子式____________________、__________________。
24. 常温下,1mol A的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为________________________________________________。
25. 非金属性的强弱:E______F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因。
_________________________________________________________________________________
______________________________________________________________________________。
26. Na2SO3可用作漂白织物时的去氯剂。Na2SO3溶液吸收Cl2后,溶液的酸性增强。写出该反应的离子方程式。______________________________________________________。
(二)(本题共15分)
反应过程中的能量变化如图所示:
完成下列填空:
27. 该反应是_____________反应(选填“吸热”、“放热”),该反应化学平衡常数表达式为
_______________________________。
28. 在恒温恒容条件下,能判断该反应达到平衡状态的依据是______________________________
_________________________________。(用文字表示)
29. 若在体系中加入合适的催化剂,则该反应的化学反应速率____________,反应的热效应________(均选填“增大”、“减小”或“不变”)。
30. 达到平衡时,改变一个条件,化学平衡常数不变,A的转化率增大,则该条件是__________
_________________________________。
31. FeCl3固体溶于蒸馏水常会出现浑浊,得不到澄清的氯化铁溶液,其原因是_______________
____________________________,如果要得到澄清的氯化铁溶液,可采取的措施是_________
___________________________________________________________________________。
(三)(本题共15分)
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示(明矾石焙烧后成分不变):
完成下列填空:
32. “浸出”反应的离子方程式为____________________________________________。“浸出”所用稀氨水浓度为39.20 g/L,配制500mL该氨水需251.28 g/L的浓氨水___________mL。
33. “过滤”所需的玻璃仪器有_____________________________________。
34. 写出“溶解”过程中发生反应的化学方程式________________________________________、
__________________________________________________。
35. 检验滤液中是否含有的实验方法_______________________________________________
__________________________________________________________________________。
36. 为测定钾氮复合肥K2SO4、(NH4)2SO4中的质量分数,设计实验步骤如下:
①________________________________________。
②溶于水,加入足量BaCl2溶液,待白色沉淀不再产生为止。
③过滤、_______________、_______________(依次填写实验操作名称)。
④冷却、称量所得沉淀的质量。
37. 若所取试样和所得沉淀的质量分别为g、g,试用含有、的代数式表示该钾氮复合肥中的质量分数为_________________。
(四)(本题共15分)
有机物G是一种高分子化合物,常用作有机合成的中间体,并可用作乳胶漆等。可以通过以下途径合成:
已知有机物A中含有C、H、O、Cl四种元素且同一个碳原子上不直接连接两个官能团,E是乙醇的同系物,F的分子式为C4H6O2。
完成下列填空:
38. A的结构简式为____________或______________,反应③的反应类型_________________。
39. 写出反应⑤和反应⑥的化学方程式:
反应⑤______________________________________________________________;
反应⑥______________________________________________________________。
40. 写出两种与F含有相同官能团的同分异构体的结构简式_________________________________、
________________________________。
41. 试设计一条以为原料合成的合成路线。
(合成路线常用的表示方式为:)
参考答案
一、 选择题
1
2
3
4
5
6
7
8
9
10
B
C
A
A
B
A
B
B
C
B
11
12
13
14
15
16
17
18
19
20
D
D
C
A
D
B
D
B
C
C
二、 综合题
(一)21. 第二周期第IVA族;2
22. S2->Cl->Na+
23. ;
24. 2H2(g)+O2(g)→2H2O(l)+572kJ
25. 弱于;S与Cl的电子层数相同,随着核电荷数的递增,原子半径减小,得电子能力增强,非金属性增强,所以非金属性S
相关文档
- 2017年度高考地理(地球仪和地图)难点2021-05-139页
- 2020版高考英语一轮巩固达标练 Uni2021-05-138页
- 高考化学全国卷理综化学含解析答案2021-05-1310页
- 2017山东高考理综化学部分及答案解2021-05-136页
- 2020版高考地理一轮复习第四章 第2021-05-135页
- 步步高考前三个月训练7用动力学和2021-05-135页
- 高考函数专题函数图像2021-05-139页
- 全国各地高考语文试卷古诗鉴赏题汇2021-05-1332页
- 2020版高考历史二轮复习 第二部分 2021-05-134页
- 高考真题——数学江苏卷Word版含答2021-05-1316页