- 548.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题八 化学反应速率和化学平衡
考纲展示 命题探究
1 化学反应速率
(1)含义
化学反应速率是用来衡量化学反应进行快慢的物理量。
(2)表示方法
用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
(3)数学表达式及单位
表达式:v=。
单位:mol·L-1·s-1或mol·L-1·min-1。
(4)规律
用不同物质的浓度变化表示同一化学反应的反应速率时,反应速率的数值之比等于化学方程式中各物质的化学计量数之比。
学霸巧学卡 正确理解化学反应速率的表达式
(1)由v=Δc/Δt计算的反应速率是一段时间内的平均速率而不是瞬时速率,且无论用反应物还是用生成物表示均取正值。
(2)同一化学反应,相同条件下用不同物质表示的反应速
率,其数值可能不同,但表示的意义相同。因此表示化学反应速率时,必须指明是用反应体系中的哪种物质作依据。
(3)对于固体或纯液体反应物,其浓度视为常数,故不能用固体或纯液体物质表示化学反应速率。
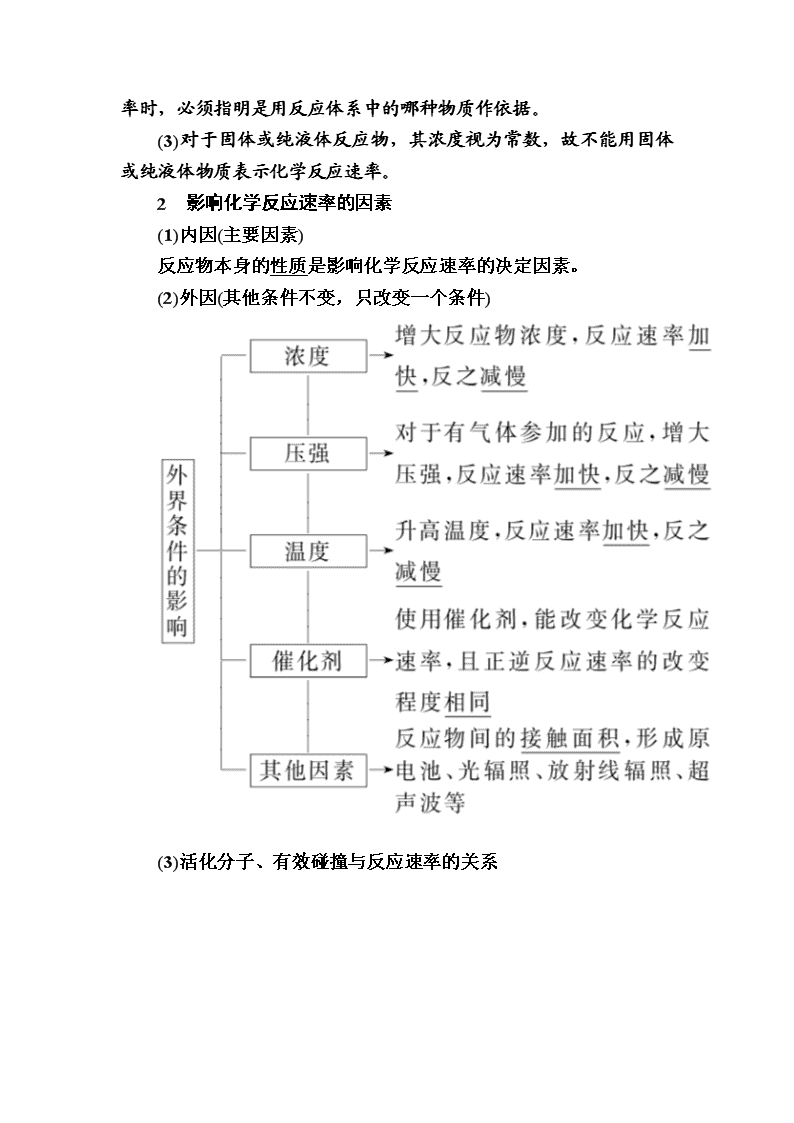
2 影响化学反应速率的因素
(1)内因(主要因素)
反应物本身的性质是影响化学反应速率的决定因素。
(2)外因(其他条件不变,只改变一个条件)
(3)活化分子、有效碰撞与反应速率的关系
学霸巧学卡 正确理解外界因素对化学反应速率的影响
(1)由于固体和纯液体的浓度可视为常数,故改变用量反应速率不变。但当固体颗粒变小时,其表面积将增大,其反应速率将加快。
(2)无论是吸热反应还是放热反应,温度对反应速率的影响具有一致性。升高温度,正、逆反应速率都增大;降低温度,正、逆反应速率都减小,不会出现v正增大,同时v逆减小的情况。
(3)改变压强,对反应速率产生影响的根本原因是引起浓度的改变。对于有气体参加的反应体系,有以下几种情况:
①恒温时:增大压强体积缩小浓度增大反应速率增大。
②恒温恒容时:
a.充入气体反应物反应物浓度增大反应速率增大。
b.充入稀有气体(或非反应气体)总压强增大,但各物质的浓度不变,反应速率不变。
③恒温恒压时:充入稀有气体(或非反应气体)体积增大各物质浓度减小反应速率减小。
(4)对于可逆反应,催化剂能同时同等程度地改变正逆反应速率。但它不会使不能发生的化学反应变得自发,也不会改变化学反应的反应热和平衡状态。
1.思维辨析
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显。( )
(2)由v= 计算平均速率,用反应物表示为正值,用生成物表示为负值。( )
(3)催化剂不参加化学反应。( )
(4)一定量的锌与过量的稀硫酸反应制取氢气,为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液。( )
(5)反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在 2 L 的密闭容器中进行,1 min后,NH3减少了0.12 mol,则 1 min 末的化学反应速率为v(NO)=0.06 mol·L-1·min-1。( )
(6)碳酸钙与盐酸反应的过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率。( )
答案 (1)× (2)× (3)× (4)× (5)× (6)√
2.将4 mol A气体和2 mol B气体在2 L容器中混合,一定条件下发生反应:2A(g)+B(g)2C(g),若经2 s后测得C的浓度为0.6 mol·L-1,现有下列说法:
①用物质A表示的反应速率为0.3 mol·L-1·s-1
②用物质B表示的反应速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是( )
A.①③ B.①④
C.②③ D.③④
答案 B
解析 由题意知,2 s时C的浓度为0.6 mol·L-1,根据化学方程式中化学计量数之比可知,B的变化浓度为0.3 mol·L-1,进而确定2 s时B的浓度是1 mol·L-l-0.3 mol·L-1=0.7 mol·L-1,④正确;A的变化浓度为0.6 mol·L-1,从而求出A的转化率为30%,③错误;用C表示的反应速率为0.3 mol·L-1·s-1,可推知用A表示的反应速率为0.3 mol·L-1·s-1,①正确;用B表示的反应速率为0.15 mol·L-1·s-1,②错误。
[考法综述] 本考点主要考查化学反应速率的计算及规律的运用,另外运用控制变量思想设计考查影响化学反应速率的因素的题目也较常见,属中等难度。
命题法1 化学反应速率的计算
典例1 一定条件下反应A(s)+3B(g)2C(g)在10 L 的密闭容器中进行,测得2 min内,A的物质的量由20 mol(560 g)减小到8 mol(224 g),则下列说法中正确的是( )
A.用反应物A表示该反应的反应速率为0.6 mol·L-1·min-1
B.用反应物B表示该反应的反应速率为2.4 mol·L-1·min-1
C.v(B)=v(C)
D.用反应物C表示该反应的反应速率为3.6 mol·L-1·min-1
[解析] 2 min内,A的物质的量由20 mol减小到8
mol,同时B的物质的量减少36 mol,C的物质的量增加24 mol,根据v=Δn/(VΔt),代入数值计算,可知v(B)=1.8 mol·L-1·min-1,v(C)=1.2 mol·L-1·min-1。A为固体,所以不能用A的浓度变化量来表示该反应的反应速率。根据化学反应速率之比等于化学计量数之比可知,v(B)=v(C)。
[答案] C
【解题法】 计算化学反应速率的常用方法
(1)定义式法:根据“v=Δc/Δt”进行计算。
(2)比例式法:根据“化学反应速率之比等于化学计量数之比”进行计算。
(3)三段式法
具体步骤如下:
①写出有关反应的化学方程式。
②找出各物质的起始量、转化量、某时刻量。
③根据已知条件列方程式计算。
例如,反应 mA + nBpC
t0时刻浓度/mol·L-1 a b 0
转化浓度/mol·L-1 x
t1时刻浓度/mol·L-1 a-x b-
则:v(A)= mol/(L·s)、
v(B)= mol/(L·s)、
v(C)= mol/(L·s)。
命题法2 化学反应速率的大小比较
典例2 反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol/(L·s)、②v(B)=0.6 mol/(L·s)、
③v(C)=0.4 mol/(L·s)、④v(D)=0.45 mol/(L·s)。下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.①>④>②=③
C.①>②>③>④ D.④>③>②>①
[解析] 可用比值法进行反应速率大小比较,=0.45 mol/(L·s);==0.2 mol/(L·s);==0.2 mol/(L·s);==0.225 mol/(L·s),故①>④>②=③,B项正确。
[答案] B
【解题法】 化学反应速率大小的比较方法
由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。
(1)先看单位是否统一,若不统一,换算成相同的单位。
(2)再用转化同一物质法(或比值法)进行比较。
①转化同一物质法:将同一反应中的不同物质的反应速率转化成同一种物质的反应速率,再进行速率的大小比较。
②比值法:用各物质表示的反应速率除以对应各物质的化学计量数,然后再对求出的数值进行大小排序,数值大的反应速率快。如反应mA+nB===pC+qD,若>,则反应速率A>B。
命题法3 外界因素对化学反应速率的影响
典例3 在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
[解析] 根据题中数据分析,温度不变时,反应的瞬时速率与浓度成正比,则可求出a=6.00,A项正确;温度为b K、浓度为0.500 mol/L和温度为318.2 K、浓度为0.300 mol/L对应的瞬时速率相等,B项正确;浓度不变时,温度由318.2 K变为b K时,反应速率减小,则b<318.2,C项正确;不同温度时,反应速率不同,蔗糖浓度减少一半所需的时间不同,D项错误。
[答案] D
【解题法】 控制变量法探究外界因素对化学反应速率的影响
在研究影响化学反应速率的因素时,由于外界影响因素较多,故为搞清某个因素的影响均需控制其他因素相同或不变时,再进行实验。因此,常用控制变量思想解决该类问题。
(1)常见考查形式
①以表格的形式给出多组实验数据,让考生找出每组数据的变化对化学反应速率的影响。
②给出影响化学反应速率的几种因素,让考生设计实验分析各因素对化学反应速率的影响。
(2)解题策略
①确定变量
解答这类题目时首先要认真审题,理清影响实验探究结果的因素有哪些。
②定多变一
在探究时,应该先确定其他的因素不变,只变化一种
因素,看这种因素与探究的问题存在怎样的关系;这样确定一种以后,再确定另一种,通过分析每种因素与所探究问题之间的关系,得出所有影响因素与所探究问题之间的关系。
③数据有效
解答时注意选择数据(或设置实验)要有效,且变量统一,否则无法作出正确判断。
1.(双选)10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
A.K2SO4 B.CH3COONa
C.CuSO4 D.Na2CO3
答案 AB
解析 加入K2SO4溶液,相当于稀释盐酸,反应速率减慢,但H+的物质的量不变,不影响H2的生成量,A项正确;加入CH3COONa溶液,CH3COONa与HCl反应生成CH3COOH,H+的浓度减小,反应速率减慢,但与锌反应的H+的物质的量不变,不影响H2的生成量,B项正确;加入CuSO4溶液,Zn置换出Cu,Zn和Cu构成原电池,反应速率加快,C项错误;D项,加入Na2CO3溶液,Na2CO3与HCl反应,H+的浓度及物质的量均减小,反应速率减慢,氢气的生成量减少,D项错误。
2.已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-―→H2O+IO- 慢
H2O2+IO-―→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
答案 A
解析 对于多步反应,其反应速率取决于反应速率慢的基元反应,A正确;从反应机理看IO-先生成后消失,是中间产物,B错误;活化能是普通分子变为活化分子所需能量,C错误;v(H2O2)=v(H2O)=2v(O2),D错误。
3.在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
答案 C
解析 0~6 min的平均反应速率v(H2O2)=(22.4/22400)×2 mol/(10×10-3 L×6 min)=3.3×10-2mol/(L·min),A正确;6~10 min,溶液中溶质减少,反应速率变慢,v (H2O2)<3.3×10-2mol/(L·min),B正确;反应至6 min时,消耗n(H2O2)=0.002 mol,此时c(H2O2)=0.2 mol·L-1,C错误;反应至6 min时,H2O2的分解率为×100%=50%,D正确。
4.在一定条件下,N2O分解的部分实验数据如下:
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1T2,由于T1时X的平衡浓度大,可推出该反应为放热反应。A项,M点与W点比较,X的转化量前者小于后者,故进行到M点放出的热量应小于进行到W点放出的热量,A项错误;B项,2v(Y)=v(X)=mol·L-1·min-1,B项错误;C项,T1>T2,温度越高,反应速率越大,M点的正反应速率v正>W点的正反应速率v正′,而W点的正反应速率v正′=其逆反应速率v逆′>N点的逆反应速率v逆,C项正确;D项,恒容时充入X,压强增大,平衡正向移动,X的转化率增大,D项错误。
6.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是( )
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
答案 B
解析 由图象知A正确;b、c点变蓝时间相同,但温度不同,故速率不同,B错误;v(HSO)==
5.0×10-5mol·L-1·s-1,C正确;温度高于40 ℃的酸性环境下淀粉会水解,从而导致实验失败,D正确。
7.T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,温度分别为T1和T2时,Z的体积分数与时间的关系如图乙所示。则下列结论正确的是( )
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
B.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图丙所示,则改变的条件是增大压强
答案 B
解析 前3 min内,X的物质的量由2 mol减少为1.4 mol,用X表示的反应速率v(X)==0.1 mol/(L·min),A错误;根据图甲中各物质的物质的量的变化,可知容器中发生的反应可表示为3X(g)+Y(g)2Z(g),B正确;由图乙知,T2>T1(温度越高,越先达到平衡),温度较高时,Z的体积分数较低,说明温度升高,平衡逆向移动,化学平衡常数K减小,C错误;反应进程如图丙所示时,反应达到平衡时间缩短,说明反应速率增大,但达到平衡时各物质的物质的量没有发生变化,因此平衡未发生移动,不可能是增大压强,D错误。