- 525.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学计算题精选精编(附答案及评分标准)
1、(12分)有三种质量比可能相同或不同的镁铝合金样品①、②、③。小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究。
(1)小明取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为_______________________。(2分)
(2)小青取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m3的取值范围是___________________。(2分)
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
实验序号
a
b
c
合金质量(mg)
510
765
918
气体体积(mL)
560
672
672
求:(ⅰ)盐酸的物质的量浓度;(2分)
(ⅱ)合金中镁的质量分数;(2分)
(ⅲ)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?(2分)
(12分)(1)47.06% (2分)
(2) 0.80V0,n(NO)>0,n(NO2)≥n(NO),即:0.045B-0.350>0,解得B>7.80;0.150-0.015B>0,解得 B<10.0;0.045B-0.350≥0.150-0.015B,解得 B≥8.30;综合上述结果得:8.3≤B<10。(上、下限只算出一个且正确给2分,算出二个并得出结果得4分)。
3、(10分)在化工分析中常用到滴定度这个概念。滴定度是指每毫升滴定剂标准溶液相当于被测组分的质量,其单位为g/mL。现有一不溶于水的氧化亚铜样品,该样品能溶于用硫酸酸化了的硫酸铁溶液,所发生的反应可用化学方程式表示为:
Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O。反应生成的硫酸亚铁可用含硫酸的高锰酸钾溶液进行滴定,其滴定反应可用化学方程式表示为:
2KMnO4+8H2SO4+10FeSO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
若每升滴定剂溶液中含有0.400mol KMnO4 ,求该KMnO4溶液对Cu2O的滴定度
(10分)
每毫升KMnO4溶液中含KMnO4的物质的量为
关系式:2 KMnO4 ~ 10FeSO4 ~ 5Cu2O
2mol 5×144g/mol
4.00×10-4mol x
答:KMnO4溶液对Cu2O的滴定度为0.144g/mL
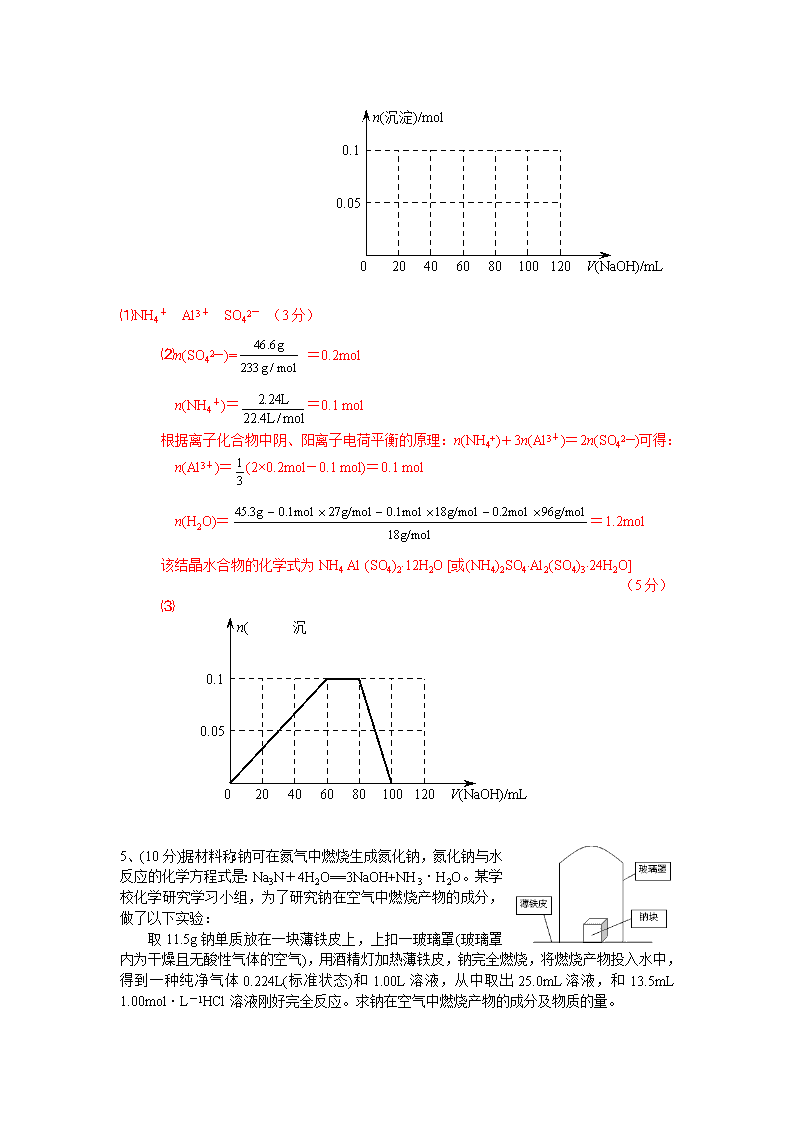
4、(10分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。
⑶假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
n(沉淀)/mol
V(NaOH)/mL
0
0.05
0.1
20
40
60
80
100
120
⑴NH4+ Al3+ SO42- (3分)
⑵n(SO42—)= =0.2mol
n(NH4+)==0.1 mol
根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42—)可得:
n(Al3+)=(2×0.2mol-0.1 mol)=0.1 mol
n(H2O)==1.2mol
该结晶水合物的化学式为NH4 Al (SO4)2·12H2O [或(NH4)2SO4·Al2(SO4)3·24H2O]
(5分)
n(沉淀)/mol
V(NaOH)/mL
0
0.05
0.1
20
40
60
80
100
120
⑶
5、(10分)据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O==3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:
取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0mL溶液,和13.5mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
(10分)
解: n(Na)=0.500 mol (1分)
钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N。 (1分)
n(O2)==0.0100 mol (1分)
2Na2O2+2H2O=4NaOH+O2↑
0.0200 mol 0.0100 mol
n(Na2O2)=0.0200mol (1分)
Na→NaOH,由Na守恒知
c(NaOH)=0.500mo1·L-1,25 mL溶液中n(NaOH)=1.25×10—2mol
n(HCl)=1.35×10-2mol>n(NaOH),说明溶液中还有氨水。 (2分)
原l L溶液中n(NH3·H2O)=×(1.35×10-2一1.25×10-2) mo1=4.00×10-2mol
Na3N+4H2O==3NaOH+NH3·H2O
4.00×10-2 mol 4.00×10-2mol
即:n(Na3N)=0.0400mo1 (2分)
n(Na2O)=(0.500 mo1一0.0400 mo1×3-0.020 mo1×2)/2=0.170 mo1 (2分)
6、已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
现向含有lmolKI的硫酸溶液中加入含a molKBrO3的溶液,a的取值不同,
所得产物也不同。
(1)试将讨论的结果填入表中:
编号
a的取值范围
产物的化学式(或离子符号)
①
I2 、、Br-
②
1/6 < a < 1/5
③
I2、、IO3-、、Br2
④
a ≥ 6/5
(2)对表中③组:当n(I2) = n(IO3-)时,求a的值。
(1)
编号
a的取值范围
产物的化学式(或离子符号)
①
0 < a ≤ 1/6
I2 、、Br-
②
1/6 < a < 1/5
I2 、Br2、、、 Br-
③
1/5 ≤ a < 6/5
I2、、IO3-、、Br2
④
a ≥ 6/5
IO3- 、Br2
(2) a = 8/15
7、已知可逆反应CO + H2O(g) CO2 + H2,达到平衡时,K =,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化
率为60%,水蒸气的转化率为________;K值为________。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度]
c (H2) = c mol/L,
①a、b、c之间的关系式是____________________ _;
②当a = b时,a = _____c。
(1) CO + H2O(g)CO2 + H2
起始浓度(单位均为mol/L) 2 3 0 0
转化浓度 1.2 1.2 1.2 1.2
平衡浓度 0.8 1.8 1.2 1.2
K=
(2)设CO的转化浓度为x CO + H2O(g)CO2 + H2
起始浓度(单位均为 mol/L) 2 6 0 0
转化浓度 x x x x
平衡浓度 2 – x 6 – x x x
K =,x = 1.5 mol/L
(3) CO + H2O(g)CO2 + H2
起始浓度(单位均为mol/L) a b 0 0
转化浓度 c c c c
平衡浓度 a – c b – c c c
①,②a = b,则a = 2c
8、(11分)为了测定溶液中Ba2+的浓度,做了以下实验:
①称取0.1323gK2Cr2O7溶于适量的稀硫酸中,再向其中加入过量的KI溶液与之反应,反应后的溶液加入27.00mLNa2S2O3溶液时恰好反应完全。
②另取50.00mLBa2+溶液,控制适当的酸度,加入足量K2CrO4的溶液,得BaCrO4沉淀,沉淀经过滤、洗涤后,用适量稀盐酸溶解,使CrO转化Cr2O,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液24.00mL,与之有关反应式如下:
□ Cr2O+□I-+□H+——□Cr3++□I2+□H2O
□I2+□S2O——□S4O+□I-
(1)配平上述的离子方程式。
(2)上述两步可用_________________作指示剂,其现象为
(3)试计算溶液中Ba2+的物质的量浓度
(11分)(1)1 6 14——2 3 7(2分) 1 2——1 2(1分)﹤
(2)淀粉(1分)溶液由蓝色变为无色(1分)
(3)解:n(K2Cr2O7)= =0.0004500moL ………………(1分)
Cr2O72-~3I2~6S2O32-
n(S2O32-)=6n(Cr2O72-)=6×0.0004500mol=0.002700mol
c(S2O32-)==0.1000mol/L………………………………(2分)
2Ba2+~2BaCrO4~CrO4~Ct2O72-~3I2~6S2O32-
n(Ba2+)==·L-1×0.02400L=0.0008000mol(2分)
c(Ba2+)==0.01600mlo/L(1分)
9、(12分)把密度为1.68g / cm3的液态S2Cl2 10 mL 溶于石油醚(一种溶剂),得到100mL溶液,把它慢慢加入50 mL3.2mol/L的SO2 水溶液中,振荡使之充分反应,当加入的S2Cl2 溶液为64.3mL时,恰好反应完全。生成物用含0.32mol KOH的KOH溶液中和后,恰好完全转化为KCl 和一种二元含氧酸的钾盐晶体。试通过计算确定S2Cl2 与SO2 在溶液中反应的化学方程式。
解:参加反应的S2Cl2 的物质的量n(S2Cl2 )= 1.68g/cm3×10mL×64.3mL/100mL×135g/mol
=0.08mol (1分)
参加反应的SO2 的物质的量n(SO2 )=50mL×10-3L/mL×3.2mol/L
=0.16 mol (1分)
生成HCl 的物质的量n(HCl)= 2 n(S2Cl2 )= 2×0.08mol
=0.16mol (2分)
生成二元酸的物质的量n(二元酸)==( 0.32 mol– 0.16mol)/2 = 0.08mol (2分)
故反应中n(S2Cl2 ):n(SO2 ):n(HCl):n(二元酸)= 0.08:0.16:0.16:0.08
= 1:2:2:1 (2分)
所以反应式为:
S2Cl2 + 2 SO2 + 2H2O = 2HCl + H2S4O6 (2分)
10、(13分)电子工业常用一定浓度的溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.有关反应为:2FeCl3 + Cu = CuCl2 + 2FeCl2
现将一块敷有铜箔的绝缘板浸入某溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入溶液60.00 mL时,溶液中的恰好完全沉淀.请计算:
(1)溶液A中的物质的量浓度为_________________;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于______________g;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
剩余固体的组成
m的取值范围
n的取值范围
只有铜
有铁且有铜
(用含m的代数式表示)
(4)当m=100.0,n=96.8时,溶液B中的物质的量浓度为________.
(1)3.00 ————( 1分)
(2)67.2g ————(2分)
(3)(每空2分)
剩余固体的组成
m的取值范围
n的取值范围
只有铜
0<m≤67.2
0<n≤76.8
有铁且有铜
m>67.2
x-67.2<n≤x + 9.6
(4)2.5 ————(2分)
11、(8分)将一定量的混合均匀的铁粉和硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解,测得室温下加入的固体A的质量与收集到的气体体积(已换算成标准状况)的关系如图,(假设氢硫酸溶液饱和之前无硫化氢逸出)。
已知加入固体A的质量m≤3.2g时,收集到的气体为氢
气,当m>3.2g时收集到的气体为氢气和硫化氢的混合气。
试分析与计算:
(1)3.2g固体A中所含的物质有
(写化学式) 。
(2)3.2g固体A中各物质的物质的量分别为 。
溶于上述盐酸充分反应后,所得的溶液中氢硫酸的物质的量浓度为(忽略体积变化) 。
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V= mL。(用含m的代数式)
(1)FeS, Fe. (2) n(Fe)=0.01mol n(FeS)=0.03mol. c(H2S)=0.1mol·L-1
(3)V=(280m-672)mL
12、(9分)在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分
反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
(1)NaOH溶液的物质的量浓度是___________ mol·L-1
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 ___________ L(标
准状况)
(3)当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为___________L(标
准状况)。
(每空3分,共9分) (1)5 mol·L-1 (2)15.68L (3) 16.8L
13、(12分)将总总的量为4mol Na2O2和 Al2(SO4)3混合物投入足量水中,充分反应后生成y mol沉淀(y>0),若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值y=f(x)关系式填写在表内(可填满,也可不填满或补充)并作图。
x值
y=f(x)
0
x
(12分)0< x≤3 y=2x/3 (4分) 3a′时,主要的大气污染物是 ;
当a a′时, ;
当a