- 409.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电化学练习
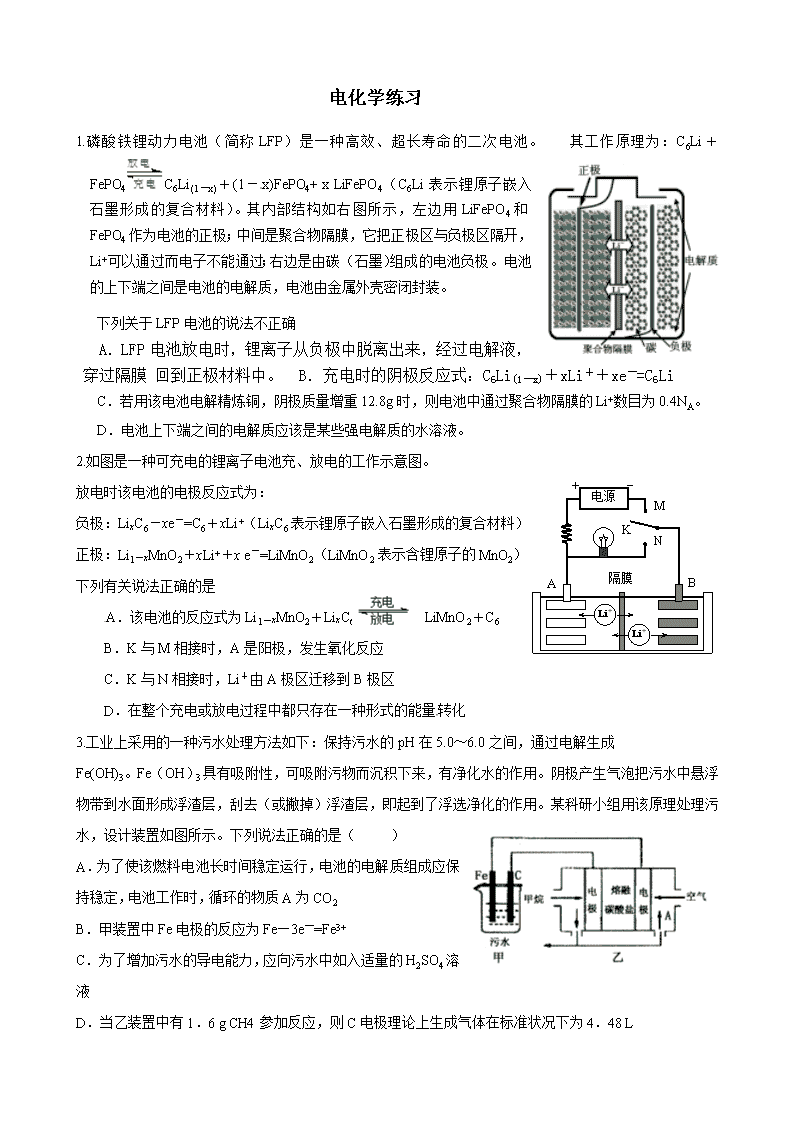
1.磷酸铁锂动力电池(简称LFP)是一种高效、超长寿命的二次电池。 其工作原理为:C6Li+FePO4C6Li(1-x)+(1-x)FePO4+ x LiFePO4(C6Li表示锂原子嵌入石墨形成的复合材料)。其内部结构如右图所示,左边用LiFePO4和FePO4作为电池的正极;中间是聚合物隔膜,它把正极区与负极区隔开,Li+可以通过而电子不能通过;右边是由碳(石墨)组成的电池负极。电池的上下端之间是电池的电解质,电池由金属外壳密闭封装。
下列关于LFP电池的说法不正确
A.LFP电池放电时,锂离子从负极中脱离出来,经过电解液,穿过隔膜 回到正极材料中。 B.充电时的阴极反应式:C6Li(1-x)+xLi++xe-=C6Li
C.若用该电池电解精炼铜,阴极质量增重12.8g时,则电池中通过聚合物隔膜的Li+数目为0.4NA。
D.电池上下端之间的电解质应该是某些强电解质的水溶液。
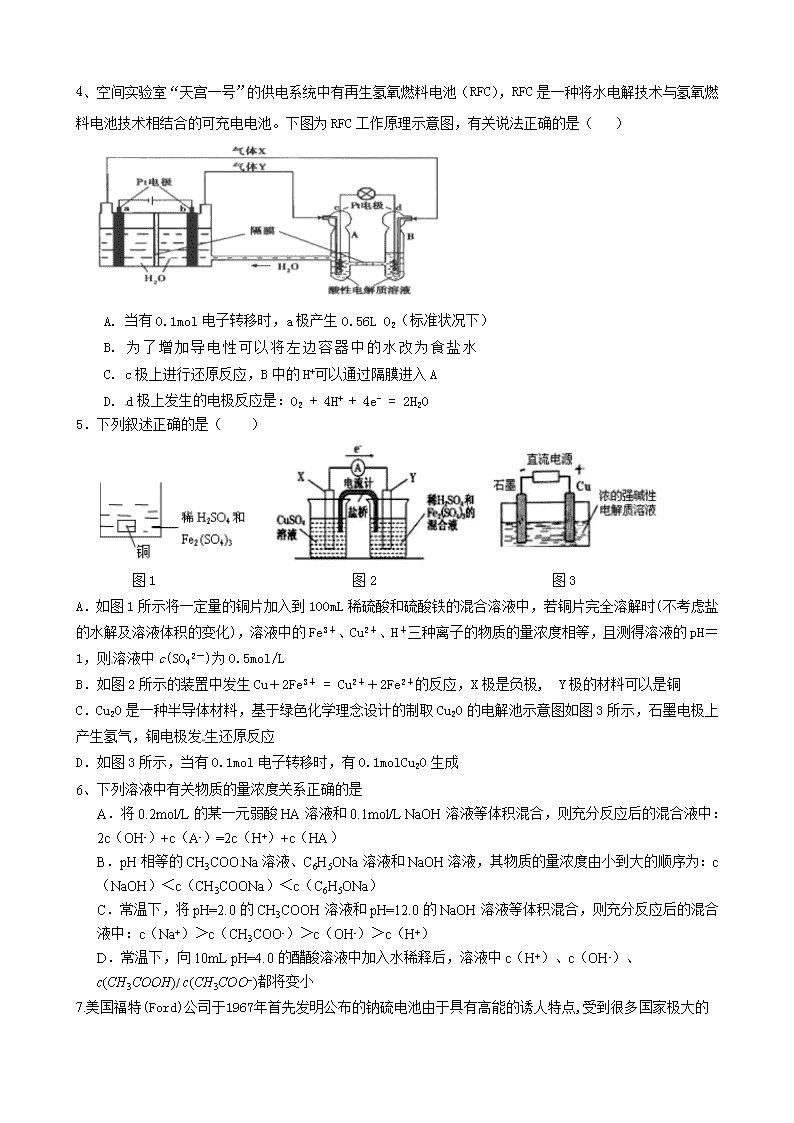
2.如图是一种可充电的锂离子电池充、放电的工作示意图。
隔膜
A
B
K
M
N
电源
Li+
+ -
Li+
放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是
A.该电池的反应式为Li1-xMnO2+LixC6 LiMnO2+C6
B.K与M相接时,A是阳极,发生氧化反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充电或放电过程中都只存在一种形式的能量转化
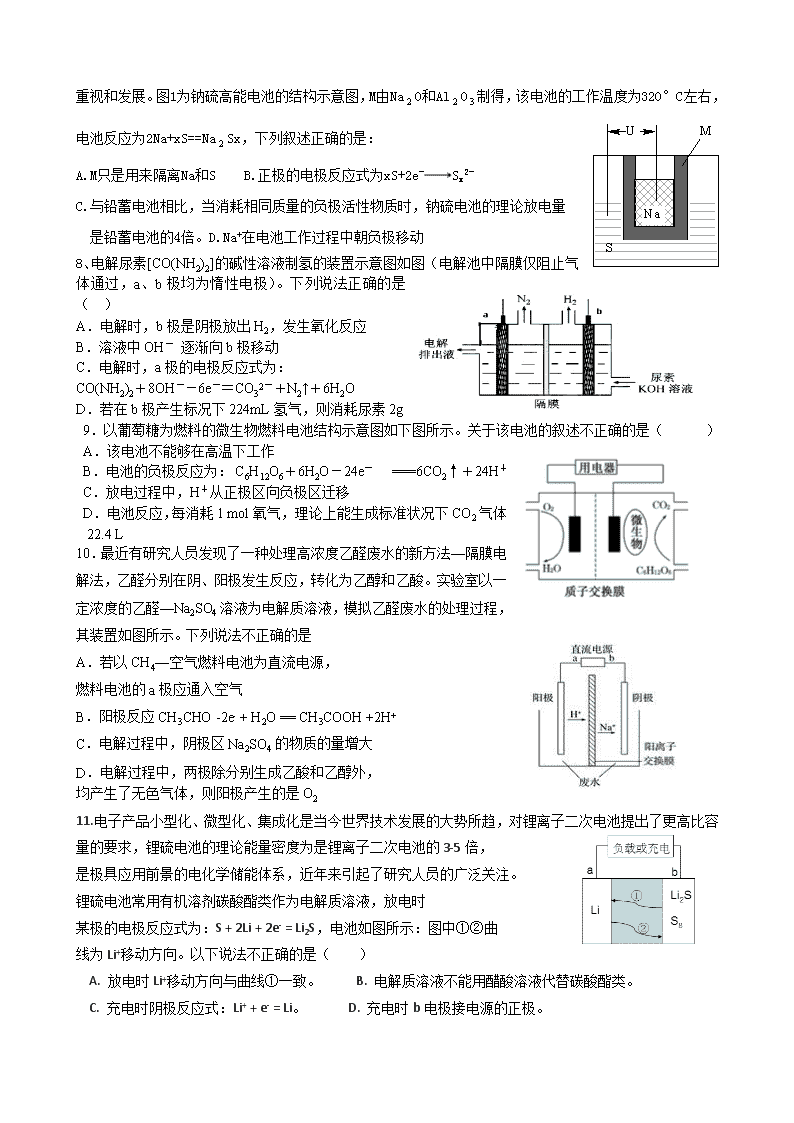
3.工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成
Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生气泡把污水中悬浮
物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污
水,设计装置如图所示。下列说法正确的是( )
A.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
B.甲装置中Fe电极的反应为Fe—3e—=Fe3+
C.为了增加污水的导电能力,应向污水中如入适量的H 2SO4溶液
D.当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L
4、空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
A. 当有0.1mol电子转移时,a极产生0.56L O2(标准状况下)
B. 为了增加导电性可以将左边容器中的水改为食盐水
C. c极上进行还原反应,B中的H+可以通过隔膜进入A
D. d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
5.下列叙述正确的是( )
图1 图2 图3
A.如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L
B.如图2所示的装置中发生Cu+2Fe3+ = Cu2++2Fe2+的反应,X极是负极, Y极的材料可以是铜
C.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D.如图3所示,当有0.1mol电子转移时,有0.1molCu2O生成
6、下列溶液中有关物质的量浓度关系正确的是
A.将0.2mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合,则充分反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
B.pH相等的CH3COONa溶液、C6H5ONa溶液和NaOH溶液,其物质的量浓度由小到大的顺序为:c(NaOH)<c(CH3COONa)<c(C6H5ONa)
C.常温下,将pH=2.0的CH3COOH溶液和pH=12.0的NaOH溶液等体积混合,则充分反应后的混合液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.常温下,向10mL pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)、c(OH-)、c(CH3COOH)/ c(CH3COO−)都将变小
7.美国福特(Ford)公司于1967年首先发明公布的钠硫电池由于具有高能的诱人特点,受到很多国家极大的
重视和发展。图1为钠硫高能电池的结构示意图,M由NaO和AlO制得,该电池的工作温度为320°C左右,电池反应为2Na+xS==NaSx,下列叙述正确的是:
A.M只是用来隔离Na和S B.正极的电极反应式为xS+2e‾Sx2‾
C.与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的4倍。D.Na+在电池工作过程中朝负极移动
8、电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。下列说法正确的是( )
A.电解时,b极是阴极放出H2,发生氧化反应
B.溶液中OH- 逐渐向b极移动
C.电解时,a极的电极反应式为:
CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
D.若在b极产生标况下224mL氢气,则消耗尿素2g
9.以葡萄糖为燃料的微生物燃料电池结构示意图如下图所示。关于该电池的叙述不正确的是( )
A.该电池不能够在高温下工作
B.电池的负极反应为: C6H12O6+6H2O-24e- ===6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.电池反应,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4 L
10.最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法不正确的是
A.若以CH4—空气燃料电池为直流电源,
燃料电池的a极应通入空气
B.阳极反应CH3CHO -2e- + H2O == CH3COOH +2H+
C.电解过程中,阴极区Na2SO4的物质的量增大
D.电解过程中,两极除分别生成乙酸和乙醇外,
均产生了无色气体,则阳极产生的是O2
11.电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,
是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注。
锂硫电池常用有机溶剂碳酸酯类作为电解质溶液,放电时
某极的电极反应式为:S + 2Li + 2e- = Li2S,电池如图所示:图中①②曲
线为Li+移动方向。以下说法不正确的是( )
A. 放电时Li+移动方向与曲线①一致。 B. 电解质溶液不能用醋酸溶液代替碳酸酯类。
C. 充电时阴极反应式:Li+ + e- = Li。 D. 充电时b电极接电源的正极。
12.近年来,金属—空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点。铝—空气电池工作原理如图所示。关于金属—空
气电池的说法不正确的是:
A、铝—空气电池(如图)中,铝作负极,电子通过外电路到正极。
B、为帮助电子与空气中的氧气反应,可使用活性炭作正极材料。
C、碱性溶液中,负极反应为Al(s)+3OH-(aq)=Al(OH)3(s)+3e-,
每消耗2.7gAl(s),需耗氧6.72L(标准状况)。
D、金属—空气电池的可持续应用要求是一方面在工作状态下要有足够的
氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀。
13. NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使
负载
Y
NO2
O2
Y
Y
石墨Ⅰ
石墨Ⅱ
熔融
NaNO3
Y
用过程中石墨I电极上生成氧化物Y,下列说法不正确的是
A.石墨1附近发生的反应为NO2+NO3--e-=N2O5
B.石墨2附近反生的反应为O2-4e-=2O2-
C. 该电池放电时NO3-从右侧向左侧迁移
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4:1
14、高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如右图所示。下列说法合理的是
A.铁是阳极,电极反应为Fe-2eˉ+2OHˉ=Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若隔膜为阴离子交换膜,则电解后左侧溶液中含有FeO42-
D.每制得1 mol Na2FeO4,理论上可以产生67.2L气体
15、液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列叙述不正确的是
装置①
A.负极发生的电极反应式为N2H4 + 4OH- - 4e - = N2+ 4H2O
B.用该燃料电池作为装置②的直流电源,产生1molCl2至少需要通入0.5mol的N2H4
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反
应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.电子从左侧电极经过KOH溶液后流向右侧电极
16. 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)
和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料
采用MnO2,可用作空军通信卫星电源,其工作原理如图所
示。下列说法正确的是( )
A.该电池的负极反应为BH4-+8OH--8e-===BO2-+6H2O
B.电池放电时Na+从b极区移向a极区
C.每消耗3 mol H2O2,转移的电子为3 mol
D.电极a采用MnO2,MnO2既作电极材料又有催化作用
17.某新型二次锂离子电池结构如右图,电池内部是固体电解质,充电、放电时允许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向。充电、放电时总反应可表示为:
LiCoO2+6C Li1-xCOO2 + LixC6。
下列说法正确的是 ( )
A.外电路上的“→”表示放电时的电流方向
B.放电时正极的电极反应为:LixC6– xe-= xLi+ + 6C
C.充电时阳极的电极反应为:LiCoO2 – xe- = Li1-xCOO2 + xLi+
D.外电路有0.1mole-通过,发生迁移的Li+的质量为0.7g
18、已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。
现以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下来说法不正确的是 ( )
A、燃料电池的总反应为:2Al+3HO2- = 2AlO2- +OH- +H2O
B、电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L
C、电极b是正极,且反应后该电极区pH增大
D、电解过程中,电子的流向由a→b→c→d.
19.某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是( )
A.工作时电子由电极a通过传感器流向电极b
B.工作时电极b作正极,O2-由电极a流向电极b
C.负极的电极反应式为:CO+O2—―2e-=CO2
D.传感器中通过的电流越大,尾气中CO的含量越高
1-5 DBACA 6-10 ABCCC 11-15ACBCD 16-19 ADDB
注:5、A溶液中有还有Fe2+ 7、C铅207