- 389.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010年高考化学专项突破精品系列电化学
原电池
一、认清目标
本节重点:①原电池的化学工作原理;
②原电池的形成条件及电极反应式;电子和电流的运动方向。
本节难点: 原电池的化学工作原理。
高考常考点:原电池的形成条件、电极反应式及电池反应方程式的书写。
二、打牢基础
知识点1:原电池的概念
将化学能转变成电能的装置
知识点2:原电池的条件
1. 组成原电池的条件。①电极:两种不同的导体相连;
(如有两种活性不同的金属;一种是金属、一种是非金属导体;一种是金属、一种是金属氧化物等)。
②电极材料均插入电解质溶液中。(电解质溶液:能与电极反应)
③两电极相连形成闭合电路。
④自发发生的氧化还原反应
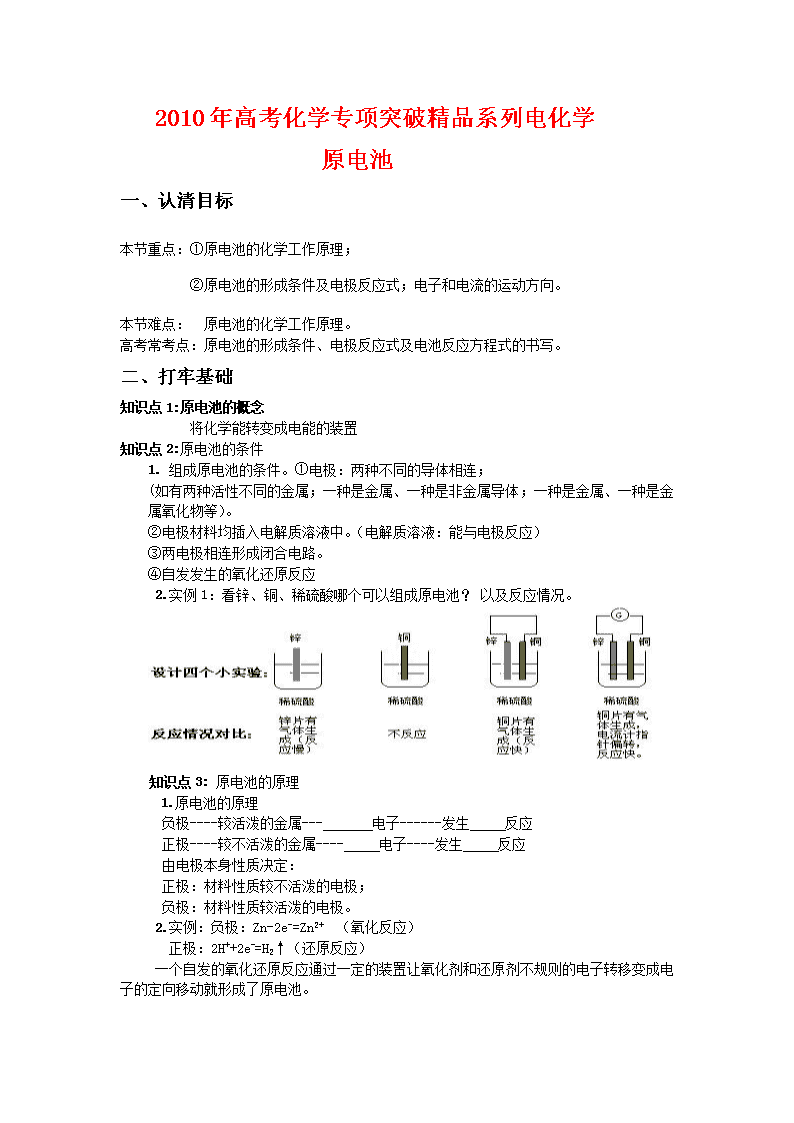
2.实例1:看锌、铜、稀硫酸哪个可以组成原电池? 以及反应情况。
知识点3: 原电池的原理
1.原电池的原理
负极----较活泼的金属--- 电子------发生 反应
正极----较不活泼的金属---- 电子----发生 反应
由电极本身性质决定:
正极:材料性质较不活泼的电极;
负极:材料性质较活泼的电极。
2.实例:负极:Zn-2e-=Zn2+ (氧化反应)
正极:2H++2e-=H2↑(还原反应)
一个自发的氧化还原反应通过一定的装置让氧化剂和还原剂不规则的电子转移变成电子的定向移动就形成了原电池。
知识点4: 一般用离子反应方程式表示原电池正负极的工作原理,又叫电极方程式或电极反应。一般先写负极,所以可表示为:
负极(Zn):Zn-2e=Zn2+ (氧化)
正极(Cu):2H++2e=H2↑(还原)
注意:电极方程式要①注明正负极和电极材料 ②满足所有守衡
总反应是:Zn+2H+=Zn2++H2↑
负极:电极本身失电子,发生氧化反应。
正极:电极本身不反应,溶液中的某些离子在正极上获得电子,发生还原反应。
阳离子放电顺(氧化性强弱顺序): Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
三、知识提升
知识点1: 原电池中的几个判断
1、原电池正负极的判断:
负极:电子流出的极或较活泼的金属电极或发生氧化反应的电极。
正极;电子流入的极或较不活泼的金属电极或发生还原反应的电极。
a、 根据活动性判断:
b、 负极(材料)发生氧化反应。
这种方法能判断简单原电池的正负极。如:Cu、Zn原电池,Zn比铜活泼,所以做负极,但是这种方法在针对一些特殊的原电池反应时就会发生误判。如:Cu、Al、浓HNO3组成的原电池时,就会发生误判(这里Cu做负极,Al做正极)。
b、根据本质来判断:失电子的一定是负极(电子从负极发出),化合价升高。
Zn + 2MnO2 + NH4+ =Zn2+ + Mn203 + NH3 + H2O
Zn元素在反应中化合价升高(0→+2),所以Zn为负极。利用这种办法准确性较高。当然,这种方法需要知道大致的原电池反应方程式或者有图示提示(燃料电池一般是这样)
c、从现象来判断:负极一般会溶解(质量减轻)。
这也是高考经常出现的原电池正负极判断方法之一。比如:在某一原电池反应中,原电池两极A、B,A极冒气泡,则A、B的活动性?
A极冒气泡,故A为正极,故活动性:A