- 167.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高中常见的原电池(化学电源)电极反应式的书写训练
一次电池
1、伏打电池:(负极—Zn、正极—Cu、电解液—H2SO4)
负极: 正极:
总反应方程式(离子方程式) Zn + 2H+ == H2↑+ Zn2+
2、铁碳电池:(负极—Fe、正极—C、电解液H2CO3 弱酸性)
负极: 正极:
总反应方程式(离子方程式) Fe+2H+==H2↑+Fe2+ (析氢腐蚀)
3、铁碳电池:(负极—Fe、正极—C、电解液 中性或碱性)
负极: 正极:
化学方程式 2Fe+O2+2H2O==2Fe(OH)2 (吸氧腐蚀) 4Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3 +3 H2O (铁锈的生成过程)
5、普通锌锰干电池:(负极—Zn、正极—C 、电解液NH4Cl、MnO2的糊状物)
负极: 正极:
6、碱性锌锰干电池:(负极—Zn、正极—C、 电解液KOH 、MnO2的糊状物)
负极: 正极:
化学方程式 Zn +MnO2 +H2O == ZnO + Mn(OH)2
7、银锌电池:(负极—Zn、正极--Ag2O、电解液NaOH )
负极 : 正极 :
化学方程式 Zn + Ag2O + H2O == Zn(OH)2 + 2Ag
8、铝–空气–海水(负极--铝、正极--石墨、铂网等能导电的惰性材料、电解液--海水)
负极 : 正极 :
总反应式为: 4Al+3O2+6H2O===4Al(OH)3 (铂网增大与氧气的接触面)
9、镁---铝电池 (负极--Al、正极--Mg 电解液KOH)
负极(Al): 正极(Mg):
化学方程式: 2Al + 2OH– + 6H2O = 2〔Al(OH)4〕—+ 3H2
二次电池(又叫蓄电池或充电电池)
1、铅蓄电池:(负极—Pb 正极—PbO2 电解液— 浓硫酸)
放电时 负极:
正极:
充电时 阴极:
阳极:
总化学方程式 Pb+PbO2 + 2H2SO42PbSO4+2H2O
4、镍--镉电池(负极--Cd 、正极—NiOOH、电解质溶液为KOH溶液)
放电时 负极:
正极:
充电时 阴极:
阳极:
总化学方程式 Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2
7、锂电池二型(负极LiC6、正极含锂的二氧化钴LiCoO2、充电时LiCoO2中Li被氧化,
Li+还原以Li原子形式嵌入电池负极材料碳C6中,以LiC6表示)
放电时 负极: LiC6 – xe- = Li(1-x)C6 + x Li+ (氧化反应)
正极: Li(1-x)CoO2 + xe- + x Li+ == LiCoO2 (还原反应)
充电时 阴极: Li(1-x)C6 + x Li+ + xe- =LiC6 (还原反应)
阳极: LiCoO2 – xe- = Li(1-x)CoO2 + x Li+ (氧化反应)
总反应方程式 Li(1-x)CoO2 + LiC6 LiCoO2 + Li(1-x)C6
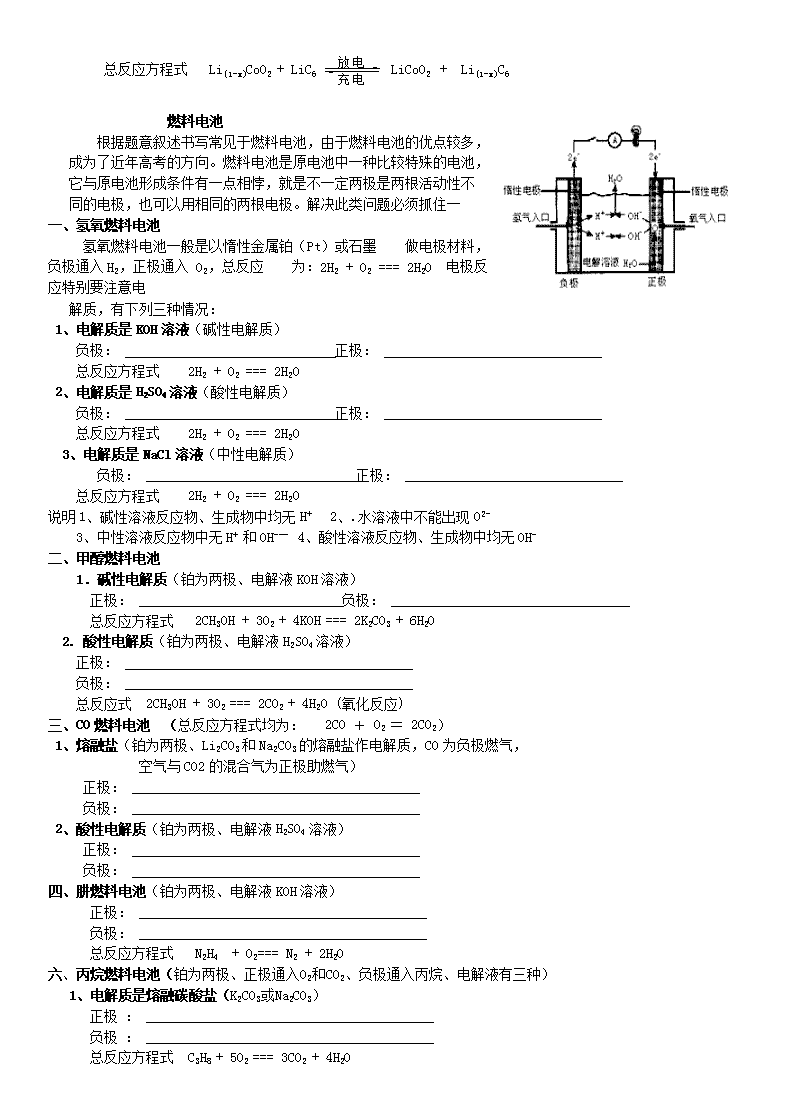
燃料电池
根据题意叙述书写常见于燃料电池,由于燃料电池的优点较多,成为了近年高考的方向。燃料电池是原电池中一种比较特殊的电池,它与原电池形成条件有一点相悖,就是不一定两极是两根活动性不同的电极,也可以用相同的两根电极。解决此类问题必须抓住一
一、氢氧燃料电池
氢氧燃料电池一般是以惰性金属铂(Pt)或石墨 做电极材料,负极通入H2,正极通入 O2,总反应 为:2H2 + O2 === 2H2O 电极反应特别要注意电
解质,有下列三种情况:
1、电解质是KOH溶液(碱性电解质)
负极: 正极:
总反应方程式 2H2 + O2 === 2H2O
2、电解质是H2SO4溶液(酸性电解质)
负极: 正极:
总反应方程式 2H2 + O2 === 2H2O
3、电解质是NaCl溶液(中性电解质)
负极: 正极:
总反应方程式 2H2 + O2 === 2H2O
说明1、碱性溶液反应物、生成物中均无H+ 2、.水溶液中不能出现O2-
3、中性溶液反应物中无H+ 和OH-— 4、酸性溶液反应物、生成物中均无OH-
二、甲醇燃料电池
1.碱性电解质(铂为两极、电解液KOH溶液)
正极: 负极:
总反应方程式 2CH3OH + 3O2 + 4KOH === 2K2CO3 + 6H2O
2. 酸性电解质(铂为两极、电解液H2SO4溶液)
正极:
负极:
总反应式 2CH3OH + 3O2 === 2CO2 + 4H2O (氧化反应)
三、CO燃料电池 (总反应方程式均为: 2CO + O2 = 2CO2)
1、熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO为负极燃气,
空气与CO2的混合气为正极助燃气)
正极:
负极:
2、酸性电解质(铂为两极、电解液H2SO4溶液)
正极:
负极:
四、肼燃料电池(铂为两极、电解液KOH溶液)
正极:
负极:
总反应方程式 N2H4 + O2=== N2 + 2H2O
六、丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)
1、电解质是熔融碳酸盐(K2CO3或Na2CO3)
正极 :
负极 :
总反应方程式 C3H8 + 5O2 === 3CO2 + 4H2O
2、酸性电解质 (电解液H2SO4溶液)
正极 :
负极 :
总反应方程式 C3H8 + 5O2 === 3CO2 + 4H2O
3、碱性电解质(铂为两极、电解液KOH溶液)
正极 :
负极 :
总反应方程式 C3H8 + 5O2 +6KOH === 3 K2CO3 + 7H2O
高中常见的电解池电极反应式的书写训练
1.用惰性电极电解下列溶液
(1)NaCl溶液
阴极: 阳极:
总反应式:
(2)CuSO4溶液
阴极: 阳极:
总反应式:
2.用惰性电极电解下列熔融态物质
(1)MgCl2
阳极: ;阴极: ;
总反应式: 。
(2)Al2O3
阳极: ;阴极: ;
总反应式: 。
3.用铜作电极电解下列溶液
(1)H2O
阴极: 阳极: ;
总反应式: 。
(2)H2SO4溶液
阴极: 阳极: ;
总反应式: 。
(3)NaOH溶液
阴极: ;阳极: ;
总反应式: 。
4.用Al作电极电解下列溶液
(1)H2SO4溶液
阴极: 阳极: ;
总反应式: 。
(2)NaOH溶液
阴极: 阳极: ;
总反应式: 。
陌生环境的电极反应的书写
可能用到的相对原子质量 H:1 O:16 Cl:35.5 Cu:64 Zn:65
.肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为__________________________。
.与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________________,该电池总反应的离子方程式为_______________________________。
.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
.如下左图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
(1)腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 ;
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
.电解NO制备NH4NO3,其工作原理如上右图所示。写出阳极的电极反应式 ,
阴极的电极反应式 。为使电解产物全部转化为NH4NO3,需补充A,A是________,理由是____________________________________________________________________。
.工业上,通过如下转化可制得KClO3晶体:NaCl溶液NaClO3溶液KClO3晶体
(1)通电时Ⅰ中阳极的电极反应式为__________________________。
(2)完成Ⅰ中反应的总化学方程式:NaCl+H2O===NaClO3+________。
.研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在 极,该电极反应式是 。
.实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2
电解时发生反应的化学方程式为 。
.H3PO2可以通过电解的方法制备。工作原理如下左图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。
(1)写出阳极的电极反应式 。
(2)分析产品室可得到H3PO2的原因
。
.将烧碱吸收H2S后的溶液加入到如上右图所示的电解池的阳极区进行电解。电解过程中阳极区发生如
下反应:S2--2e-===S (n-1)S+S2-===S
(1)写出电解时阴极的电极反应式:________________。
(2)电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
.PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
.电解K2MnO4水溶液可以制备KMnO4。电解槽中阳极发生的电极反应为___________________________,阴极逸出的气体是________。
常见的原电池电极反应式的书写训练参考答案
一次电池
1、伏打电池:(负极—Zn、正极—Cu、电解液—H2SO4)
负极: Zn–2e-==Zn2+ (氧化反应) 正极: 2H++2e-==H2↑ (还原反应)
2、铁碳电池:(负极—Fe、正极—C、电解液H2CO3 弱酸性)
负极: Fe–2e-==Fe2+ (氧化反应) 正极:2H++2e-==H2↑ (还原反应)
3、铁碳电池:(负极—Fe、正极—C、电解液 中性或碱性)
负极: 2Fe–4e-==2Fe2+ (氧化反应) 正极:O2+2H2O+4e-==4 (还原反应)
4、普通锌锰干电池:(负极—Zn、正极—C 、电解液NH4Cl、MnO2的糊状物)
负极:Zn–2e-==Zn2+ (氧化反应) 正极:2NH4++2e-==2NH3+H2 (还原反应)
5、碱性锌锰干电池:(负极—Zn、正极—C、 电解液KOH 、MnO2的糊状物)
负极: Zn + 2OH– 2e-== ZnO+ H2O (氧化反应)
正极: MnO2 + 2H2O + 2e-==2Mn(OH )2+2 OH- (还原反应)
6、银锌电池:(负极—Zn、正极--Ag2O、电解液NaOH )
负极 :Zn+2OH––2e-== Zn(OH)2 (氧化反应)
正极 :Ag2O + H2O + 2e-== 2Ag + 2 OH- (还原反应)
7、铝–空气–海水(负极--铝、正极--石墨、铂网等能导电的惰性材料、电解液--海水)
负极 :4Al-12e-==4Al3+ (氧化反应)
正极 :3O2+6H2O+12e-==12OH- (还原反应)
8、镁---铝电池 (负极--Al、正极--Mg 电解液KOH)
负极(Al): 2Al + 8 OH–- 6e- = 2AlO2–+4H2O (氧化反应)
正极(Mg): 6H2O + 6e- = 3H2↑+6OH– (还原反应)
二次电池
1、铅蓄电池:(负极—Pb 正极—PbO2 电解液— 浓硫酸)
放电时 负极: Pb-2e-+SO42-=PbSO4 (氧化反应)
正极: PbO2+2e-+4H++SO42-=PbSO4+2H2O (还原反应)
充电时 阴极: PbSO4 + 2H+ + 2e-== Pb+H2SO4 (还原反应)
阳极: PbSO4 + 2H2O - 2e-== PbO2 + H2SO4 + 2H+ (氧化反应)
2、镍--镉电池(负极--Cd 、正极—NiOOH、电解质溶液为KOH溶液)
放电时 负极: Cd -2e—+ 2 OH– == Cd(OH)2 (氧化反应)
正极: 2NiOOH + 2e— + 2H2O == 2Ni(OH)2+ 2OH– (还原反应)
充电时 阴极: Cd(OH)2 + 2e—== Cd + 2 OH– (还原反应)
阳极:2 Ni(OH)2 -2e—+ 2 OH– == 2NiOOH + 2H2O (氧化反应)
燃料电池
一、氢氧燃料电池
1、电解质是KOH溶液(碱性电解质)
负极:H2 – 2e- + 2OH— === 2H2O (氧化反应)正极:O2 + H2O + 4e- === OH—(还原反应)
2、电解质是H2SO4溶液(酸性电解质)
负极:H2 –2e- === 2H+ (氧化反应)正极:O2 + 4H+ + 4e- === 2H2O (还原反应) 3、电解质是NaCl溶液(中性电解质)
负极:H2 – 2e- === 2H+(氧化反应)正极:O2 + H2O + 4e- === 4OH—
二、甲醇燃料电池
1.碱性电解质(铂为两极、电解液KOH溶液)
正极:3O2 + 12e- + 6H20=== 12OH- (还原反应)
负极:2CH3OH – 12e- + 16OH— === 2CO32- +12H2O (氧化反应)
2. 酸性电解质(铂为两极、电解液H2SO4溶液)
正极:3O2 + 12e-- + 12H+ == 6H2O (还原反应)(注:乙醇燃料电池与甲醇
负极:2CH3OH –12e- +2H2O==12H++2CO2 (氧化反应) 燃料电池原理基本相)
三、CO燃料电池 (总反应方程式均为: 2CO + O2 = 2CO2)
1、熔融盐
正极: O2 + 4e- + 2CO2 = 2CO32-- (还原反应)
负极: 2CO+2CO32- – 4e- ==4CO2 (氧化反应)
2、酸性电解质
正极: O2 + 4e-- + 4H+ == 2H2O (还原反应)
负极: 2CO – 4e- + 2H2O == 2CO2 +4H+ (氧化反应)
四、肼燃料电池(铂为两极、电解液KOH溶液)
正极: O2 + 2H2O + 4e- == 4OH— (还原反应)
负极: N2H4 + 4OH— -- 4e- == N2 + 4H2O (氧化反应)
五、丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)
1、电解质是熔融碳酸盐(K2CO3或Na2CO3)
正极 : 5O2 + 20e- + 10CO2 == 10CO32- (还原反应)
负极 : C3H8 -- 20e-+ 10CO32- == 3CO2 + 4H2O (氧化反应)
2、酸性电解质 (电解液H2SO4溶液)
正极 : 5O2 + 20e- + 26H+ == 10H2O (还原反应)
负极 : C3H8 -- 20e- + 6H2O == 3CO2 + 20 H+ (氧化反应)
3、碱性电解质(铂为两极、电解液KOH溶液)
正极 : 5O2 + 20e- + 10H2O == 20OH— (还原反应)
负极 : C3H8 -- 20e-+ 26 OH— == 3CO32- + 17H2O (氧化反应)
高中常见的电解池电极反应式的书写训练答案
1.用惰性电极电解下列溶液
(1)NaCl溶液
阴极:2H++2e-===H2↑; 阳极:2Cl--2e-===Cl2↑;
总反应式:2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(2)CuSO4溶液
阴极:2Cu2++4e-===2Cu; 阳极:4OH--4e-===2H2O+O2↑;
总反应式:2CuSO4+2H2O2Cu+2H2SO4+O2↑。
2.用惰性电极电解下列熔融态物质
(1)MgCl2
阳极:2Cl--2e-===Cl2↑; 阴极:Mg2++2e-===Mg;
总反应式:MgCl2(熔融)Mg+Cl2↑。
(2)Al2O3
阳极:6O2--12e-===3O2↑; 阴极:4Al3++12e-===4Al;
总反应式:2Al2O3(熔融)4Al+3O2↑。
3.用铜作电极电解下列溶液
(1)H2O
阴极:2H++2e-===H2↑; 阳极:Cu-2e-===Cu2+;
总反应式:Cu+2H2OCu(OH)2↓+H2↑。
(2)H2SO4溶液
阴极:2H++2e-===H2↑; 阳极:Cu-2e-===Cu2+;
总反应式:Cu+H2SO4CuSO4+H2↑。
(3)NaOH溶液
阴极:2H2O+2e-===H2↑+2OH-; 阳极:Cu-2e-+2OH-===Cu(OH)2↓;
总反应式:Cu+2H2OCu(OH)2↓+H2↑。
4.用Al作电极电解下列溶液
(1)H2SO4溶液
阴极:6H++6e-===3H2↑; 阳极:2Al-6e-===2Al3+;
总反应式:2Al+3H2SO4Al2(SO4)3+3H2↑。
(2)NaOH溶液
阴极:6H2O+6e-===3H2↑+6OH-; 阳极:2Al-6e-+8OH-===2AlO+4H2O;
总反应式:2Al+2H2O+2NaOH2NaAlO2+3H2↑。
参考答案
1.N2H4+4OH--4e-===4H2O+N2↑
2.FeO42-+3e-+4H2O===Fe(OH)3+5OH- 2FeO42-+8H2O+3Zn===2Fe(OH)3+3Zn(OH)2+4OH-
注:Fe(OH)3、Zn(OH)2写成氧化物等其他形式且正确也给分
3.(1)MnO2+e—+H+=MnOOH;Zn+2MnO2+2H+=Zn2++2MnOOH (2)0.05g
4.(1) c (2)2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ (3)0.448
5.阳极:5(NO-3e-+2H2O===NO+4H+ ) 阴极:3(NO+5e-+6H+===NH+H2O)
NH3 根据反应:8NO+7H2O3NH4NO3+2HNO3,电解产生的HNO3多
6.(1)3H2O+Cl--6e-===ClO3-+6H+ (6OH-+Cl--6e-===ClO3-+3H2O更好?)
(2)NaCl+H2O===NaClO3+H2↑
7.阴 CO2+6H++6e-==CH3OH+H2O
8.NH4Cl+2HCl3H2↑+NCl3
9.(1)2H2O-4e-=O2↑+4H+;(2)阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2—穿过阴膜扩散至产品室,二者反应生成H3PO2;
10.(1)2H2O+2e-===H2↑+2OH- (2)S+2H+===(n-1)S↓+H2S↑
11.Pb2++2H2O-2e-===PbO2↓+4H+ 石墨上包上铜镀层 Pb2++2e-===Pb↓ 不能有效利用Pb2+
12.MnO42--e-=MnO4- H2;