- 396.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
《2016年高考最后一卷》第七模拟化学
一、单选题:共7题
1.化学无处不在,下列与化学知识有关的说法不正确的是
A.司母戊大方鼎的主要成分是铜合金
B.磁勺指南针中磁性物质是Fe2O3,底座为铜质
C.单质硅可用来制作太阳能电池
D.氯气用于自来水消毒会带来二次污染
【答案】B
【解析】本题考查物质的性质与用途,意在考查考生对STSE的关注情况。选项A,司母戊大方鼎是青铜器,正确;选项B,具有磁性的铁的氧化物是Fe3O4,错误;选项D,氯气与水中的杂质反应会生成有害物质,正确。
2.能正确表示下列反应的离子方程式是
A.向澄清石灰水中通入过量SO2:SO2+OH-
B.向Fe(NO3)3溶液中加入少量的HI溶液:2Fe3++2I-2Fe2++I2
C.NaHS溶液的水解反应:HS-+H2OH3O++S2-
D.向NaAlO2溶液中通入足量CO2:+2H2O+4CO2Al3++4
【答案】A
【解析】本题考查离子方程式,意在考查考生对离子方程式正误判断的能力。选项A,澄清石灰水中Ca(OH)2完全电离,通入少量SO2时生成CaSO3沉淀,SO2过量时,沉淀溶解,正确;选项B,硝酸的氧化性比Fe3+强,发生的反应为2+8H++6I-2NO↑+4H2O+3I2,错误;选项C,HS-的水解反应为:HS-+H2OH2S+OH-,错误;选项D,Al(OH)3不能溶解在碳酸中,故正确的离子方程式为 +2H2O+CO2Al(OH)3↓+,错误。
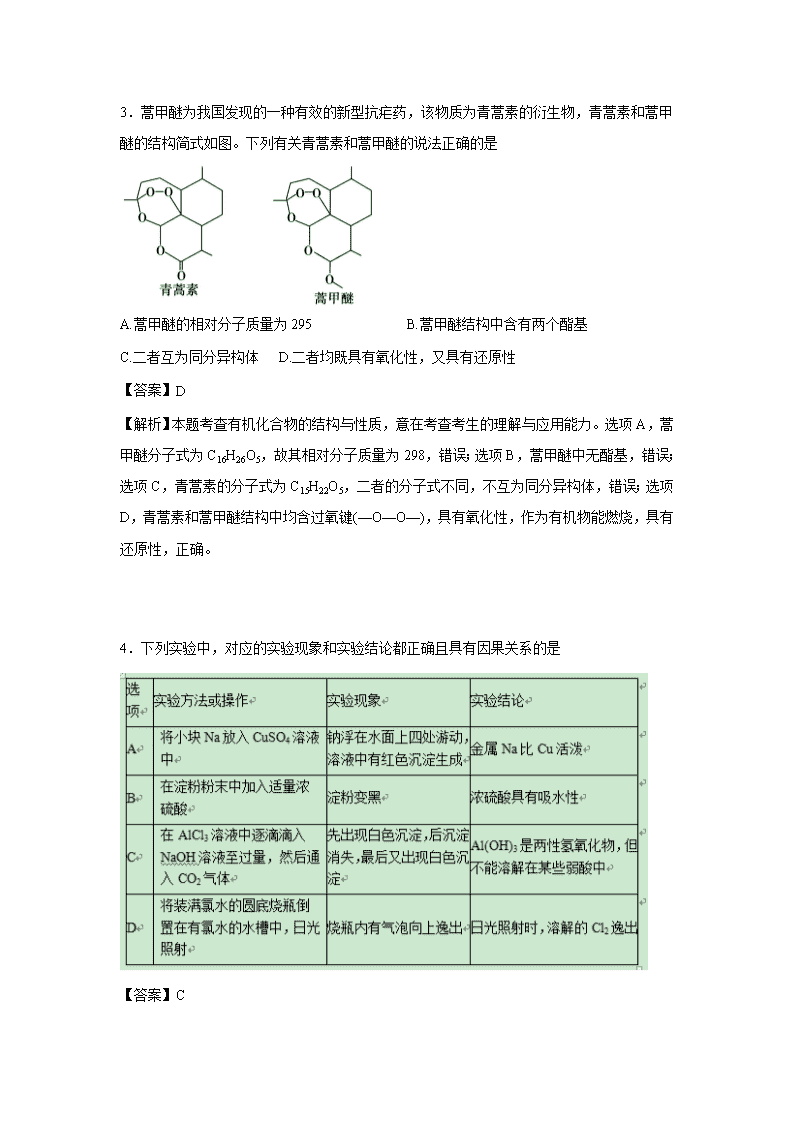
3.蒿甲醚为我国发现的一种有效的新型抗疟药,该物质为青蒿素的衍生物,青蒿素和蒿甲醚的结构简式如图。下列有关青蒿素和蒿甲醚的说法正确的是
A.蒿甲醚的相对分子质量为295 B.蒿甲醚结构中含有两个酯基
C.二者互为同分异构体 D.二者均既具有氧化性,又具有还原性
【答案】D
【解析】本题考查有机化合物的结构与性质,意在考查考生的理解与应用能力。选项A,蒿甲醚分子式为C16H26O5,故其相对分子质量为298,错误;选项B,蒿甲醚中无酯基,错误;选项C,青蒿素的分子式为C15H22O5,二者的分子式不同,不互为同分异构体,错误;选项D,青蒿素和蒿甲醚结构中均含过氧键(—O—O—),具有氧化性,作为有机物能燃烧,具有还原性,正确。
4.下列实验中,对应的实验现象和实验结论都正确且具有因果关系的是
【答案】C
【解析】本题考查化学实验,意在考查考生对元素化合物知识的理解能力和实验操作能力。选项A,在水溶液中,Na先与水反应生成NaOH,NaOH与溶液中的Cu2+反应,生成Cu(OH)2蓝色沉淀,错误;选项B,浓硫酸使淀粉变黑体现了浓硫酸的脱水性,错误;选项C,AlCl3溶液中逐滴滴入NaOH溶液至过量先出现Al(OH)3沉淀,后Al(OH)3溶解在NaOH溶液中,生成NaAlO2,与碳酸反应生成Al(OH)3沉淀,正确;选项D,氯水受日光照射,其中的HClO分解生成氧气,不是氯气,错误。
5.科技工作者已经研发出一种更高容量、更高安全性、更低成本的新型锂离子电池,该新型锂离子电池装置如图所示。下列有关该电池的叙述正确的是
A.不管是放电还是充电,甲极区均发生氧化反应
B.充电时,Li+经过电解液进入乙极区
C.充电时阴极电极反应式为Li2O2+2e-+2Li+2Li2O
D.电池总反应为2Li+Li2O22Li2O
【答案】D
【解析】本题考查电化学知识,意在考查考生对电化学理论的理解与应用能力。选项A,放电时,甲极区Li失电子,发生氧化反应,充电时,甲极区Li+得电子,发生还原反应,错误;选项B,充电时,乙电极为阳极,电极反应式为2Li2O-2e-Li2O2+2Li+,故Li+由乙极区进入甲极区,错误;选项C,充电时,甲极为阴极,电极反应式为Li++e-Li,错误;选项D,根据图示中的物质性质,可知该电池的总反应为Li与Li2O2发生的氧化还原反应,正确。
6.X、Y、Z、W分别为短周期主族元素,原子序数依次增大,Y、Z在同周期中相邻,且4种元素分布在3个短周期中。4种元素原子最外层电子数之和为16,且W为金属元素。下列有关叙述正确的是
A.单质沸点:XZ
C.简单离子的离子半径:W>Y>Z D.4种元素只能形成两种离子化合物
【答案】A
【解析】本题考查原子结构、元素周期表与元素周期律,意在考查考生对元素位、构、性的应用能力。4种元素分布在3个短周期中,则X为H,Y、Z在第2周期,W在第3周期。设Y、W最外层电子数分别为y、w,则Z最外层电子数为y+1,故1+y+(y+1)+w=16,即2y+w=14,其中w只能取偶数,又因W为金属元素,则w=2,则y=6,故Y、Z、W分别为O、F、Mg。选项A,H2、O2、F2均为双原子气体分子,相对分子质量越大,沸点越高,而Mg为金属固体,沸点比气体的高,正确;选项B,F的非金属性比O的强,故HF的热稳定性比H2O的强,错误;选项C,O2-、F-、Mg2+核外电子数相等,故核电荷数越小,离子半径越大,即O2->F->Mg2+,错误;选项D,MgH2、MgO、MgF2、Mg(OH)2均为离子化合物,错误。
7.常温下,向含有c(H+)=1 mol·L-1、c(Cu2+)=c(Fe3+) =0.04 mol·L-1的100 mL溶液中加入固体NaOH(忽略加入固体时的溶液体积变化),溶液中Cu2+、Fe3+的浓度随着pH的变化曲线如图所示。下列叙述正确的是(溶液中离子浓度小于10-5mol·L-1时认为沉淀完全)
A.pH在0~2之间时,溶液中发生3个化学反应 B.Ksp[Fe(OH)3]>Ksp[Cu(OH)2]
C.pH=4时溶液中的阳离子为H+和Cu2+ D.加入4.8 g NaOH时,Fe3+、Cu2+沉淀完全
【答案】D
【解析】本题考查电解质溶液理论,意在考查考生对溶度积概念的理解及有关计算能力。选项A,pH在0~2之间时,溶液中只发生H+与OH-的中和反应,错误;选项B,Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=0.04 mol·L-1×(10-14mol·L-1÷10-2mol·L-1)3=4.0×10-38;Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=0.04 mol·L-1×(10-14mol·L-1÷10-5mol·L-1)2=4.0×10-20,故Ksp[Fe(OH)3]”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L-1,该温度下的平衡常数K= ,0~10 min内反应速率v(CH3OH)= 。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:
A、B两点的压强大小关系:p1 (选填“>”、“=”或“<”)p2。若A点对应容器的容积为20 L,则B点对应容器的容积为 L。
【答案】(1)
(2)①H2C2O4+22+ ②c4>c3>c2>c1
(3)2C(s)+O2(g)2CO(g) ΔH=-222.0 kJ·mol-1
(4)①< ②2.041 L2·mol-2 0.08 mol·L-1·min-1 ③< 4
【解析】本题考查物质性质与化学反应原理,意在考查考生对化学理论知识的综合应用能力。 (1)乙烷为共价化合物,其中H原子核外达到2电子稳定状态,C原子核外为8电子稳定状态,故其电子式为。(2)①的酸性比H2CO3强,若草酸过量,则生成二氧化碳,但该题中草酸为少量,故反应生成和。②由碳酸和草酸的两步电离常数可知酸性强弱顺序为H2C2O4>>H2CO3>,酸性越弱,其对应的强碱盐水解程度越大,盐溶液的碱性越强,c(H+)越小,故浓度均为0.1 mol·L-1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液中c(H+)逐渐增大,即c4>c3>c2>c1。(3)由已知C和CO的标准燃烧热数据可写出其热化学方程式:①C(s)+O2(g)CO2(g) ΔH=-394.0 kJ·mol-1、②
CO(g)+O2(g)CO2(g) ΔH=-283.0 kJ·mol-1,根据盖斯定律,由(①-②)×2可得:2C(s)+O2(g)2CO(g) ΔH=(-394.0 kJ·mol-1+283.0 kJ·mol-1)×2=-222.0 kJ·mol-1。(4)①由表格中的平衡常数数据可知,温度越高,平衡常数越小,即升高温度,平衡逆向移动,故正反应为放热反应,即Q<0。②由题意可知,平衡时c(H2)=1.4 mol·L-1,c(CO)=0.2 mol·L-1,c(CH3OH)=0.8 mol·L-1,则K=≈2.041 L2·mol-2,v(CH3OH)=0.8 mol·L-1÷10 min=0.08 mol·L-1·min-1。③由图示可知B处的转化率高于A处,而已知反应为增大压强平衡正向移动的反应,因此压强p18.5,使污水中的磷转化为难溶的Ca5(PO4)3OH,该反应的离子方程式为 。
(4)电解法也是污水处理的一种重要方法,采用的电解设备的名称一般是
;电解可以直接将污水中的污染物除掉,也可以通过电解产生的物质和污水中的污染物反应,达到除去污染物的目的,或者通过生成物的物理作用除去污染物。若某种电解工艺中,采用电解生成的Fe(OH)3的吸附、絮凝作用除去污染物,则该电解工艺中的阳极材料是 。
(5)溶解氧的数值是研究水自净能力的一种依据。测定水中溶解氧的方法之一是在50.00 mL水样中加入硫酸锰和碱性碘化钾(KOH、KI),水中溶解氧将+2价锰氧化成+4价锰形成氢氧化物沉淀[MnO(OH)2],该反应的离子方程式为 。加稀硫酸后,该沉淀溶解,并与I-反应而释放出I2;然后以淀粉为指示剂,用0.010 00 mol·L-1硫代硫酸钠标准溶液滴定溶液中的I2(其中Na2S2O3被氧化为Na2S4O6),共消耗硫代硫酸钠标准溶液8.00 mL。通过计算确定该水样中溶解氧含量是 mg·L-1。
【答案】(1)Al(OH)3 物理变化、化学变化
(2)中和 Cd2++S2-CdS↓
(3)5Ca(OH)2+3Ca5(PO4)3OH+9OH-
(4)电解槽 Fe(或答“铁棒”)
(5)2Mn2++4OH-+O22MnO(OH)2↓ 12.80
【解析】本题考查化学与技术,意在考查考生对该模块知识与理论的综合应用能力。 (1)明矾电离出Al3+,Al3+水解生成的Al(OH)3具有吸附性;水解为化学变化,吸附为物理变化。(2)溶液中的Cd2+与S2-反应生成CdS沉淀析出。(3)通过题目给出的有关反应物和生成物可写出离子方程式:5Ca(OH)2+ 3Ca5(PO4)3OH+9OH-,要注意“石灰乳”写作“Ca(OH)2”,而不是离子形式。(4)电解设备为电解槽;通过生成物Fe(OH)3可判断阳极材料为Fe。(5)测定溶解氧的过程中涉及的反应有:
2Mn2++4OH-+O22MnO(OH)2↓
MnO(OH)2+2I-+4H+Mn2++3H2O+I2
2+I22I-+
由此可得关系式:O2~2MnO(OH)2~2I2~4,即O2~4,则n(O2)=0.010 00 mol·L-1×0.008 L×=2×10-5mol,故溶解氧的含量为:2×10-5mol×32 g·mol-1÷0.05 L=12.80×10-3g·L-1=12.80 mg·L-1。
12.碳族元素包括C、Si、Ge、Sn等元素。回答下列问题:
(1)基态原子的电子吸收能量后会跃迁到较高能级,此时原子处于 态,基态碳原子的核外电子排布式为 。
(2)甲硅烷(SiH4)和联氨(N2H4)的相对分子质量均为32,但二者沸点相差很大,甲硅烷的沸点为-111.9 ℃,联氨的沸点为113.5 ℃,常温下前者为气体,后者为液体。二者性质出现该差异的原因是 。
(3)结构简式为的物质可用作医药中间体及用于有机合成的羟基保护剂。极性键与非极性键数目之比为 ,其中Si原子的杂化轨道类型是 。
(4)SnCl4的熔点为-33 ℃,沸点为114.1 ℃,易溶于水,溶于汽油、二硫化碳等多种有机溶剂。在潮湿空气中水解生成锡酸,并生成白雾,该白雾有腐蚀性。由此判断SnCl4为 晶体,SnCl4水解的化学方程式为 。
(5)β-羧乙基锗倍半氧化物可提高人体免疫功能,具有抗癌、延缓衰老、排除体内毒素的功效。其片层结构(每个结构单元均是由Ge原子和O原子构成的十二元环)如图:
①β-羧乙基锗倍半氧化物的十二元环片层结构中,每个Ge原子连接 个十二元环,每个十二元环占有 个O原子。
②β-羧乙基锗倍半氧化物的化学式为 。
【答案】(1)激发 1s22s22p2
(2)联氨分子间存在氢键,而甲硅烷分子间只存在范德华力
(3)19∶3 sp3
(4)分子 SnCl4+3H2OH2SnO3+4HCl
(5)①3 3 ②Ge2C6H10O7
【解析】本题考查物质结构与性质模块知识,意在考查考生对该模块知识和理论的理解与应用能力。 (1)基态原子吸收能量后成为激发态原子,基态碳原子的核外电子排布式为1s22s22p2。(2)联氨分子与分子间形成H—N…H氢键,使得联氨分子间作用力大,沸点高;而甲硅烷分子间只存在范德华力,不能形成氢键,故分子间作用力弱,沸点低。(3)分子中含有5个甲基,故存在15个C—H极性键,存在3个C—Si极性键和1个Si—Cl极性键,共19个极性键,而只有3个C—C非极性键,故极性键与非极性键数目之比为19∶3。每个Si原子最外层有4个电子,在该分子中,3个C原子和1个Cl原子各提供1个电子与Si原子共用,因此分子中Si原子周围为4对成键电子,故Si原子采取sp3杂化。(4)由SnCl4的熔沸点较低,且易溶于水可知其为分子晶体;由C、Sn同主族可知锡酸的分子式为H2SnO3,因此SnCl4水解生成H2SnO3和HCl。(5)①由给出的片层结构可知,每个Ge原子与3个由Ge原子和O原子构成的十二元环相连;十二元环结构中,每个O原子属于2个十二元环,故属于每个十二元环的O原子数为6×1/2=3。②属于每个十二元环的Ge原子数为6×1/3=2,与每个十二元环相连的—CH2—CH2—COOH数目为6×1/3=2,故β-羧乙基锗倍半氧化物的化学式为Ge2C6H10O7。
五、推断题:共1题
13.琥珀酸二乙酯主要用途:用作增塑剂和特种润滑剂,也用作气相色谱固定液;用作溶剂、食品加香剂、有机合成中间体。用乙烯为原料制备琥珀酸二乙酯的合成路线如下:
已知:R—Br+NaCNR—CNR—COOH
回答下列问题:
(1)乙烯生成A的反应类型为 ,A的名称是 。
(2)B的结构简式为 ,琥珀酸二乙酯的结构简式为 。
(3)E为八元环状化合物,E含有的官能团名称为 。
(4)A生成D的化学方程式为 .
(5)能发生银镜反应,且能与碳酸钠反应生成CO2的C的同分异构体有 种。
(6)参照上述琥珀酸二乙酯的合成路线,设计一条由丙醇(CH3CH2CH2OH)合成2-甲基丙酸()的合成路线: 。
【答案】(1)加成反应 1,2-二溴乙烷
(2)NCCH2CH2CN C2H5OOCCH2CH2COOC2H5
(3)酯基
(4)BrCH2CH2Br+2NaOHHOCH2CH2OH+2NaBr
(5)6
(6)CH3CH2CH2OHCH3CH=CH2CH3CHBrCH3
【解析】本题考查有机化学基础,意在考查考生对该模块知识与理论的综合应用能力。根据框图中的转化关系可知A、B、C、D、E的结构简式分别为BrCH2CH2Br、NCCH2CH2CN 、HOOCCH2CH2COOH、HOCH2CH2OH、;琥珀酸二乙酯的结构简式为C2H5OOCCH2CH2COOC2H5。(1)乙烯中的碳碳双键与Br2发生加成反应生成1,2-二溴乙烷。(5)能发生银镜反应,且能与碳酸钠反应生成CO2,则①分子中含有—COOH、—CHO和—OH,可先定一个碳主链C—C—CHO,羟基和羧基在同一个碳原子上有2种,分别在不同的碳原子上有2种;②分子中含有—COOH和HCOO—,此情况有2种,故共有6种同分异构体。
相关文档
- 历年高考全国卷英语听力原文2021-05-1335页
- 2013年高考化学试题分类解析汇编:非2021-05-1312页
- 十年高考2002-2011英语分类汇编形2021-05-1330页
- 2012年高考理综化学试题及答案(全2021-05-138页
- 高考最后一卷A卷数学理2021-05-134页
- 细节决定成败——对2011年高考物理2021-05-134页
- 高考英语复习往年6年高考4年模拟试2021-05-1364页
- 2018年高考英语必背单词分类汇总(2021-05-1321页
- 2008年高考全国文综卷(1)历史部分_2021-05-133页
- 十年高考全国各地高考英语试题分类2021-05-1321页