- 346.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考理综卷(化学1)
第Ⅰ卷(选择题 共42分)
一、选择题(本小题包括7小题,每小题6分,共42分,每小题只有一个选项符合题意)
6.化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. TNT(炸药)爆炸时,部分化学能转化为动能
B. 镁条燃烧时,部分化学能转化为光能
C. 煤燃烧时,部分化学能转化为热能
D. 电解熔融Al2O3时,部分化学能转化为电能
7.在下列溶液中,各组离子一定能够大量共存的是( )
A.含碳酸氢钠的溶液:K+、SO42-、Cl-、H+
B.c(H+)=10-12 mol·L-1的溶液:K+、Na+、Cl-、CO32-
C.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
8.NA代表阿伏加德罗常数。下列有关叙述不正确的是( )
A.46 g 二氧化氮和四氧化二氮的混合气体中含有的原子数为3NA
B.常温下,100mL 1mol·L-1Na2CO3溶液中阴离子总数大于0.1NA
C.分子总数为NA的CO、C2H4混合气体质量为28g,体积约为22.4L
D.78 g Na2O2晶体中所含阴离子数为NA
9.一条有机合成路线如图1所示:
图1
下列说法错误的是( )
A.乙的结构简式为CH3COOCH2CH3
B.乙醇与CH3OCH3(二甲醚)互为同分异构体
C. 反应①属于加成反应,反应④属于取代反应
Cu
△
D. 反应②的化学方程式为2CH3CH2OH+O2 2CH3CHO
10.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应。下列说法不正确的是( )
A.原氨水物质的量浓度为0.1 mol·Lˉ1
B.反应后的溶液中:c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ)
C.反应后的溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=0.1 mol·Lˉ1
D.原氨水中:c(NH4+)+c(H+)=c(OHˉ)
11.在容积为1 L的密闭容器中充入1 mol CO和2 mol H2混
合气体,发生以下反应:CO(g)+2H2(g) CH3OH(g)。
T1、T2温度下,CH3OH的物质的量随着时间的变化关系如
图2所示。下列有关说法正确的是( )
A.反应温度:T1>T2
B.平衡常数:K(T1)>K(T2) 图2
C.T1温度下,40 min后,再充入一定量CO,CO转化率增大
D.T2温度下,0~10 min间,v (H2)= 0.06 mol·Lˉ1·minˉ1
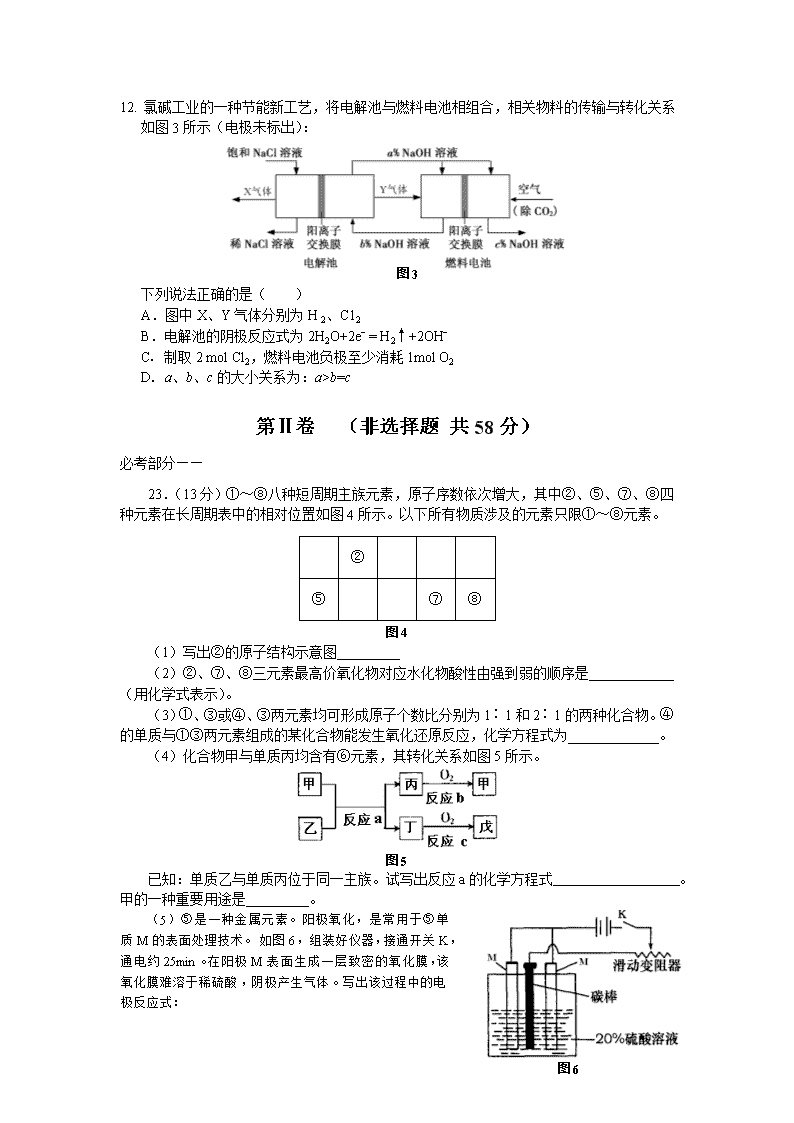
12. 氯碱工业的一种节能新工艺,将电解池与燃料电池相组合,相关物料的传输与转化关系如图3所示(电极未标出):
图3
下列说法正确的是( )
A.图中X、Y气体分别为H 2、C12
B.电解池的阴极反应式为2H2O+2eˉ = H2↑+2OHˉ
C. 制取2 mol Cl2,燃料电池负极至少消耗1mol O2
D. a、b、c的大小关系为:a>b=c
第Ⅱ卷 (非选择题 共58分)
必考部分——
23.(13分)①~⑧八种短周期主族元素,原子序数依次增大,其中②、⑤、⑦、⑧四种元素在长周期表中的相对位置如图4所示。以下所有物质涉及的元素只限①~⑧元素。
②
⑤
⑦
⑧
图4
(1)写出②的原子结构示意图_________
(2)②、⑦、⑧三元素最高价氧化物对应水化物酸性由强到弱的顺序是
(用化学式表示)。
(3)①、③或④、③两元素均可形成原子个数比分别为1∶1和2∶1的两种化合物。④的单质与①③两元素组成的某化合物能发生氧化还原反应,化学方程式为_____________。
(4)化合物甲与单质丙均含有⑥元素,其转化关系如图5所示。
图5
已知:单质乙与单质丙位于同一主族。试写出反应a的化学方程式 。甲的一种重要用途是_________。
(5)⑤是一种金属元素。阳极氧化,是常用于⑤单质M的表面处理技术。如图6,组装好仪器,接通开关K,通电约25min。在阳极M表面生成一层致密的氧化膜,该氧化膜难溶于稀硫酸,阴极产生气体。写出该过程中的电极反应式:
图6
阳极 ;
阴极 。
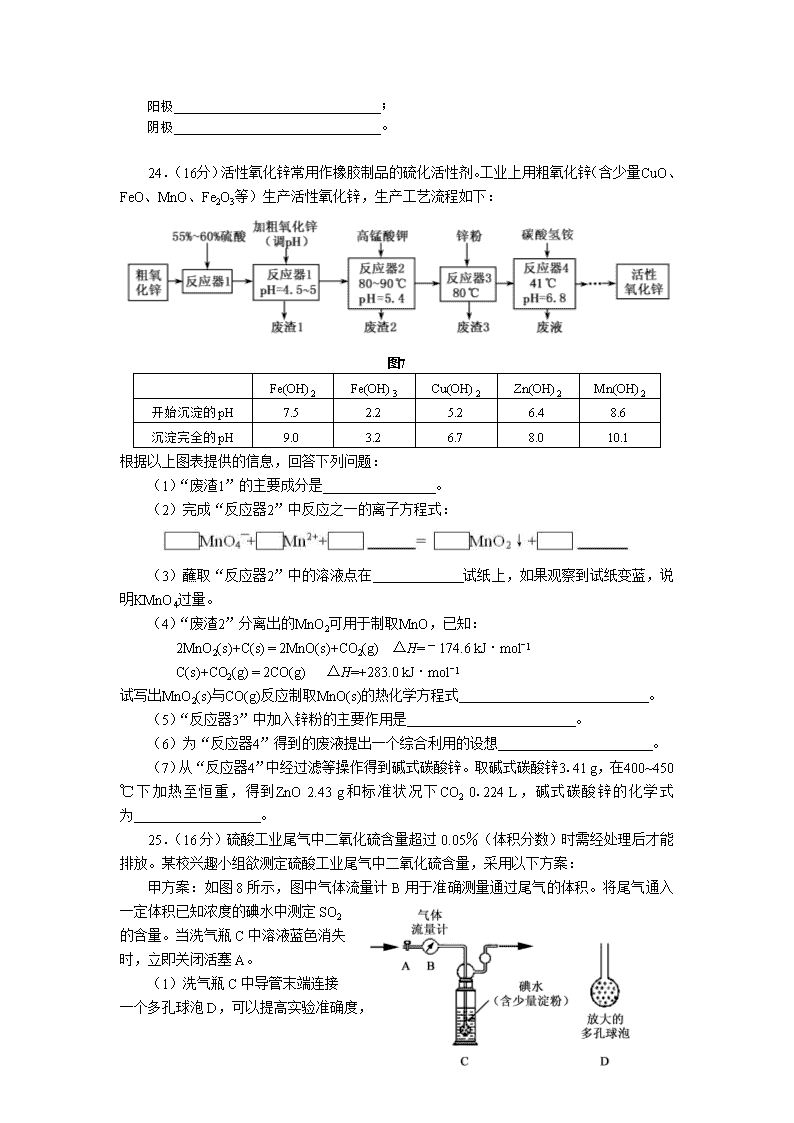
24.(16分)活性氧化锌常用作橡胶制品的硫化活性剂。工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下:
图7
Fe(OH)2
Fe(OH)3
Cu(OH)2
Zn(OH)2
Mn(OH)2
开始沉淀的pH
7.5
2.2
5.2
6.4
8.6
沉淀完全的pH
9.0
3.2
6.7
8.0
10.1
根据以上图表提供的信息,回答下列问题:
(1)“废渣1”的主要成分是 。
(2)完成“反应器2”中反应之一的离子方程式:
(3)蘸取“反应器2”中的溶液点在 试纸上,如果观察到试纸变蓝,说明KMnO4过量。
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s) = 2MnO(s)+CO2(g) △H=–174.6 kJ·molˉ1
C(s)+CO2(g) = 2CO(g) △H=+283.0 kJ·molˉ1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式 。
(5)“反应器3”中加入锌粉的主要作用是 。
(6)为“反应器4”得到的废液提出一个综合利用的设想 。
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌。取碱式碳酸锌3.41 g,在400~450 ℃下加热至恒重,得到ZnO 2.43 g和标准状况下CO2 0.224 L,碱式碳酸锌的化学式为 。
25.(16分)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如图8所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2
的含量。当洗气瓶C中溶液蓝色消失
时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接
一个多孔球泡D,可以提高实验准确度,
其理由是 。
(2)洗气瓶C中的溶液可以用其他
试剂替代,请你举出一种_______________。 图8
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量________(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如图9所示。
溶液
尾气
V L
过量H2O2溶液
①
固体
m g
过量BaCl2溶液
②
过滤、洗涤、干燥、称量
③
图9
(4)写出步骤②中反应的化学方程式______________________ ________。
(5)步骤③中洗涤沉淀的方法是:________________________
____________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为 (用含有V、m的代数式表示)。
丙方案:先将SO2转化为亚硫酸钡,测定质量,求得SO2含量,实验步骤如图10所示。
尾气
V L
固体
m g
过滤、洗涤、干燥、称量
②
过量Ba(OH)2溶液
①
图10
(7)你认为丙方案是否合理,说明理由:______________________________________
__________________________________。
选考部分——
以下两题任选一题作答,若两题都作答,则按第30题计分。
30. [物质结构与性质] (13分)
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1
I1
I2
I3
I4
X
578
1817
2745
11578
Y
738
1451
7733
10540
X的第一电离能<Y的第一电离能,其原因是___________________________________
(2)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似,KCl、MgO、CaO、TiN四种离子晶体的熔点从高到低的顺序是________________。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。(提示:V、Cr分别位于第四周期ⅤB、ⅥB族)
(4)据报道,新发现只含镁、镍和碳三种元素的某晶体具有超
导性,鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体晶
胞如图11所示,图中:碳原子用小球,镍原子用大球,镁原子
用大球,试写出该晶体的化学式____________。晶体中每个镁原子
周围距离最近的镍原子有____个。 图11
(5)据报道,科学家研究出一种硬度比金刚
石还大的晶体,该晶体由短周期相邻两元素组成,
结构如图12,试写出其化学式 ,硬度大于
金刚石的主要原因是________________________ 图12 _______________________________。
(6)为研究人体内三聚氰胺致结石的成因,浙江台州学院医药化工系学者选取几个典型的二价金属离子与三聚氰胺(代号L)形成的三聚氰胺金属配合物ML2(OH)2(其中M=Ca、Mg、Zn、Cu、Ni或Fe等)进行研究,ML2(OH)2的结构如图13所示,三聚氰胺分子中的N原子与金属原子M以________键结合。
三聚氰胺金属配合物ML2(OH)2 L
图13
31. [有机化学基础] (13分)
以下几种有机物是常用香精的主要成分:
百里香酚 苏合香醇 风信子醛 枯茗醛
图14
(1)鉴别百里香酚和苏合香醇可采用的试剂为 ;
(2)苏合香醇能发生的有机反应类型有 ;(填序号)
A.加成反应 B.消去反应 C.加聚反应
D.取代反应 E.氧化反应
(3)符合下列条件的风信子醛的同分异构体有 种:
a. 含有苯环,苯环上有两个支链
b.与新制氢氧化铜悬浊液共热无砖红色沉淀
(4)已知醛在一定条件下可以两分子加成:
由枯茗醛合成兔耳草醛的路线如图15所示:
图15
①写出有机物A、B的结构简式 、 。
②写出有机物C→兔耳草醛的化学方程式 。
参考答案一:
6.D 7.B 8.C 9.D 10.C 11.B 12.B
23. +6
2
4
(1) (1分)
(2)HClO4>H2SO4>H2CO3(2分)
(3)2Na+2H2O=2NaOH+ H 2↑(2分)
(4)SiO2+2C高温
Si+CO↑(2分)制光纤(2分)
(5)2Al+3H2O−6e- =Al2O3+6H+(2分);6H++6e-=3H2↑(或2H++2e-=H2↑)(2分)
24.(1)Fe(OH)3(2分)
(2)2MnO4ˉ+3Mn2++2H2O=5MnO2↓+4H+(3分)
(3)淀粉碘化钾(2分)
(4)MnO2(s)+CO(g) = MnO(s)+CO2(g) △H=–228.8 kJ·molˉ1(3分)
(5)除去Cu2+(1分);若答“除去Cu2+和过量KMnO4”者,同样得分;若只答“除去过量KMnO4”者,不给分。
(6)制复合肥或其它合理答案(2分)
(7)ZnCO3·2Zn(OH)2·H2O或Zn3(OH)4CO3·H2O或2Zn(OH)2·ZnCO3·H2O(3分)
25.(1)增大气体与溶液的接触面积,有利于SO2与碘水充分反应(2分)
(2)高锰酸钾溶液等合理答案(2分)
(3)偏低(2分)
(4)H2SO4+BaCl 2=BaSO4↓+2HCl(2分)
(5)向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次(2分)(6)或(3分)
(7)不合理(1分)。亚硫酸钡被(氧气)部分氧化为硫酸钡,尾气中的CO2气体也能产生沉淀(2分,写出以上两个理由之一即可得分)
30.(1)Mg失去1个电子时,由较稳定的3p0全空状态转变为不稳定的3 s 1状态(或:Al失去1个电子时,由不稳定的3p1状态转变为较稳定的3p0全空状态)(2分)
(2)TiN>MgO>CaO>KCl(2分);
(3)CrO2(2分);
(4)MgCNi3 或MgNi3C等合理答案(2分);12(1分)
(5)C3N4(2分);均为原子晶体,氮碳键的键长更短,键能更大。(1分)
(6)配位键(1分)。
31.(1)FeCl3溶液 或 浓溴水(2分)
(2)A、B、D、E(2分)
(3)三种()(2分)
(4)①
、 (各2分)
②
(3分)
相关文档
- 高考高中必背古诗文50篇带注音完美2021-05-1315页
- 2016年全国高考英语试题及答案全国2021-05-1310页
- 湖北高考理综化学试题及答案解析2021-05-138页
- 高考化学必修12试题汇编及详细解析2021-05-1310页
- 高考数学理函数、基本初等函数的图2021-05-135页
- 浙江省高考英语二轮复习写作提升练2021-05-134页
- 高考作文万能素材模板—青春成长2021-05-1320页
- 高考数学专题轨迹方程问题汇总已可2021-05-1312页
- 人教物理2019高考一轮优练题10含答2021-05-135页
- 2017年度高考物理(电学实验与创新)二2021-05-1321页