- 218.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
26.(15)
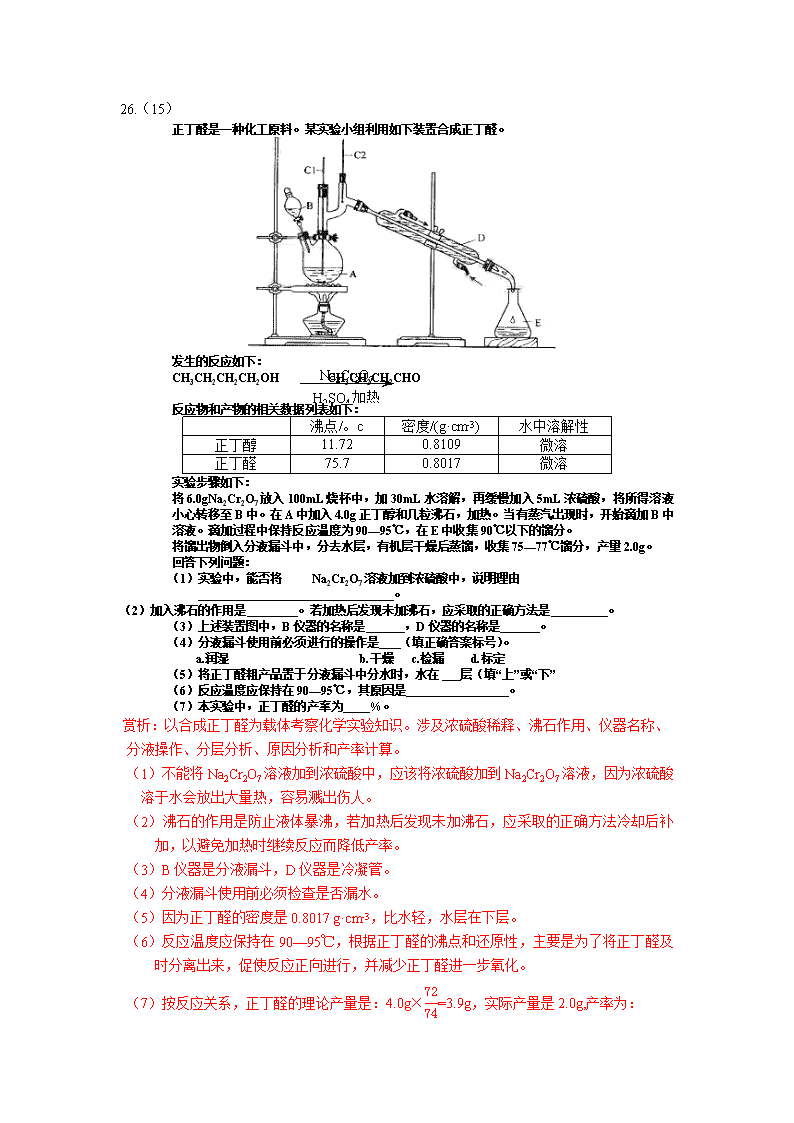
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
Na2Cr2O7
H2SO4加热
发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/。c
密度/(g·cm-3)
水中溶解性
正丁醇
11.72
0.8109
微溶
正丁醛
75.7
0.8017
微溶
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将 Na2Cr2O7溶液加到浓硫酸中,说明理由
。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”
(6)反应温度应保持在90—95℃,其原因是 。
(7)本实验中,正丁醛的产率为 %。
赏析:以合成正丁醛为载体考察化学实验知识。涉及浓硫酸稀释、沸石作用、仪器名称、
分液操作、分层分析、原因分析和产率计算。
(1)不能将Na2Cr2O7溶液加到浓硫酸中,应该将浓硫酸加到Na2Cr2O7溶液,因为浓硫酸溶于水会放出大量热,容易溅出伤人。
(2)沸石的作用是防止液体暴沸,若加热后发现未加沸石,应采取的正确方法冷却后补加,以避免加热时继续反应而降低产率。
(3)B仪器是分液漏斗,D仪器是冷凝管。
(4)分液漏斗使用前必须检查是否漏水。
(5)因为正丁醛的密度是0.8017 g·cm-3,比水轻,水层在下层。
(6)反应温度应保持在90—95℃,根据正丁醛的沸点和还原性,主要是为了将正丁醛及时分离出来,促使反应正向进行,并减少正丁醛进一步氧化。
(7)按反应关系,正丁醛的理论产量是:4.0g×=3.9g,实际产量是2.0g,产率为:
×100%=51.3%。
参考答案:
(1)不能,浓硫酸溶于水会放出大量热,容易溅出伤人。
(2)防止液体暴沸;冷却后补加;
(3)分液漏斗;冷凝管。
(4)c
(5)下
(6)为了将正丁醛及时分离出来,促使反应正向进行,并减少正丁醛进一步氧化。
(7)51%
28.(14号)
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g)B(g)+C(g) △H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
0
1
2
4
8
16
20
25
30
总压强p/100kPa
4.91
5.58
6.32
7.31
8.54
9.50
9.52
9.53
9.53
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
反应时间t/h
0
4
8
16
C(A)/(mol·L-1)
0.10
a
0.026
0.0065
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,
由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1
赏析:考察化学平衡知识,涉及平衡移动,转化率、平衡常数、平衡计算、反应速率、表格
数据分析。
(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A) mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
= α(A)=( -1)×100%;α(A)=(-1)×100%=94.1%
平衡浓度C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,
K==1.5
(3)①= n=0.1× ;其中,n(A)=0.1-(0.1×-0.1)=0.1×(2-)
②n(A)=0.1×(2-)=0.051 C(A)=0.051/1=0.051mol/L
每间隔4小时,A的浓度为原来的一半。
当反应12小时时,C(A)=0.026/2=0.013mol/L
参考答案:
(1)升高温度、降低压强
(2)α(A)=( -1)×100%;94.1%;K==1.5;
(3)①0.1×;0.1×(2-);
②0.051;每间隔4小时,A的浓度为原来的一半。0.013
37.[化学——选修3:物质结构与性质](15分)
前四周期原子序数依次增大的元素A,B,C,D中,
A和B的价电子层中未成对电子均只有1个,平且A-和B+
的电子相差为8;与B位于同一周期的C和D,它们价
电子层中的未成对电子数分别为4和2,且原子序数
相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,
电负性最大的是________。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
参考答案:
(1)
(2)K F
(3)①K2NiF4; 6
②=3.4
27.(14分) 某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
【答案解析】(1)
(2) CaFe(CO3)2 CaFe(CO3)2 CaO+FeO+2CO2↑
(3) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4) 2FeO+CO2Fe2O3+CO 检验方法:将固体用盐酸溶解,加入KSCN溶液,若溶液呈红色,证明有Fe(III);检测CO:将气体通入灼烧CuO,黑色固体变成红色。
28.(14分)在全球一致倡导低碳经济的大背景下,对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
(1)以CO和O2为电极燃料,以KOH溶液为电解质组成燃料电池,请写出该电池的负极反应式 .
(2)25℃时,1mol 石墨和1mol CO完全燃烧放出热量分别为393.5kJ、283.0kJ.请写出石墨不完全燃烧时的热化学方程式 .
(3)25℃时,反应2CO2(g)⇌2CO(g)+O2(g)的平衡常数K=1.72×10﹣46.在一个体积可变的密闭容器中充入一定量CO2、CO、O2的混合气体,以下说法正确的是 .
A.要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是<1.72×10﹣46
B.达平衡后,其他条件不变时,升高温度或增加容器的压强,平衡均逆向移动
C.平衡常数K随温度的升高而增大
D.平衡常数K随压强的增大而减小
(4)25℃时,在一个保持恒温恒容的密闭容器中充入一定量CO2、CO、O2的混合气体,从起始到t1时刻达到平衡状态,速率变化如图所示.在t2时刻再加入一定量的CO2后于t3时刻达到新的平衡,请画出t2~t3的速率变化图(需标出v正,v逆).
【答案与解析】:(1)碱性条件下,燃料电池的负极上CO失电子生成CO32﹣,负极反应式为CO﹣2e﹣+4OH﹣═CO32﹣+2H2O,故答案为:CO﹣2e﹣+4OH﹣═CO32﹣+2H2O;
(2)25℃时,1mol 石墨和1mol CO完全燃烧放出热量分别为393.5kJ、283.0kJ,
则①C(石墨,s)+O2(g)=CO2(g)△H=﹣393.5kJ/mol,
②CO(g)+O2(g)=CO2(g)△H=﹣283.0kJ/mol
根据盖斯定律①﹣②得:C(石墨,s)+O2(g)═CO(g)△H=﹣110.5 kJ/mol;
故答案为:C(石墨,s)+O2(g)═CO(g)△H=﹣110.5 kJ/mol;
(3)A.当>1.72×10﹣46,平衡正移,所以要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是>1.72×10﹣46,故A错误;
B.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,该反应正方向为体积增大的方向,所以增大压强平衡逆移,故B错误;
C.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,K增大,故C正确;
D.平衡常数K只随温度的变化而变化,所以增大压强平衡常数不变,故D错误;
故答案为:C;
(4)25℃时,在一个保持恒温恒容的密闭容器中充入一定量CO2、CO、O2的混合气体,从起始到t1时刻达到平衡状态,速率变化如图所示.在t2时刻再加入一定量的CO2后正反应速率瞬间增大,然后逐渐减小,逆反应速率逐渐增大,于t3时刻达到新的平衡,依此作图为,
故答案为:.
37.【化学——选修三:物质结构与性质】(15分)
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg﹣1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.
回答下列问题:
(1)写出基态Fe2+的核外电子排布式 .K4[Fe(CN)6]中Fe2+与CN﹣之间的作用力是 .
(2)CN﹣中碳原子的杂化方式为 ;1molCN﹣中含有π键的数目为 .
(3)金属钾、铁的晶体的晶胞结构如图,钾、铁两种晶体晶胞中金属原子的配位数之比为 2:3 .
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN﹣是等电子体的气态化合物,反应化学方程式为 .
宁可累死在路上,也不能闲死在家里!宁可去碰壁,也不能面壁。是狼就要练好牙,是羊就要练好腿。什么是奋斗?奋斗就是每天很难,可一年一年却越来越容易。不奋斗就是每天都很容易,可一年一年越来越难。能干的人,不在情绪上计较,只在做事上认真;无能的人!不在做事上认真,只在情绪上计较。拼一个春夏秋冬!赢一个无悔人生!早安!—————献给所有努力的人.
相关文档
- 2018全国卷高考语文-答题卡模板2021-05-132页
- 高考物理三轮冲刺导学案竖直上抛运2021-05-137页
- 2011高考生物一轮复习作业选修3 专2021-05-137页
- 高考生物专项训练——人类的遗传病2021-05-1310页
- 2015高考数学(文)(平面向量的数量积及2021-05-139页
- 2019高考数学专题精练坐标系2021-05-136页
- 高考真题——化学北京卷2021-05-1310页
- 高考物理时检测试题电磁感应与力和2021-05-137页
- 高考英语一轮巩固达标练Unit4Pygma2021-05-138页
- 2013年(全国卷II)(含答案)高考文科2021-05-1320页