- 228.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
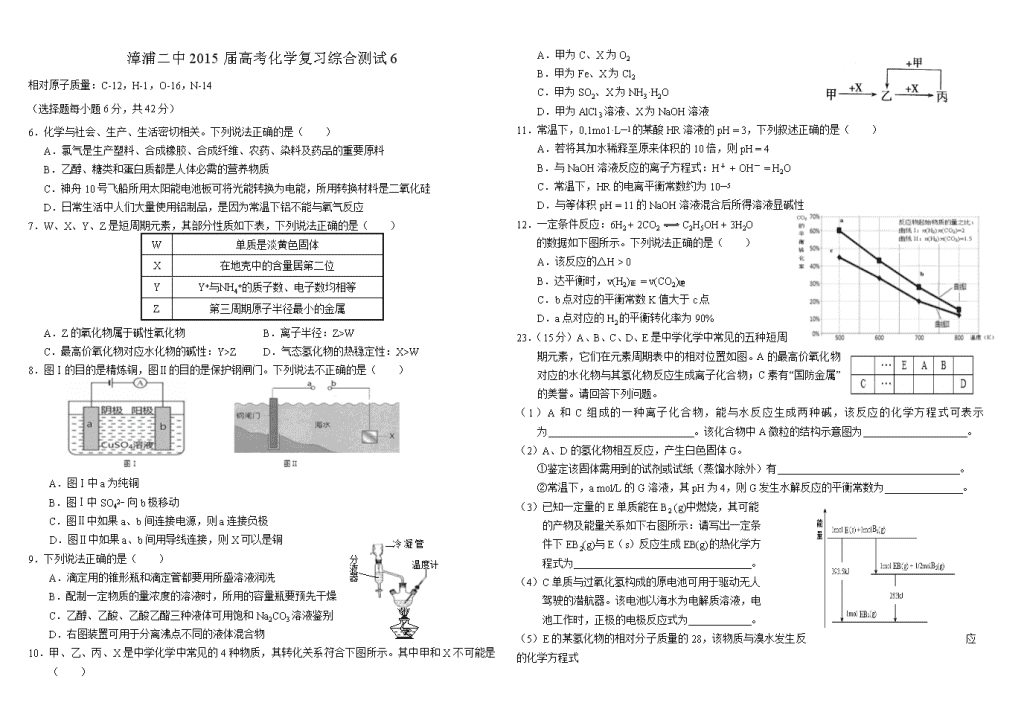
漳浦二中2015届高考化学复习综合测试6
相对原子质量:C-12,H-1,O-16,N-14
(选择题每小题6分,共42分)
6.化学与社会、生产、生活密切相关。下列说法正确的是( )
A.氯气是生产塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料
B.乙醇、糖类和蛋白质都是人体必需的营养物质
C.神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅
D.日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应
7.W、X、Y、Z是短周期元素,其部分性质如下表,下列说法正确的是( )
W
单质是淡黄色固体
X
在地壳中的含量居第二位
Y
Y+与NH4+的质子数、电子数均相等
Z
第三周期原子半径最小的金属
A.Z的氧化物属于碱性氧化物 B.离子半径:Z>W
C.最高价氧化物对应水化物的碱性:Y>Z D.气态氢化物的热稳定性:X>W
8.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是( )
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42– 向b极移动
C.图Ⅱ中如果a、b间连接电源,则a连接负极
分液器
温度计
冷凝管理
D.图Ⅱ中如果a、b间用导线连接,则X可以是铜
9.下列说法正确的是( )
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.配制一定物质的量浓度的溶液时,所用的容量瓶要预先干燥
C.乙醇、乙酸、乙酸乙酯三种液体可用饱和Na2CO3溶液鉴别
D.右图装置可用于分离沸点不同的液体混合物
10.甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合下图所示。其中甲和X不可能是( )
A.甲为C、X为O2
B.甲为Fe、X为Cl2
C.甲为SO2、X为NH3·H2O
D.甲为AlCl3溶液、X为NaOH溶液
11.常温下,0.1mo1·L—1的某酸HR溶液的pH = 3,下列叙述正确的是( )
A.若将其加水稀释至原来体积的10倍,则pH = 4
B.与NaOH溶液反应的离子方程式:H+ + OH- = H2O
C.常温下,HR的电离平衡常数约为10—5
D.与等体积pH = 11的NaOH溶液混合后所得溶液显碱性
12.一定条件反应:6H2 + 2CO2C2H5OH + 3H2O
的数据如下图所示。下列说法正确的是( )
A.该反应的△H > 0
B.达平衡时,v(H2)正 = v(CO2)逆
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
23.(15分)A、B、C、D、E是中学化学中常见的五种短周期元素,它们在元素周期表中的相对位置如图。A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C素有“国防金属”的美誉。请回答下列问题。
(1)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式可表示为 。该化合物中A微粒的结构示意图为 。
(2)A、D的氢化物相互反应,产生白色固体G。
①鉴定该固体需用到的试剂或试纸(蒸馏水除外)有 。
②常温下,a mol/L的G溶液,其pH为4,则G发生水解反应的平衡常数为 。
(3)已知一定量的E单质能在B2 (g)中燃烧,其可能
的产物及能量关系如下右图所示:请写出一定条
件下EB2(g)与E(s)反应生成EB(g)的热化学方
程式为 。
(4)C单质与过氧化氢构成的原电池可用于驱动无人
驾驶的潜航器。该电池以海水为电解质溶液,电
池工作时,正极的电极反应式为 。
(5)E的某氢化物的相对分子质量的28,该物质与溴水发生反应的化学方程式
为 。
24.(15分)氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂。已知:
a.Cu2Cl2不溶于乙醇,在空气中会被迅速氧化;
b.在pH≥4时,Cu2+开始以碱式盐形式沉淀;
c.Cu2Cl2能溶于浓盐酸生成配合物,该配合物加水稀释后会重新析出Cu2Cl2沉淀。
(1)Cu2Cl2的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。该反应的化学方程式为 。
(2)工业上处理、回收含铜电缆废料制备氯化亚铜的方案如下:
①反应①符合绿色化学思想,则稀酸A为 ,单质B为 。
②反应②的离子方程式是 。
为提高Cu2Cl2的产率,工业上常在反应②的溶液中加入适量稀碱溶液,控制pH为
3.5左右,其目的是 。
③保持各反应物的最佳配比,改变温度,测得Cu2Cl2
产率的变化如右图所示,则反应最佳温度为 。
④析出的氯化亚铜晶体要立即用无水乙醇洗涤,然后
真空干燥、冷却,密封包装。真空干燥,密封包装
的目的是 。
25.(15分)氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN–
等形式存在于废水中。某化学小组同学对含氰化物废水处理进行研究。
I.查阅资料:含氰化物的废水破坏性处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN–离子氧化成CNO–(CN–和CNO–中N元素均为-3价),CNO—在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
II.实验验证:破坏性处理CN–的效果。
化学兴趣小组同学在密闭系统中用上图装置进行实验,以测定CN–被处理的百分率,实验步骤如下:
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN—离子的废水与过量NaClO溶液的混合液200mL(设其中CN–
的浓度为0.2mol•L–1)倒入甲中,塞上橡皮塞。
步骤3:
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)。
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO–反应的离子方程式为
(2)完成步骤3:
(3)丙装置中的试剂是 ,丁装置的目的是 。
(4)干燥管Ⅱ的作用是 。
(5)请简要说明实验中通入N2的目的: 。
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为 。
31.[化学一物质结构与性质](13分)
海底热液研究处于当今科研的前沿,海底热液活动区域“黑烟囱”的
周围存在FeS、黄铜矿及锌矿等矿物。
(1)酸性热液中大量存在仅由H、O元素组成的一价阳离子,其结构
如图甲所示,它的化学式为 。该离子中存在的化学键有 。
A.离子键 B.共价键 C.氢键 D.范德华力 E.配位键
(2)FeS中铁元素微粒的价电子排布为 。
(3)已知SCN一中各原子最外层均满足8电子稳定结构,其中S、C两种元素相比较,电负性更大的是 ,C原子的杂化方式为 ,该原子团中σ键和л键个数的比为 。
(4)硫与硒同主族,H2Se与H2S的第一电离平衡常数K1分别为1.3×10—4和1.3×10—7,请从结构的角度解释其原因 。
(5)纯钛铐瓷牙是近几年才发展成熟的金属铐瓷技术,过氧硫酸被用于假牙的消毒。过氧硫酸可由氯磺酸通过反应:H2O2 + ClSO2OHH2SO5 + HCl
制得,氯磺酸的结构如右图。
①氯磺酸中是否存在配位键 (填“是”或“否”)。
②写出过氧硫酸的结构式 。
化学综合测试6参考答案
6-12:ACDCBCD
23.(15分)
(1)Mg3N2 + 8H2O = 3Mg(OH)2 + 2NH3·H2O(3分) N3—离子的结构示意图(2分)
(2)①氢氧化钠溶液、红色石蕊试纸(pH试纸)(1分)硝酸银溶液、稀硝酸(1分)
②10—8/(a-10-4)(2分)
(3)CO2(g)+C(s)=2CO(g)△H= +172.5kJ/mol(2分)
(4)(2分) (5)CH2=CH2+Br2→CH2BrCH2Br(2分)
24.(15分)
(1)Cu2Cl2+2CO+2H2O==[Cu2Cl2(CO)2·2H2O](3分)
(2)① 稀硫酸(2分) 氧气(2分)
②2Cu2++SO32-+2Cl-+H2O=Cu2Cl2↓+SO42-+2H+(2分)
既能中和反应生成的H+,有利于反应向右进行,又能防止生成碱式盐沉淀(2分)
③55℃(2分) ④防止氯化亚铜在空气中会被氧化而变质(2分)
25.(15分)
(1)2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O(3分)
(2)点燃酒精灯对丁装置加热(2分) (3)浓硫酸(2分),除去Cl2(2分)
(4)防止空气中的水和CO2进入干燥管I中影响对CO2的测量。(2分)
(5)使装置中的CO2全部被排到干燥管I中被吸收,减少误差。(2分)
(6)80%(2分)
31.[化学一物质结构与性质](13分)
(1)H11O5+(2分)BE(2分) (2)3d6(1分)
(3)S(1分)sp(1分)1:1(1分)
(4)H2Se中H—Se键的键能比H2S中H—S键键能小,在水分子作用下容易断裂,所以酸性更强。(2分)
(5)①是(1分) ② (2分)
化学综合测试6参考答案
6-12:ACDCBCD
23.(15分)
(1)Mg3N2 + 8H2O = 3Mg(OH)2 + 2NH3·H2O(3分) N3—离子的结构示意图(2分)
(2)①氢氧化钠溶液、红色石蕊试纸(pH试纸)(1分)硝酸银溶液、稀硝酸(1分)
②10—8/(a-10-4)(2分)
(3)CO2(g)+C(s)=2CO(g)△H= +172.5kJ/mol(2分)
(4)(2分) (5)CH2=CH2+Br2→CH2BrCH2Br(2分)
24.(15分)
(1)Cu2Cl2+2CO+2H2O==[Cu2Cl2(CO)2·2H2O](3分)
(2)① 稀硫酸(2分) 氧气(2分)
②2Cu2++SO32-+2Cl-+H2O=Cu2Cl2↓+SO42-+2H+(2分)
既能中和反应生成的H+,有利于反应向右进行,又能防止生成碱式盐沉淀(2分)
③55℃(2分) ④防止氯化亚铜在空气中会被氧化而变质(2分)
25.(15分)
(1)2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O(3分)
(2)点燃酒精灯对丁装置加热(2分) (3)浓硫酸(2分),除去Cl2(2分)
(4)防止空气中的水和CO2进入干燥管I中影响对CO2的测量。(2分)
(5)使装置中的CO2全部被排到干燥管I中被吸收,减少误差。(2分)
(6)80%(2分)
31.[化学一物质结构与性质](13分)
(1)H11O5+(2分)BE(2分) (2)3d6(1分)
(3)S(1分)sp(1分)1:1(1分)
(4)H2Se中H—Se键的键能比H2S中H—S键键能小,在水分子作用下容易断裂,所以酸性更强。(2分)
(5)①是(1分) ② (2分)