- 642.59 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017年高考化学真题分类汇编
非金属及其化合物(必修1)
Ⅰ—无机非金属材料的主角——硅 (碳族元素)
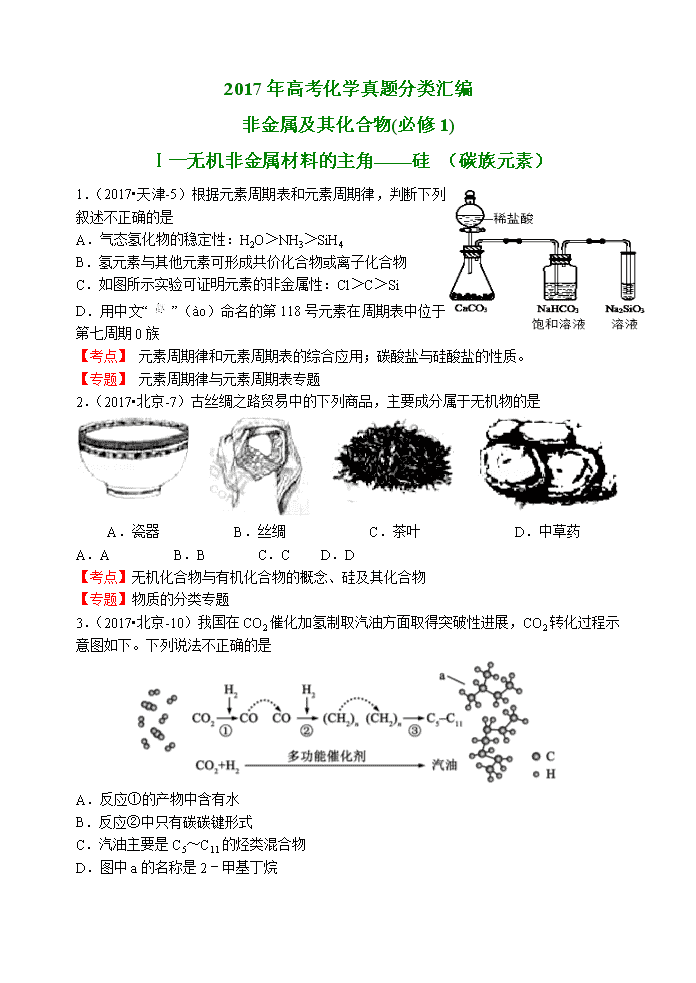
1.(2017•天津-5)根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
【考点】 元素周期律和元素周期表的综合应用;碳酸盐与硅酸盐的性质。 菁优网版权所【专题】 元素周期律与元素周期表专题
2.(2017•北京-7)古丝绸之路贸易中的下列商品,主要成分属于无机物的是
A.瓷器
B.丝绸
C.茶叶
D.中草药
A.A B.B C.C D.D
【考点】无机化合物与有机化合物的概念、硅及其化合物 菁优网版权所有
【专题】物质的分类专题
3.(2017•北京-10)我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下。下列说法不正确的是
A.反应①的产物中含有水
B.反应②中只有碳碳键形式
C.汽油主要是C5~C11的烃类混合物
D.图中a的名称是2﹣甲基丁烷
【考点】 碳族元素简介;有机物的结构;汽油的成分;有机物的系统命名法 菁优网版权【专题】 碳族元素 ;观察能力、自学能力。
4.(2017•北京-11)根据SO2通入不同溶液中实验现象,所得结论不正确的是
实验
现象
结论
A
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
A.A B.B C.C D.D
【考点】 硫及其化合物的性质 ;硅及其化合物的性质;铁及其化合物的性质。
【专题】 氧族元素
5.(2017•江苏-3)下列有关物质性质与用途具有对应关系的是
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
【考点】物质的组成、结构和性质的关系:钠及其化合物;硅及其化合物;氯及其化合物;氮及其化合物;
【专题】 物质的性质和变化专题。
6.(2017•北京-13)下述实验中均有红棕色气体产生,对比分析所的结论不正确的是
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【考点】 氮及其化合物;碳及其化合物;硝酸的化学性质菁优网版权所有
【专题】 氮族元素
7.(2017•江苏-7)在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeFeCl2Fe(OH)2
B.SSO3H2SO4
C.CaCO3CaOCaSiO3
D.NH3NOHNO3
【考点】 铁及其化合物; 硫及其化合物;氮及其化合物;碳、硅及其化合物;
【专题】 物质的性质和变化专题
8.(14分)(2017•新课标Ⅱ-26)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是 ,还可使用 代替硝酸。
(2)沉淀A的主要成分是 ,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 。
(3)加氨水过程中加热的目的是 。沉淀B的主要成分为 (填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4﹣+H++H2C2O4→Mn2++CO2+H2O.实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L﹣1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为 。
【考点】 探究物质的组成或测量物质的含量 ;硅及其化合物;铁、铝及其化合物;胶体的性质;化学计算;菁优网版权所有
【专题】 定量测定与误差分析
9.(12分)(2017•江苏-16)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为 。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是
。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.
阳极的电极反应式为 ,阴极产生的物质A的化学式为 。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是
。
【考点】 铝及其化合物;铁及其化合物;硅及其化合物;电解原理;物质分离和提纯的方法和基本操作综合应用;菁优网版权所有
【专题】 物质的分离提纯和鉴别
Ⅱ—氮及其化合物(氮、磷及其化合物)
1.(2017•北京-9)下列变化中,气体被还原的是
A.二氧化碳使Na2O2固体变白
B.氯气使KBr溶液变黄
C.乙烯使Br2的四氯化碳溶液褪色
D.氨气使AlCl3溶液产生白色沉淀
【考点】 氧化还原反应 ;钠及其化合物;卤素;乙烯的性质;氮及其化合物;铝及其化合物。优网版权所有
【专题】 氧化还原反应专题
2.(2017•北京-13)下述实验中均有红棕色气体产生,对比分析所的结论不正确的是
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【考点】 氮及其化合物;碳及其化合物;硝酸的化学性质菁优网版权所有
【专题】 氮族元素
3-.(2017•新课标Ⅱ13)由下列实验及现象不能推出相应结论的是
实验
现象
结论
A.
向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D.
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
A.A B.B C.C D.D
【考点】 化学实验方案的评价;铁及其化合物的性质;钠及其化合物的性质;铵盐的性质;难溶电解质的溶解平衡。菁优网版权所有
【专题】 化学实验基本操作。
3.(2017•江苏)下列有关物质性质与用途具有对应关系的是
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
【考点】物质的组成、结构和性质的关系:钠及其化合物;硅及其化合物;氯及其化合物;氮及其化合物;
【专题】 物质的性质和变化专题。
4.(2017•江苏-7)在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeFeCl2Fe(OH)2
B.SSO3H2SO4
C.CaCO3CaOCaSiO3
D.NH3NOHNO3
【考点】 铁及其化合物; 硫及其化合物;氮及其化合物;碳、硅及其化合物;
【专题】 物质的性质和变化专题
5.(2017•天津-1)下列有关水处理方法不正确的是
A.用石灰、碳酸钠等碱性物质处理废水中的酸
B.用可溶性的铝盐和铁盐处理水中的悬浮物
C.用氯气处理水中的Cu2+、Hg2+等重金属离子
D.用烧碱处理含高浓度NH4+的废水并回收利用氨
【考点】 "三废"处理与环境保护 ;铝盐的性质;铁盐的性质;铵盐的性质;优网版权所【专题】 化学应用
6.(12分)(2017•北京-27)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的
NOx排放。(1)SCR(选择性催化还原)工作原理:
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:
。
②反应器中NH3还原NO2的化学方程式: 。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒.用化学方程式表示(NH4)2SO4的形成: 。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g•mol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol•L﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol•L﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是 。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.
①通过BaO和Ba(NO3) 2的相互转化实验NOx的储存和还原。储存NOx的物质是 。
②用H2模拟尾气中还原性气体研究了Ba(NO3) 2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3) 2的物质的量之比是 。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整: 。
【考点】 氮的氧化物的性质及其对环境的影响;硫及其化合物;化学方程式的有关计算; "三废"处理与环境保护。菁优网版权所有
【专题】 元素及其化合物; 利用化学方程式的计算。
7.(15分)(2017•江苏-19)某科研小组采用如下方案回收一种光盘金属层中的少量Ag
(金属层中其他金属含量过低,对实验的影响可忽略)。
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3•H2O⇌Ag(NH3)2++Cl﹣+2H2O
③常温时 N2H4•H2O(水合肼)在碱性条件下能还原Ag(NH3) 2+:
4Ag(NH3)2++N2H4•H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2,该反应的化学方程式为
。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是
。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3•H2O反应外(该条件下NaClO3与NH3•H2O不反应),还因为
。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:
(实验中须使用的试剂有:2mol•L﹣1水合肼溶液,
1mol•L﹣1H2SO4 )。
【考点】 硝酸的性质;氯及其化合物;物质分离和提纯的方法和基本操作综合应用 菁优【专题】 物质的分离提纯和鉴别
Ⅲ—硫及其化合物(涉及绿色化学)
1.(2017•北京-11)根据SO2通入不同溶液中实验现象,所得结论不正确的是
实验
现象
结论
A
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
A.A B.B C.C D.D
【考点】 硫及其化合物的性质 ;硅及其化合物的性质;铁及其化合物的性质。
【专题】 氧族元素
2.(2017•江苏-4)下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
【考点】 化学实验方案的评价。硫及其化合物。菁优网版权所有
【专题】 实验评价题。
3.(2017•江苏-13)根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀
苯酚浓度小
B
向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
部分Na2SO3被氧化
C
向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜
蔗糖未水解
D
向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色
溶液中含 Br2
A.A B.B C.C D.D
【考点】实验方案的评价;酚;硫及其化合物; 糖类的水解反应;铁及其化合物;卤素;【专题】 实验评价题
4.(2017•江苏-7)在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeFeCl2Fe(OH)2
B.SSO3H2SO4
C.CaCO3CaOCaSiO3
D.NH3NOHNO3
【考点】 铁及其化合物; 硫及其化合物;氮及其化合物;碳、硅及其化合物;
【专题】 物质的性质和变化专题
5.(2017•新课标Ⅲ-7)化学与生活密切相关.下列说法错误的是
A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.天然气和液化石油气是我国目前推广使用的清洁燃料
【考点】 物质的组成、结构和性质的关系。环境保护。优网版权所有
【专题】 化学应用
6.(14分)(2017•天津-10)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题.
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4) 3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4) 3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是
。
(2)由图1和图2判断使用硫杆菌的最佳条件为 。若反应温度过高,反应速率下降,其原因是 。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2) /n(H2S)变化,氧化产物不同.当n(H2O2) /n(H2S)=4
时,氧化产物的分子式为 。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生, NaOH溶液Na2SO3溶液。
(4)写出过程①的离子方程式: ;CaO在水中存在如下转化:
CaO(s) +H2O(l)═Ca(OH)2(s)Ca2+(aq) +2OH﹣(aq),从平衡移动的角度,简述过程②NaOH再生的原理 。
方法2:用氨水除去SO2
(5)已知25℃,NH3•H2O的Kb=1.8×10﹣5,H2SO3的Ka1=1.3×10﹣2,Ka2=6.2×10﹣8.若氨水的浓度为2.0mol•L﹣1,溶液中的c(OH﹣) = mol•L﹣1.将SO2通入该氨水中,当c(OH﹣)降至1.0×10﹣7 mol•L﹣1时,溶液中的c(SO32﹣) /c(HSO3﹣) = 。
【考点】 二氧化硫的污染及治理; 弱电解质在水溶液中的电离平衡; "三废"处理与环境保护。菁优网版权所有
【专题】 化学平衡专题; 元素及其化合物。
7.(14分)(2017•新课标Ⅲ-26)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
①仪器B的名称是 。
②将下列实验操作步骤正确排序 (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x= (列式表示)。若实验时按a、d次序操作,则使x (填“偏大”“偏小”或“无影响”).
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
①C、D中的溶液依次为 (填标号)。C、D中有气泡冒出,并可观察到的现象分别为 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 。
【考点】 性质实验方案的设计;铁及其化合物;硫及其化合物;化学计量。 优网版权所【专题】 无机实验综合
8.(12分)(2017•北京-27)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:
。
②反应器中NH3还原NO2的化学方程式: 。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒.用化学方程式表示(NH4)2SO4的形成: 。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g•mol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol•L﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol•L﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是 。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.
①通过BaO和Ba(NO3) 2的相互转化实验NOx的储存和还原。储存NOx的物质是 。
②用H2模拟尾气中还原性气体研究了Ba(NO3) 2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3) 2的物质的量之比是 。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整: 。
【考点】 氮的氧化物的性质及其对环境的影响;硫及其化合物;化学方程式的有关计算; "三废"处理与环境保护。菁优网版权所有
【专题】 元素及其化合物; 利用化学方程式的计算。
Ⅳ—富集在海水中的元素——氯(卤素)
1.(2017•北京-9)下列变化中,气体被还原的是
A.二氧化碳使Na2O2固体变白
B.氯气使KBr溶液变黄
C.乙烯使Br2的四氯化碳溶液褪色
D.氨气使AlCl3溶液产生白色沉淀
【考点】 氧化还原反应 ;钠及其化合物;卤素;乙烯的性质;氮及其化合物;铝及其化合物。优网版权所有
【专题】 氧化还原反应专题
2.(6分)(2017•天津-4)以下实验设计能达到实验目的是
实验目的
实验设计
A.
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
B.
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C.
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
D.
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
A.A B.B C.C D.D
【考点】 化学实验方案的评价;钠及其化合物;铝及其化合物、铝盐的水解;
混合物的分离与提纯;卤素单质间的置换反应。
【专题】 物质的分离提纯和鉴别
3.(2017•江苏-3)下列有关物质性质与用途具有对应关系的是
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
【考点】物质的组成、结构和性质的关系:钠及其化合物;硅及其化合物;氯及其化合物;氮及其化合物;
【专题】 物质的性质和变化专题。
4.(2017•江苏-13)根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀
苯酚浓度小
B
向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
部分Na2SO3被氧化
C
向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜
蔗糖未水解
D
向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色
溶液中含 Br2
A.A B.B C.C D.D
【考点】实验方案的评价;酚;硫及其化合物; 糖类的水解反应;铁及其化合物;卤素;【专题】 实验评价题
5.(13分)(2017•北京-26)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1412
熔点/℃
﹣69
25
193
304
714
在TiCl4中的溶解性
互溶
﹣
微溶
难溶
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ•mol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJ•mol﹣1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g
)的热化学方程式:
。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的△H 0(填“>”“<”或“=”),判断依据:
。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是
。
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有 。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
物质a是 ,T2应控制在 。
【考点】盖斯定律与热化学方程式的书写; 氯及其化合物;铁及其化合物;金属综合;制备实验方案的设计 菁优网版权所有
【专题】 无机实验综合
7.(15分)(2017•江苏-19)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3•H2O⇌Ag(NH3)2++Cl﹣+2H2O
③常温时 N2H4•H2O(水合肼)在碱性条件下能还原Ag(NH3) 2+:
4Ag(NH3)2++N2H4•H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2,该反应的化学方程式为
。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是
。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3•H2O反应外(该条件下NaClO3与NH3•H2O不反应),还因为
。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:
(实验中须使用的试剂有:2mol•L﹣1水合肼溶液,
1mol•L﹣1H2SO4 )。
【考点】 硝酸的性质;氯及其化合物;物质分离和提纯的方法和基本操作综合应用 菁优【专题】 物质的分离提纯和鉴别
Ⅴ—非金属及其化合物综合
1.(2017•江苏-3)下列有关物质性质与用途具有对应关系的是
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
【考点】物质的组成、结构和性质的关系:钠及其化合物;硅及其化合物;氯及其化合物;氮及其化合物;
【专题】 物质的性质和变化专题。
2.(15分)(2017•江苏-19)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3•H2O⇌Ag(NH3)2++Cl﹣+2H2O
③常温时 N2H4•H2O(水合肼)在碱性条件下能还原Ag(NH3) 2+:
4Ag(NH3)2++N2H4•H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2,该反应的化学方程式为
。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是
。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3•H2O反应外(该条件下NaClO3与NH3•H2O不反应),还因为
。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:
(实验中须使用的试剂有:2mol•L﹣1水合肼溶液,
1mol•L﹣1H2SO4 )。
【考点】 硝酸的性质;氯及其化合物;物质分离和提纯的方法和基本操作综合应用 菁优【专题】 物质的分离提纯和鉴别