- 16.58 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013 年普通高等学校招生全国统一考试(北京卷)
理科综合
本试卷共 16页,共 300分。考试时长 150分钟。考生务必将答案答在答题卡上,在试
卷上作答无效。考试结束后,将本试卷和答题卡一并交回。
以下数据可供解题时参考:
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Ca 40
第一部分(选择题 共 120分)
本部分共 20小题,每小题 6分,共 120分。在每小题列出的四个选项中,选出最符合
题目要求的一项。
1.下列真核细胞结构与成分,对应有误..的是( )
A.细胞膜:脂质、蛋白质、糖类
B.染色体:核糖核酸、蛋白质
C.核糖体:蛋白质、核糖核酸
D.细胞骨架:蛋白质
答案:B
解析:细胞膜的组成成分包括脂质、蛋白质和糖类,A项正确;染色体的组成成分是
DNA和蛋白质,核糖核酸是 RNA,B项不正确;核糖体是由蛋白质和 RNA 组成的,C项
正确;细胞骨架是由蛋白质纤维组成的网架结构,与细胞运动、分裂、分化以及物质运输、
能量转换、信息传递等生命活动密切相关。
2.在细胞生命活动中,不可能...发生的过程是( )
A.神经递质由突触小泡分泌到胞外
B.mRNA从细胞核进入细胞质
C.老化受损的细胞器融入溶酶体中
D.O2通过主动运输进入线粒体
答案:D
解析:神经递质是由突触小泡以胞吐的形式分泌到细胞外面的突触间隙;mRNA 在细
胞核中以 DNA为模板转录合成后,由核孔进入细胞质中;老化受损的细胞器融入溶酶体中,
被溶酶体中的酶水解;O2是通过自由扩散的方式进入线粒体被利用的。
3.有关生物体对刺激做出反应的表述,错误..的是( )
A.病毒感染→人体 T细胞分泌特异性抗体→清除病毒
B.外界温度降低→哺乳动物体温调节中枢兴奋→体温稳定
C.摄入高糖食品→人体胰岛素分泌增加→血糖水平回落
D.单侧光照→植物体生长素重新分布→向光弯曲
答案:A
解析:病毒侵入机体细胞,是寄生在宿主细胞内的,通过细胞免疫使靶细胞裂解死亡。
病原体失去了寄生的基础,因而能被吞噬、消灭。抗体是由浆细胞(效应 B细胞)分泌的。外
界温度降低,人体通过冷觉感受器接受刺激,产生兴奋,将兴奋传导至下丘脑中的体温调节
中枢,然后使有关神经兴奋,进而引起皮肤血管收缩,减少皮肤血流量,从而使皮肤的散热
量减少。与此同时,皮肤立毛肌收缩;骨骼肌也产生不自主战栗,使产热量增加。有关神经
的兴奋还可使肾上腺素分泌增加,导致产热量增加,体温维持稳定。摄入高糖食品使人体血
糖含量升高,此时胰岛素分泌增加,使血糖水平回落。单侧光照引起生长素分布不均匀,背
光侧生长素含量高于向光侧生长素含量,背光侧细胞生长得快,表现为向光弯曲生长。
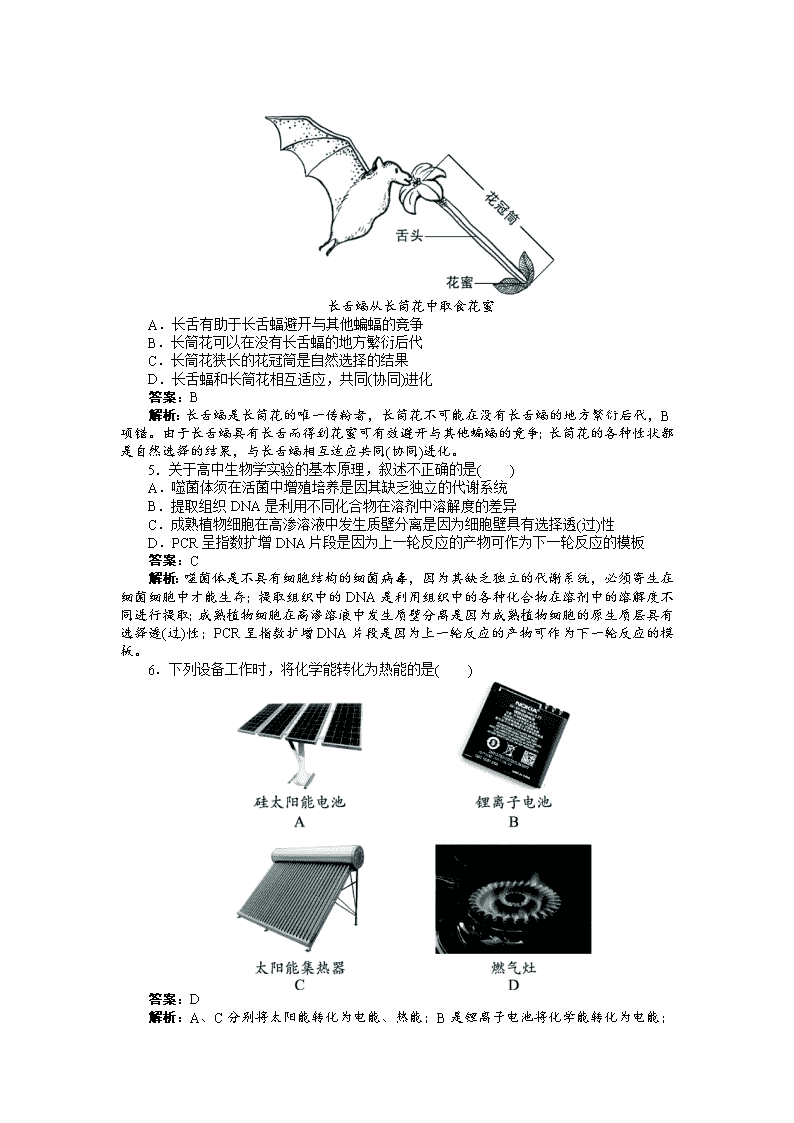
4.安第斯山区有数十种蝙蝠以花蜜为食。其中,长舌蝠的舌长为体长的 1.5倍。只有
这种蝙蝠能从长筒花狭长的花冠筒底部取食花蜜,且为该植物的唯一传粉者。由此无法..推断
出( )
长舌蝠从长筒花中取食花蜜
A.长舌有助于长舌蝠避开与其他蝙蝠的竞争
B.长筒花可以在没有长舌蝠的地方繁衍后代
C.长筒花狭长的花冠筒是自然选择的结果
D.长舌蝠和长筒花相互适应,共同(协同)进化
答案:B
解析:长舌蝠是长筒花的唯一传粉者,长筒花不可能在没有长舌蝠的地方繁衍后代,B
项错。由于长舌蝠具有长舌而得到花蜜可有效避开与其他蝙蝠的竞争;长筒花的各种性状都
是自然选择的结果,与长舌蝠相互适应共同(协同)进化。
5.关于高中生物学实验的基本原理,叙述不正确...的是( )
A.噬菌体须在活菌中增殖培养是因其缺乏独立的代谢系统
B.提取组织 DNA是利用不同化合物在溶剂中溶解度的差异
C.成熟植物细胞在高渗溶液中发生质壁分离是因为细胞壁具有选择透(过)性
D.PCR呈指数扩增 DNA片段是因为上一轮反应的产物可作为下一轮反应的模板
答案:C
解析:噬菌体是不具有细胞结构的细菌病毒,因为其缺乏独立的代谢系统,必须寄生在
细菌细胞中才能生存;提取组织中的 DNA是利用组织中的各种化合物在溶剂中的溶解度不
同进行提取;成熟植物细胞在高渗溶液中发生质壁分离是因为成熟植物细胞的原生质层具有
选择透(过)性;PCR呈指数扩增 DNA 片段是因为上一轮反应的产物可作为下一轮反应的模
板。
6.下列设备工作时,将化学能转化为热能的是( )
答案:D
解析:A、C分别将太阳能转化为电能、热能;B是锂离子电池将化学能转化为电能;
D燃烧,将化学能转化为热能。
7.下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A.水中的钢闸门连接电源的负极
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
答案:A
解析:形成电解池,被保护的金属作阴极,与电源的负极相连,A选项正确。
8.下列解释事实的方程式不准确...的是( )
A.用浓盐酸检验氨:NH3+HCl===NH4Cl
B.碳酸钠溶液显碱性:
2
3CO
+H2O 3HCO
+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2===CaCO3↓+H2O
答案:C
解析:C选项负极电极反应为:Fe-2e-===Fe2+。
9.用石墨电极电解 CuCl2溶液(见下图)。下列分析正确的是( )
A.a端是直流电源的负极
B.通电使 CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-===Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
答案:A
解析:阳离子向阴极移动、阴离子向阳极移动,可知 a为负极、b为正极,A选项正确;
阳极发生失电子的反应生成 Cl2、阴极发生得电子的反应生成 Cu,C、D选项错误;电解质
的电离与是否通电无关,B选项错误。
10.实验:
①0.1 mol·L-1AgNO3溶液和 0.1 mol·L-1NaCl溶液等体积混合得到浊液 a,过滤得到滤
液 b和白色沉淀 c;
②向滤液 b中滴加 0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀 c中滴加 0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A.浊液 a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq)
B.滤液 b中不含有 Ag+
C.③中颜色变化说明 AgCl转化为 AgI
D.实验可以证明 AgI比 AgCl更难溶
答案:B
解析:由②及沉淀溶解平衡 AgCl(s) Ag+(aq)+Cl-(aq)可知 A选项正确、B选项
错误;由③及难溶沉淀可以转化为更难溶沉淀可知 C、D正确。
11.下列实验事实不能用平衡移动原理解释的是( )
A.
将 NO2球浸泡在冷水和热水中
B.
t/℃ 25 50 100
KW/10-14 1.01 5.47 55.0
C.
D.
c(氨水)/(mol·L-1) 0.1 0.01
pH 11.1 10.6
答案:C
解析:催化剂不能使化学平衡发生移动,C选项与化学平衡移动无关。
12.用下图所示装置检验乙烯时不需要...除杂的是( )
乙烯的制备 试剂 X 试剂 Y
A CH3CH2Br与 NaOH乙醇溶液共热 H2O KMnO4酸性溶液
B CH3CH2Br与 NaOH乙醇溶液共热 H2O Br2的 CCl4溶液
C C2H5OH与浓 H2SO4加热至 170℃ NaOH
溶液
KMnO4酸性溶液
D C2H5OH与浓 H2SO4加热至 170℃ NaOH
溶液
Br2的 CCl4溶液
答案:B
解析:A、B制取的乙烯中含有乙醇,乙醇使酸性高锰酸钾溶液褪色,不能使溴的四氯
化碳溶液褪色,所以 B选项不需要除杂;C、D选项中制取的乙烯中含有乙醇、SO2等,SO2
使酸性高锰酸钾溶液、溴的四氯化碳溶液均褪色,所以均需要除杂。
13.下列说法正确的是( )
A.液体中悬浮微粒的无规则运动称为布朗运动
B.液体分子的无规则运动称为布朗运动
C.物体从外界吸收热量,其内能一定增加
D.物体对外界做功,其内能一定减少
答案:A
解析:布朗运动指的是悬浮在液体或气体中的固体微粒的无规则运动,而非液体分子的
运动,选项 A正确,B 错误;根据热力学第一定律,物体的内能的改变取决于做功和热传
递两个方面,故选项 C、D错误。
14.(2013北京理综,14)如图所示,一束可见光射向半圆形玻璃砖的圆心 O,经折射后
分为两束单色光 a和 b。下列判断正确的是( )
A.玻璃对 a光的折射率小于对 b光的折射率
B.a光的频率大于 b光的频率
C.在真空中 a光的波长大于 b光的波长
D.a光光子能量小于 b光光子能量
答案:B
解析:由折射定律 1
2
sin
sin
n
可知,玻璃对 a光的折射率大于对 b光的折射率,选项 A
错误;a光的频率也大于 b光的频率,选项 B正确;由 c=λν可知,真空中 a光的波长小于
b光的波长,选项 C错误;由 E=hν可知,a光光子能量大于 b光光子的能量,选项 D错误。
15.一列沿 x轴正方向传播的简谐机械横波,波速为 4 m/s。某时刻波形如图所示,下
列说法正确的是( )
A.这列波的振幅为 4 cm
B.这列波的周期为 1 s
C.此时 x=4 m处质点沿 y轴负方向运动
D.此时 x=4 m处质点的加速度为 0
答案:D
解析:由图象可得该波的波长为 8 m,振幅为 2 cm,选项 A错误;由 v
T
得周期 T
=2 s,选项 B错误;由波的传播方向与质点振动方向间的关系可知此时 x=4 m处的质点沿
y轴正方向运动,选项 C错误;此时 x=4 m 处的质点处于平衡位置,受到的回复力为 0,
因此加速度也为 0,选项 D正确。
16.倾角为α、质量为 M的斜面体静止在水平桌面上,质量为 m的木块静止在斜面体
上。下列结论正确的是( )
A.木块受到的摩擦力大小是 mgcosα
B.木块对斜面体的压力大小是 mgsinα
C.桌面对斜面体的摩擦力大小是 mgsinαcosα
D.桌面对斜面体的支持力大小是(M+m)g
答案:D
解析:取木块 m为研究对象,受力如图甲所示,根据平衡条件,有摩擦力大小 Ff1=
mgsinα,支持力大小 FN1=mgcosα,对斜面体的压力大小 F′N1=mgcosα,选项 A、B错误;
取斜面体 M及木块 m组成的整体为研究对象,整体静止在水平桌面上,受力如图乙所示,
桌面对斜面体的摩擦力大小 Ff2=0,支持力大小 FN2=(M+m)g,选项 C错误,D正确。
17.如图,在磁感应强度为 B、方向垂直纸面向里的匀强磁场中,金属杆 MN在平行金
属导轨上以速度 v 向右匀速滑动,MN中产生的感应电动势为 E1;若磁感应强度增为 2B,
其他条件不变,MN中产生的感应电动势变为 E2。则通过电阻 R的电流方向及 E1与 E2之比
E1∶E2分别为( )
A.c→a,2∶1 B.a→c,2∶1
C.a→c,1∶2 D.c→a,1∶2
答案:C
解析:由右手定则,可判断出金属杆中的电流方向为 N→M,则电阻 R中的电流方向为
a→c。根据 E=BLv,可得 E1∶E2=1∶2,选项 C正确。
18.某原子电离后其核外只有一个电子,若该电子在核的静电力作用下绕核做匀速圆周
运动,那么电子运动( )
A.半径越大,加速度越大
B.半径越小,周期越大
C.半径越大,角速度越小
D.半径越小,线速度越小
答案:C
解析:根据题意,静电力提供电子做圆周运动的向心力,有 2
kQe
r
=ma=m
2
2
4π
T
r=mω2r
=
2vm
r
,可得 2
kQea
mr
,
2 34π mrT
kQe
, 3
kQe
mr
,
kQev
mr
,可见,半径越大,
加速度越小,角速度越小;半径越小,周期越小,线速度越大。则选项 A、B、D错误,C
正确。
19.在实验操作前应该对实验进行适当的分析。研究平抛运动的实验装置示意如图。小
球每次都从斜槽的同一位置无初速释放,并从斜槽末端水平飞出。改变水平板的高度,就改
变了小球在板上落点的位置,从而可描绘出小球的运动轨迹。某同学设想小球先后三次做平
抛,将水平板依次放在如图 1、2、3的位置,且 1与 2的间距等于 2与 3的间距。若三次实
验中,小球从抛出点到落点的水平位移依次为 x1、x2、x3,机械能的变化量依次为E1、 E2、
E3,忽略空气阻力的影响,下面分析正确的是( )
A.x2-x1=x3-x2, E1= E2= E3
B.x2-x1>x3-x2, E1= E2= E3
C.x2-x1>x3-x2, E1< E2< E3
D.x2-x1<x3-x2, E1< E2< E3
答案:B
解析:平抛运动的物体在竖直方向为匀加速运动,因此小球通过竖直方向上相等距离所
用的时间 t越来越短,由 x=v0 t可知,x2-x1>x3-x2,小球平抛运动的过程中机械能
守恒,则有E1= E2= E3=0,选项 B正确。
20.以往我们认识的光电效应是单光子光电效应,即一个电子在极短时间内只能吸收到
一个光子而从金属表面逸出。强激光的出现丰富了人们对于光电效应的认识,用强激光照射
金属,由于其光子密度极大,一个电子在极短时间内吸收多个光子成为可能,从而形成多光
子光电效应,这已被实验证实。
光电效应实验装置示意如图。用频率为ν的普通光源照射阴极 K,没有发生光电效应。
换用同样频率ν的强激光照射阴极 K,则发生了光电效应;此时,若加上反向电压 U,即将
阴极 K接电源正极,阳极 A接电源负极,在 KA之间就形成了使光电子减速的电场。逐渐
增大 U,光电流会逐渐减小;当光电流恰好减小到零时,所加反向电压 U可能是下列的(其
中 W为逸出功,h为普朗克常量,e为电子电量)( )
A.
h WU
e e
B.
2h WU
e e
C.U=2hν-W D.
5h WU
e e
答案:B
解析:由题意可知,一个电子一次吸收了 n 个光子,则有 eU=nhν-W,整理得
nh WU
e e
,因 n只能取整数且 n≥2,故选项 B正确。
第二部分(非选择题 共 180分)
本部分共 11小题,共 180分。
21. (18分)
某同学通过实验测定一个阻值约为 5 Ω的电阻 Rx的阻值。
(1)现有电源(4 V,内阻可不计)、滑动变阻器(0~50 Ω,额定电流 2 A)、开关和导线若
干,以及下列电表:
A.电流表(0~3 A,内阻约 0.025 Ω)
B.电流表(0~0.6 A,内阻约 0.125 Ω)
C.电压表(0~3 V,内阻约 3 kΩ)
D.电压表(0~15 V,内阻约 15 kΩ)
为减小测量误差,在实验中,电流表应选用______,电压表应选用______(选填器材前
的字母);实验电路应采用图 1中的______(选填“甲”或“乙”)。
图 1
(2)图 2是测量 Rx的实验器材实物图,图中已连接了部分导线。请根据在(1)问中所选的
电路图,补充完成图 2中实物间的连线。
图 2
(3)接通开关,改变滑动变阻器滑片 P的位置,并记录对应的电流表示数 I、电压表示数
U。某次电表示数如图 3所示,可得该电阻的测量值 Rx=
U
I
=______Ω(保留两位有效数字)。
图 3
(4)若在(1)问中选用甲电路,产生误差的主要原因是______;若在(1)问中选用乙电路,
产生误差的主要原因是______。(选填选项前的字母)
A.电流表测量值小于流经 Rx的电流值
B.电流表测量值大于流经 Rx的电流值
C.电压表测量值小于 Rx两端的电压值
D.电压表测量值大于 Rx两端的电压值
(5)在不损坏电表的前提下,将滑动变阻器滑片 P从一端滑向另一端,随滑片 P移动距
离 x的增加,被测电阻 Rx两端的电压 U也随之增加,下列反映 U-x关系的示意图中正确
的是______。
图 4
答案:(1)B C 甲
(2)见解析图
(3)5.2
(4)B D
(5)C
解析:(1)电源电压为 4 V,为减小测量误差,电压表应选 C,通过电阻的最大电流 I=
3
5
A
=0.6 A,因此电流表选 B。因待测电阻远小于电压表内阻,故电流表采用外接法,实验电
路选甲。
(2)连线如图所示。
(3)由图 3读得电流表示数 I=0.50 A,电压表示数 U=2.60 V,则 Rx=
U
I
=
2.60
0.50
Ω=5.2
Ω。
(4)若选甲电路,由于电压表有分流作用,电流表测量值大于流经 Rx的电流值,因此选
B;若选乙电路,由于电流表的分压作用,使得电压表的测量值大于 Rx两端的电压值,因此
选 D。
(5)电阻 Rx两端的电压 x
x
ERU
R R
,当 x逐渐增大时,滑动变阻器阻值 R逐渐减小,电
压 U逐渐增大,当 R=0时,U=E,选项 C正确。
22. (18分)如图所示,两平行金属板间距为 d,电势差为 U,板间电场可视为匀强电
场;金属板下方有一磁感应强度为 B的匀强磁场。带电量为+q、质量为 m的粒子,由静止
开始从正极板出发,经电场加速后射出,并进入磁场做匀速圆周运动。忽略重力的影响,求:
(1)匀强电场场强 E的大小;
(2)粒子从电场射出时速度 v 的大小;
(3)粒子在磁场中做匀速圆周运动的半径 R。
答案:(1)
U
d
(2)
2qU
m
(3)
1 2mU
B q
解析:(1)电场强度
UE
d
。
(2)根据动能定理,有 qU=
1
2
mv2得
2qUv
m
。
(3)粒子在磁场中做匀速圆周运动时,洛伦兹力提供向心力,有 qvB=
2vm
R
得
1 2mUR
B q
。
23. (18分)蹦床比赛分成预备运动和比赛动作两个阶段。最初,运动员静止站在蹦床
上;在预备运动阶段,他经过若干次蹦跳,逐渐增加上升高度,最终达到完成比赛动作所需
的高度;此后,进入比赛动作阶段。
把蹦床简化为一个竖直放置的轻弹簧,弹力大小 F=kx(x为床面下沉的距离,k为常量)。
质量 m=50 kg 的运动员静止站在蹦床上,床面下沉 x0=0.10 m;在预备运动中,假定运动
员所做的总功 W全部用于增加其机械能;在比赛动作中,把该运动员视作质点,其每次离
开床面做竖直上抛运动的腾空时间均为 t=2.0 s,设运动员每次落下使床面压缩的最大深
度均为 x1。取重力加速度 g=10 m/s2,忽略空气阻力的影响。
(1)求常量 k,并在图中画出弹力 F随 x变化的示意图;
(2)求在比赛动作中,运动员离开床面后上升的最大高度 hm;
(3)借助 F—x图象可以确定弹力做功的规律,在此基础上,求 x1和 W的值。
答案:(1)5.0×103 N/m 见解析图
(2)5.0 m
(3)1.1 m 2.5×103 J
解析:(1)床面下沉 x0=0.10 m时,运动员受力平衡 mg=kx0
得 k=
0
mg
x
=5.0×103N/m
F-x图线示意图如图所示
(2)运动员从 x=0处离开床面,开始腾空,其上升、下落时间相等
hm= 21 ( )
2 2
tg
=5.0 m
(3)参考由速度—时间图象求位移的方法,Fx图线与坐标轴所围的面积等于弹力做的功,
从 x1处到 x=0,弹力做功 WT
WT=
1
2
·x1·kx1=
1
2
kx12
运动员从 x1处上升到最大高度 hm的过程,根据动能定理,有
1
2
kx12-mg(x1+hm)=0
解得 x1≈1.1 m
对整个预备运动,由题设条件以及功和能的关系,有
W+
1
2
kx02=mg(hm+x0)
得 W=2 525 J≈2.5×103 J
24. (20分)对于同一物理问题,常常可以从宏观与微观两个不同角度进行研究,找出
其内在联系,从而更加深刻地理解其物理本质。
(1)一段横截面积为 S、长为 l的直导线,单位体积内有 n个自由电子,电子电量为 e。
该导线通有电流时,假设自由电子定向移动的速率均为 v。
(a)求导线中的电流 I;
(b)将该导线放在匀强磁场中,电流方向垂直于磁感应强度 B,导线所受安培力大小为 F
安,导线内自由电子所受洛伦兹力大小的总和为 F,推导 F 安=F。
(2)正方体密闭容器中有大量运动粒子,每个粒子质量为 m,单位体积内粒子数量 n为
恒量。为简化问题,我们假定:粒子大小可以忽略;其速率均为 v,且与器壁各面碰撞的机
会均等;与器壁碰撞前后瞬间,粒子速度方向都与器壁垂直,且速率不变。利用所学力学知
识,导出器壁单位面积所受粒子压力 f与 m、n和 v 的关系。
(注意:解题过程中需要用到、但题目没有给出的物理量,要在解题时做必要的说明。)
答案:(1)(a)neSv (b)见解析 (2)f=
1
3
nmv2
解析:(1)(a)设 t时间内通过导体横截面的电量为 q,由电流定义,有
I=
q neSv t
t t
=neSv
(b)每个自由电子所受的洛伦兹力 F 洛=evB
设导体中共有 N个自由电子 N=n·Sl
导体内自由电子所受洛伦兹力大小的总和
F=NF 洛=nSl·evB
由安培力公式,有 F 安=IlB=neSv·lB
得 F 安=F
(2)一个粒子每与器壁碰撞一次给器壁的冲量大小为 I=2mv
如图所示,以器壁上的面积 S为底、以 v t为高构成柱体,由题设可知,其内的粒子
在 t时间内有 1/6与器壁 S发生碰撞,碰壁粒子总数为 N=
1
6
n·Sv t
t时间内粒子给器壁的冲量为 I=N· I=
1
3
nSmv2 t
面积为 S的器壁受到粒子压力为
IF
t
器壁单位面积所受粒子压力为 f=
F
S
=
1
3
nmv2
25. (17分)可降解聚合物 P的合成路线如下:
已知:
ⅰ.
ⅱ. +2HCl(R为烃基)
(1)A的含氧官能团名称是______________。
(2)羧酸 a的电离方程式是____________________________________________________。
(3)B→C 的 化 学 方 程 式 是
_____________________________________________________。
(4)化合物 D苯环上的一氯代物有 2种,D的结构简式是______________。
(5)E→F中反应①和②的反应类型分别是______________。
(6)F的结构简式是______________。
(7)聚合物 P的结构简式是______________。
答案:(1)羟基
(2)CH3COOH CH3COO-
+H+
(3) +HNO3
+H2O
(4)
(5)加成反应、取代反应
(6)
(7)
解析:由 结合反应条件,逆推可知 C为 、B
为 、A 为 、羧酸 a 为乙酸;结合 D 的分子式可知 D 为
,结合反应条件可知 D 到 E 发生的是醇的催化氧化,生成醛 E 为
;结合已知过程ⅰ可知 F为 ,由 G的分子式可知 G是
由两分子 F脱水缩合而成,除两个苯环外,另一个环为 F 中的羧基与氨基脱水形成的,其
结构简式为
,由已知过程ⅱ可知聚合物 P的结构简式。
26. (14分)NOx是汽车尾气中的主要污染物之一。
(1)NOx 能 形 成 酸 雨 , 写 出 NO2 转 化 为 HNO3 的 化 学 方 程 式 :
_________________________。
(2)汽车发动机工作时会引发 N2和 O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式:
________________________________________________。
②随温度升高,该反应化学平衡常数的变化趋势是
________________________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低 NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成 N2排出。写出 NO被 CO还原
的化学方程式:
___________________________________________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收 NOx生成盐。其吸收能力顺
序 如 下 : 12MgO < 20CaO < 38SrO < 56BaO 。 原 因 是
________________________________________
________________________________________________________________________,
元素的金属性逐渐增强,金属氧化物对 NOx的吸收能力逐渐增强。
(4)通过 NOx传感器可监测 NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是______反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:_______________________________________________。
答案:(1)3NO2+H2O===2HNO3+NO
(2)①N2(g)+O2(g)===2NO(g) H=+183 kJ·mol-1
②增大
(3)①2CO+2NO N2+2CO2
②根据Mg、Ca、Sr和 Ba 的质子数,得知它们均为ⅡA族元素。同一主族的元素,从
上到下,原子半径逐渐增大
(4)①还原
②NO+O2--2e-===NO2
解析:(2)首先写出所求方程式 N2(g)+O2(g) 2NO(g),断开化学键吸收的能量为
945 kJ·mol-1+498 kJ·mol-1=1 443 kJ·mol-1,形成化学键释放的能量为 1 260 kJ·mol-1,所
以H=+183 kJ·mol-1,反应为吸热反应,升高温度平衡右移,化学平衡常数增大;(3)性
质与结构有关,所以应该从原子结构的角度分析;(4)此装置为原电池,通入氧化剂(O2)的为
正极(或依据阴离子 O2-向负极移动判断),正极发生得电子的还原反应;负极 NO失电子生
成 NO2,电极反应为 NO+O2--2e-===NO2。
27. (12分)用含有 Al2O3、SiO2和少量 FeO·xFe2O3的铝灰制备 Al2(SO4)3·18H2O,工艺
流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀 H2SO4,过滤;
Ⅱ.向滤液中加入过量 KMnO4溶液,调节溶液的 pH约为 3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解 Al2O3的离子方程式是_________________________________________
________________________________________________________________________。
(2)将MnO -
4氧化 Fe2+的离子方程式补充完整:
(3)已知:
生成氢氧化物沉淀的 pH
Al(OH)3 Fe(OH)2 Fe(OH)3
开始沉淀时 3.4 6.3 1.5
完全沉淀时 4.7 8.3 2.8
注:金属离子的起始浓度为 0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的:____________________________________________
________________________________________________________________________。
(4)已知:一定条件下, 4MnO
可与 Mn2+反应生成MnO2。
① 向Ⅲ 的 沉淀 中 加 入浓 HCl 并 加热 , 能 说明 沉 淀 中存 在 MnO2 的 现象 是
________________________________________________________________________。
②Ⅳ 中 加 入 MnSO4 的 目 的 是
__________________________________________________。
答案:(1)Al2O3+6H+===2Al3++3H2O
(2)5 8H+ 5 4H2O
(3)pH约为 3时,Fe2+和 Al3+不能形成沉淀,将 Fe2+氧化为 Fe3+,可使铁完全沉淀
(4)①生成黄绿色气体 ②除去过量的 4MnO
解析:铝灰中 SiO2不与硫酸反应,操作Ⅰ过滤后滤液中主要含有 Al3+、Fe3+、Fe2+、 2
4SO
等,滤渣为 SiO2;由表格可知 Fe3+在 pH=2.8时沉淀完全,而 Fe2+完全沉淀时 pH=8.3,操
作Ⅱ的目的是除去滤液中的 Fe3+、Fe2+,沉淀前应把 Fe2+变成易沉淀的 Fe3+;(4)①MnO2
与浓盐酸反应生成黄绿色氯气;②由信息 4MnO
与Mn2+在一定条件下反应生成MnO2沉淀,
结合操作Ⅳ的现象可知操作Ⅳ目的是除去溶液中的 4MnO
。
28. (15分)某学生对 SO2与漂粉精的反应进行实验探究:
操作 现象
取 4 g漂粉精固体,加入 100 mL水 部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的 pH pH试纸先变蓝(约为 12),后褪色
A
ⅰ.液面上方出现白雾;
ⅱ.稍后,出现浑浊,溶液变为黄
绿色;
ⅲ.稍后,产生大量白色沉淀,黄
绿色褪去
(1)Cl2 和 Ca(OH)2 制 取 漂 粉 精 的 化 学 方 程 式 是
_____________________________________
___________________________________________________________________________
。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是_____________________________。
(3)向水中持续通入 SO2,未观察到白雾。推测现象ⅰ的白雾由 HCl 小液滴形成,进行
如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的 AgNO3溶液检验白雾,产生白色沉淀。
①实验 a的目的是____________________________________________________。
②由实验 a、b不能判断白雾中含有 HCl,理由是___________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和 Cl
-
发生反应。通过进一步实验确认了这种可能性,其实验方案是____________________。
(5)将 A瓶中混合物过滤、洗涤,得到沉淀 X。
①向沉淀 X中加入稀 HCl,无明显变化。取上层清液,加入 BaCl2溶液,产生白色沉淀。
则沉淀 X中含有的物质是______。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:___________________________。
答案:(1)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2)碱性、漂白性
(3)①检验白雾中是否含有 Cl2,排除 Cl2干扰
②白雾中混有 SO2,SO2可与酸化的 AgNO3反应产生白色沉淀
(4)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色
(5)①CaSO4
②SO2+Cl2+2H2O=== 2
4SO
+2Cl-+4H+
解析:(2)pH试纸先变蓝说明溶液显碱性,后褪色说明漂粉精具有漂白性;(3)湿润淀粉
碘化钾试纸是检验氧化性气体的,所以 a是检验白雾中是否含有氯气,排除氯气的干扰;白
雾中可能含有 SO2气体,SO2被硝酸氧化生成
2
4SO
,硫酸银微溶于水,所以不能判断白雾
中含有 HCl;(4)依据信息可知只要使溶液中只含有 H+
、Cl-、ClO-
,便可排除 SO2与 ClO-
生成氯气的可能性,即向漂粉精中滴加盐酸(或硫酸)看是否变为黄绿色;(5)由信息可知,SO2
与 H2O 反应生成 H2SO3,使溶液呈酸性,在酸性条件下,Cl-与 ClO-生成 Cl2,Cl2把 SO2
氧化为
2
4SO
,生成微溶于水的 CaSO4白色沉淀,溶液黄绿色褪去。
29. (16 分)为研究棉花去棉铃(果实)后对叶片光合作用的影响,研究者选取至少具有
10个棉铃的植株,去除不同比例棉铃,3天后测定叶片的 CO2固定速率以及蔗糖和淀粉含
量。结果如图。
图 1
图 2
(1)光合作用碳(暗)反应利用光反应产生的 ATP 和______,在______中将 CO2转化为三
碳糖,进而形成淀粉和蔗糖。
(2)由图 1可知,随着去除棉铃百分率的提高,叶片光合速率______。本实验中对照组(空
白对照组)植株的 CO2固定速率相对值是______。
(3)由图 2可知,去除棉铃后,植株叶片中______增加。已知叶片光合产物会被运到棉
铃等器官并被利用,因此去除棉铃后,叶片光合产物利用量减少,______降低,进而在叶片
中积累。
(4)综合上述结果可推测,叶片中光合产物的积累会______光合作用。
(5)一种验证上述推测的方法为:去除植株上的棉铃并对部分叶片遮光处理,使遮光叶
片成为需要光合产物输入的器官,检测______叶片的光合产物含量和光合速率。与只去除棉
铃植株的叶片相比,若检测结果是______,则支持上述推测。
答案:(1)[H] 叶绿体基质
(2)逐渐下降 28
(3)淀粉和蔗糖含量 输出量
(4)抑制
(5)未遮光的 光合产物含量下降,光合速率上升
解析:(1)光合作用暗反应利用光反应产生的 ATP和[H]在叶绿体基质中将 CO2还原,最
终合成有机物。
(2)题图中显示随着去除棉铃百分率的提高,叶片光合速率逐渐下降,实验中的对照组
为不摘除棉铃的棉花,所以 CO2固定速率的相对值为 28。
(3)由题图 2 知,去除棉铃后,植株叶片中的淀粉和蔗糖含量增加,因此去除棉铃后,
叶片光合产物利用量减少,输出量降低,进而在叶片中积累。
(4)叶片中光合作用产物的积累使 CO2固定速率下降,所以会抑制光合作用。
(5)照光处理后的叶片光合产物淀粉、蔗糖的量降低或 CO2固定速率相对上升,则支持
上述推测。
30. (18分)斑马鱼的酶 D由 17号染色体上的 D基因编码。具有纯合突变基因(dd)的斑
马鱼胚胎会发出红色荧光。利用转基因技术将绿色荧光蛋白(G)基因整合到斑马鱼 17号染色
体上。带有 G基因的胚胎能够发出绿色荧光。未整合 G基因的染色体的对应位点表示为 g。
用个体M和 N进行如下杂交实验。
个体 N的 17号染色体上相关基因组成
(1)在上述转基因实验中,将 G基因与质粒重组,需要的两类酶是______和______。将
重组质粒显微注射到斑马鱼______中,整合到染色体上的 G基因______后,使胚胎发出绿
色荧光。
(2)根据上述杂交实验推测:
①亲代M的基因型是______(选填选项前的符号)。
a.DDgg b.Ddgg
②子代中只发出绿色荧光的胚胎基因型包括______(选填选项前的符号)。
a.DDGG b.DDGg
c.DdGG d.DdGg
(3)杂交后,出现红·绿荧光(既有红色又有绿色荧光)胚胎的原因是亲代______(填“M”或
“N”)的初级精(卵)母细胞在减数分裂过程中,同源染色体的______发生了交换,导致染色体
上的基因重组。通过记录子代中红·绿荧光胚胎数量与胚胎总数,可计算得到该亲本产生的
重组配子占其全部配子的比例,算式为______________。
答案:(1)限制性核酸内切酶 DNA连接酶 受精卵 表达
(2)①b ②b、d
(3)N 非姐妹染色单体 4
红 绿荧光胚胎数
胚胎总数
解析:(1)在转基因工程中用到的工具酶是限制性核酸内切酶和 DNA连接酶,将目的基
因导入动物细胞,受体细胞是受精卵。目的基因表达后才能表现出相应的性状。
(2)亲代 N 的基因型是 DdGg,在减数分裂的四分体时期同源染色体的非姐妹染色单体
交叉互换,减数分裂完成后产生了一种 dG的生殖细胞,该生殖细胞与亲代 M 经减数分裂
产生的生殖细胞 dg结合,产生基因型为 ddGg的受精卵。该受精卵发育成红·绿荧光个体,
交叉互换后的配子类型有 DG、dg、Dg、dg四种,所以子代只发出绿色荧光胚胎基因型有
DDGg和 DdGg两种。
(3)亲代 N 的初级精(卵)母细胞在减数分裂中同源染色体的非姐妹染色单体发生了交换
导致染色体上的基因重组。当初级精(卵)母细胞发生交叉互换时,产生的后代中红·绿荧光胚
胎数量占胚胎总数的
1
4
,所以红·绿荧光胚胎数乘以 4再除以胚胎总数即为该算式。
31. (16分)研究者发现,小鼠舌头上的某些味觉细胞和小肠上皮细胞表面均存在蛋白
C,该蛋白能和脂肪结合。为研究蛋白 C的功能,进行了系列实验。
(1)蛋白 C是一种膜蛋白,它在细胞内的______上合成,然后在______和______中加工。
(2)实验一:让小鼠舌头接触脂肪,结果发现正常小鼠小肠出现脂肪消化液,而去除蛋
白 C基因的小鼠分泌的脂肪消化液明显减少。由此推测,脂肪通过与味觉细胞表面的蛋白 C
结合,刺激了脂肪味觉______,产生兴奋,传到相关中枢,再通过______刺激消化腺分泌。
(3)实验二:分别培养实验一中两种小鼠的小肠上皮细胞,向培养液中加入脂肪分解物。
与正常小鼠细胞相比,进入去除蛋白 C基因的小鼠细胞的脂肪分解物减少,表明小肠上皮
细胞表面蛋白 C的功能是______。
(4)为了证实其他哺乳动物的蛋白 C也有相似作用,可行的做法是从该种动物的基因文
库中______蛋白 C基因序列,然后以______的小鼠为受体,导入该基因序列,检测发育出
的小鼠相关指标的恢复程度。
答案:(1)核糖体 内质网 高尔基体
(2)感受器 传出神经
(3)促进脂肪分解物的吸收
(4)获取(或获得) 去除蛋白 C基因
解析:(1)蛋白质的合成部位是核糖体;膜蛋白在核糖体合成后经内质网和高尔基体加
工经胞吐分泌到细胞外。
(2)完成反射的结构是反射弧,由感受器、传入神经、神经中枢、传出神经和效应器组
成。
(3)由题干信息表明蛋白 C基因的功能是促进脂肪分解物的吸收。
(4)从基因文库中获取目的基因,构建基因表达载体后导入没有蛋白 C基因的受体细胞,
通过观察其发育可得出相应的结论。