- 329.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考复习 无机推断题
一、以物质的特殊物理性质及组成结构为突破口(1)
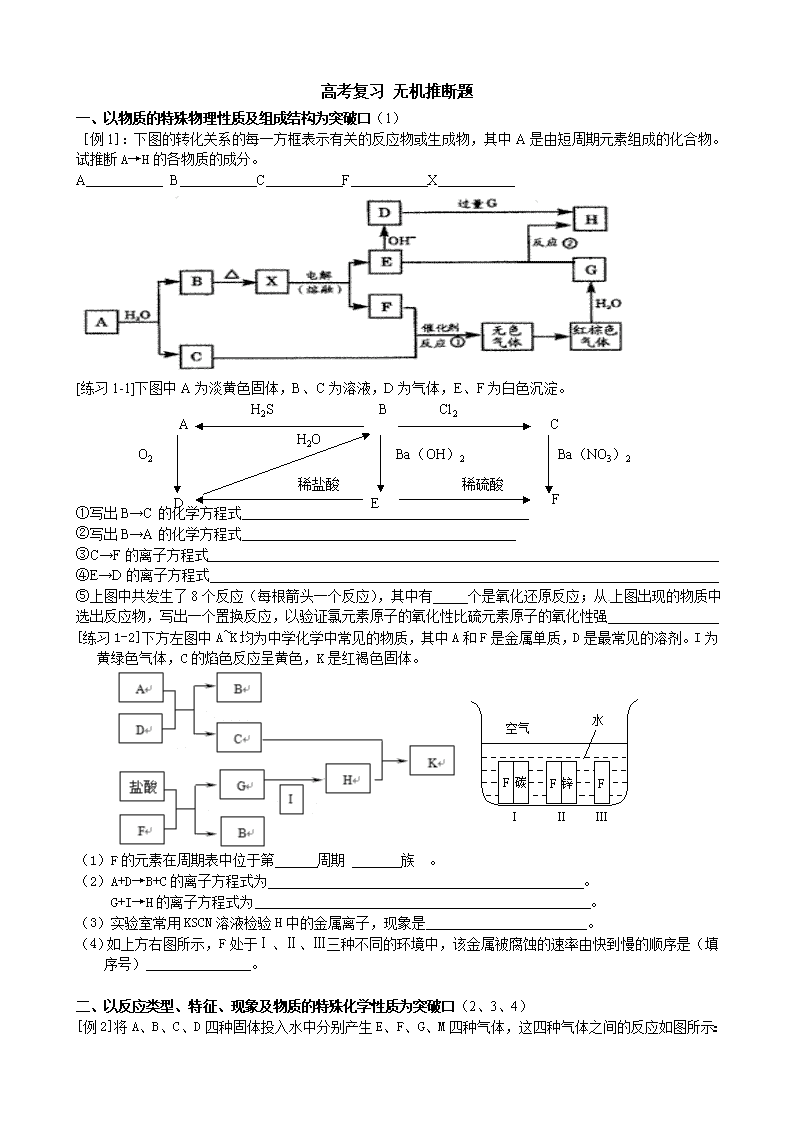
[例1]:下图的转化关系的每一方框表示有关的反应物或生成物,其中A是由短周期元素组成的化合物。试推断A→H的各物质的成分。
A B C F X
[练习1-1]下图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀。
Ba(NO3)2
O2
H2S
D
Cl2
C
B
F
E
稀硫酸
稀盐酸
Ba(OH)2
H2O
A
①写出B→C的化学方程式
②写出B→A的化学方程式
③C→F的离子方程式
④E→D的离子方程式
⑤上图中共发生了8个反应(每根箭头一个反应),其中有 个是氧化还原反应;从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强
[练习1-2]下方左图中A~K均为中学化学中常见的物质,其中A和F是金属单质,D是最常见的溶剂。I为黄绿色气体,C的焰色反应呈黄色,K是红褐色固体。
空气
水
F
碳
F
锌
F
Ⅰ
Ⅱ
Ⅲ
(1)F的元素在周期表中位于第 周期 族 。
(2)A+D→B+C的离子方程式为 。
G+I→H的离子方程式为 。
(3)实验室常用KSCN溶液检验H中的金属离子,现象是 。
(4)如上方右图所示,F处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,该金属被腐蚀的速率由快到慢的顺序是(填序号)_______________。
二、以反应类型、特征、现象及物质的特殊化学性质为突破口(2、3、4)
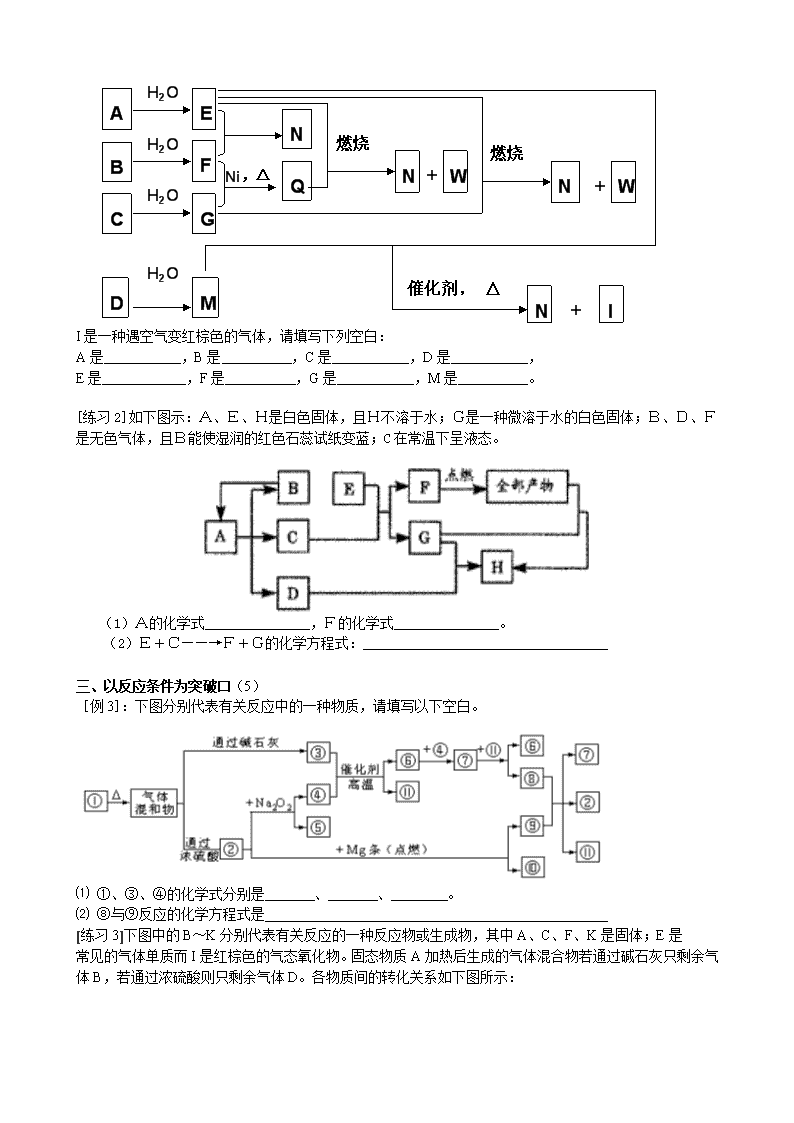
[例2]将A、B、C、D四种固体投入水中分别产生E、F、G、M四种气体,这四种气体之间的反应如图所示:
A
C
B
E
F
N
N
G
Q
W
N
W
N
I
H2O
H2O
H2O
D
M
H2O
Ni,△
燃烧
燃烧
催化剂, △
+
+
+
I是一种遇空气变红棕色的气体,请填写下列空白:
A是 ,B是 ,C是 ,D是 ,
E是 ,F是 ,G是 ,M是 。
[练习2]如下图示:A、E、H是白色固体,且H不溶于水;G是一种微溶于水的白色固体;B、D、F是无色气体,且B能使湿润的红色石蕊试纸变蓝;C在常温下呈液态。
(1)A的化学式_______________,F的化学式_______________。
(2)E+C——→F+G的化学方程式:___________________________________
三、以反应条件为突破口(5)
[例3]:下图分别代表有关反应中的一种物质,请填写以下空白。
⑴ ①、③、④的化学式分别是 、 、 。
⑵ ⑧与⑨反应的化学方程式是
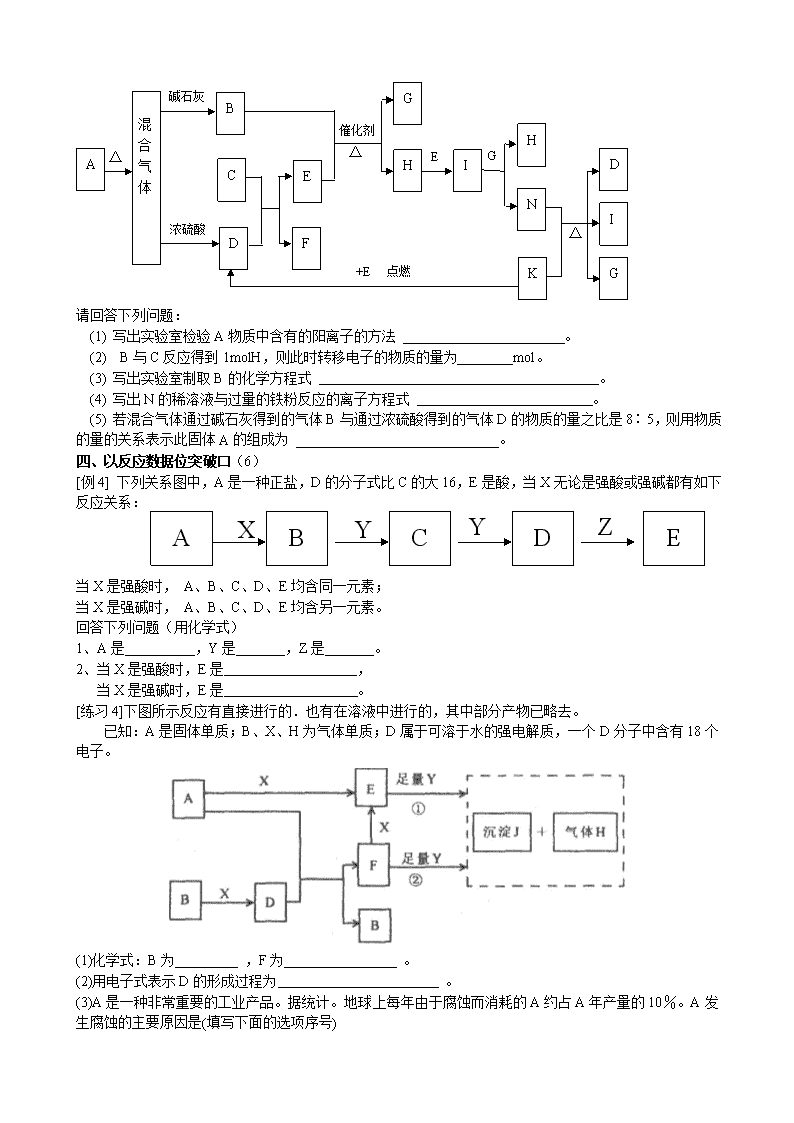
[练习3]下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是
常见的气体单质而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气
体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
A
混 合 气 体
△
B
C
D
浓硫酸
碱石灰
E
F
H
点燃
催化剂
G
△
I
E
G
H
N
△
K
G
I
D
+E
请回答下列问题:
(1) 写出实验室检验A物质中含有的阳离子的方法 。
(2) B与C反应得到1molH,则此时转移电子的物质的量为________mol。
(3) 写出实验室制取B的化学方程式 。
(4) 写出N的稀溶液与过量的铁粉反应的离子方程式 。
(5) 若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为 。
四、以反应数据位突破口(6)
[例4] 下列关系图中,A是一种正盐,D的分子式比C的大16,E是酸,当X无论是强酸或强碱都有如下反应关系:A
B
C
D
E
X
Y
Y
Z
当X是强酸时, A、B、C、D、E均含同一元素;
当X是强碱时, A、B、C、D、E均含另一元素。
回答下列问题(用化学式)
1、A是 ,Y是 ,Z是 。
2、当X是强酸时,E是 ,
当X是强碱时,E是 。
[练习4]下图所示反应有直接进行的.也有在溶液中进行的,其中部分产物已略去。
已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
(1)化学式:B为 ,F为 。w.w.w.k.s.5.u.c.o.m
(2)用电子式表示D的形成过程为 。
(3)A是一种非常重要的工业产品。据统计。地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号)
a.直接与氧气发生化学腐蚀;b.通过原电池反应发生腐蚀;c.因溶于水而消耗掉;
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式: 。
(4)已知H的密度比空气的密度大,则①中所涉及的反应的化学方程式为
。
(5)写出F与足量Y反应生成J的理由:
。
五、以转化关系为突破口(7)
[例5]金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:
Al+NO3-
H+
OH-
A溶液
B溶液
气体C
气体D
E
F
O2
O2
H2O
其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)写出Al3+的结构示意图
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al+NO3-+OH-+H2O—→ +
(3)将A转化为B,可加入的试剂是
(4)写出D—→C反应的化学方程式:
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)写出气体D的一种用途
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是
6.(10分)A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态.其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合.有关的转化关系如下图所示(反应条件均已略去).w.w.w.k.s.5.u.c.o.m
回答下列问题:
(1)A的化学式为_______________;
(2)写出反应③的化学反应方程式___________________________________________;
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为_______________________________________;
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×,则参加反应的E的质量为________g;
(5)将Z与N反应后的产物溶于水中,则溶液的pH(填“<”或“>”________7,其原因是________________________________________________________________.
六、根据特殊工业生产推断
[例6]以海水中常见物质A为原料可以发展很多工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题。
(1) C和D、C和G反应都可以制取消毒剂。C和D反应制取的消毒剂中有效成分的化学式为______ ____。
(2) 电解A溶液反应的离子方程式为_________________________________。
(3) 将F和J通入A的饱和溶液中,反应的化学方程式为: ___ ______________________。
(4) J的空间构型为___________形。K的电子式___________。
(5)实验室可利用K与G制取J,请写出该反应化学方程式:______________________________________________________ 。
[练习6]把某黑色固体单质A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X ,将X做如下图所示的实验:
X
无色气体C
蓝色溶液G
无色气体E
无色气体E
通入澄清石灰水
白色沉淀
加入单质F
无色溶液D
通入水中
①由此可以推断:A为 ;C为 和
②写出D加入F生成E和G的离子方程式
③C通入澄清石灰水时,若气体通过量则白色沉淀又会溶解,写出白色沉淀溶解的化学方程式
练习题:
1.下图为某些物质之间的变化关系(未注明用量的物质间均按恰好充分反应处理)
已知A的焰色反应呈黄色,常温下,甲为能使湿润的红色石蕊试纸变蓝的气体,乙为可燃性气体,甲、乙分子中质子数相等。
(1) A的化学式是 ;乙的化学式是 。
(2) X是一种纯净物,X的化学式是 ;C中含有 、 。(填化学式)
(3) 能否确定B为何种物质?如果能,写出B的化学式;如果不能,请说明理由
。
2.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示:
(1) X的电子式是 ,G的化学式是 。
(2) 上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是 。
(3) 反应“D+丙”的化学方程式是 。
(4) 写出X与D在稀硫酸中反应的离子方程式 。
3.甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件
下的相互转化关系如下:
请填写以下空白:
(1) 在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物是 。
(2) 在X、Z两种化合物的正价元素的化合价中,是 。
A. 前者高 B. 后者高 C. 不一定
原因是 。
(3) 当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式
。写出丙跟乙反应的化学方程式 。
(4) 当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式 。写出丙跟乙反应的化学方程式 。
4.有X、Y、Z三种单质,常温下X是固体,Y是液体,Z是气体。它们之间的反应关系如下图所示:
请填写下列空白:
(1) 据此推断X、Y、Z的化学式:X 、Y 、Z 。
(2) X是常见的单质,它是主族元素,还是副族元素 ,其理由是: 。
(3) 写出C+Y ® A的离子方程式: 。
5.根据以下反应关系图,回答下列问题:
(1) A溶液所含溶质是:_______________________;
(2) A溶液跟B溶液反应的化学方程式是:______________________________;
(3) G转变为E的离子方程式是:_________________________________________。
6.甲、乙两种物质是常见的短周期元素的单质,其有关物质性质如图,其中C为白色沉淀,D为气体。
(1) 若D为酸性气体,则A的化学式为 。
(2) 若D为碱性气体,则A的化学式为 。
(3) 若由两种元素组成的化合物M发生水解反应只生成两种酸N和P,则下列有关说法中,正确的是 。
A. M可能由两种非金属元素组成
B. N、P均一定为一元酸 C. M一定含有金属元素
D. 此反应可能为氧化还原反应 E. 生成物中的无氧酸和含氧酸并存
7、X、Y、Z、W为常见的4种单质。常温下,X是固体,Y是液体,Z是无色气体,W为黄绿色气体。其反应关系如下,其中B的溶液显强酸性。
(1)根据反应推断X、Y、Z的化学式:__________、__________、__________。
(2)指出X元素在元素周期表中的位置:__________。
(3)写出A溶于水后加入X的离子方程式:__________。
(4)写出C与过量W反应的离子方程式:__________。
8.A、B、C是所学过的三种单质,A、B、C及其它物质之间的反应关系如下图所示。其中,B、D、E、F的水溶液呈酸性。
若D+C ® E+F,且常温下B为气态,则
(1) A、B、C三种单质分别是: 、 、 。
(2) F+B ® D的离子方程式: 。
(3) E的水溶液呈酸性的离子方程式: 。
9.A是中学化学的一种常见固体。在加热条件下,A可与一种无色溶液B反应, 生成两种气体混合物X,将X作如下图所示的实验:
据此判断:A是 ___________,B是 ____________,C是 ____________,
D是 ___________,E是 ____________,X是 ____________。
A
B
C
D
E
F
G
H
I
B
D
+
+
盐酸
水
10、A、B、C是按原子序数由小到大排列的第二、三周期
元素的单质。B、E均为组成空气的成分。F的焰色反应呈
黄色。在G中,非金属元素与金属元素的原子个数比为
1:2。在一定条件下,各物质之间的相互转化关系如右
(图中部分产物未列出):
请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
11、置换反应的通式可以表示为:单质(l)+化合物(1)=化合物(2)+单质(2)
请写出满足以下要求的3个置换反应的化学方程式:①所涉及的元素的原子序数都小于20②6种单质分属6个不同的主族 ; ;
12、有A、B两种钠盐,各取适量混合,加少量水后再强热,生成气体C,残留固体D,C易溶于水生成无色溶液E;将D溶于水后加入硝酸钡溶液生成不溶于稀HNO3的白色沉淀;E的浓溶液加入MnO2共热产生气体F,此气体能使湿的有色布条褪色;A溶于水显酸性。
(1) 推断A、B、C、D、E、F各是什么物质?
A_______,B________,C________,D_________,E_________,F________。
(2) 写出指定反应的化学方程式:
① A+B:________________________________________________________;
② E+MnO2:_____________________________________________________。
13.有A、B、C、D、E、F六瓶无色溶液,它们分别是NaCl、Ca(NO3)2、MgCl2、K3PO4、BaCl2和NH4NO3。现进行如下实验:
⑴ 分别滴入AgNO3溶液,A、B、D、E溶液产生沉淀;⑵ 分别滴入Na2CO3溶液,C、D、E溶液产生沉淀;⑶将C溶液滴入其它五种溶液中,A溶液产生沉淀;⑷ 将NaOH稀溶液滴入D、E溶液中,E溶液产生沉淀。
从以上实验现象可推断:(写化学式)
A
B
C
D
E
F
14.下图每一方格表示一种物质。通常状况下,A、C均为无色气体,B为无色液体。
请填写下列空白:
(1) 物质X可以是___________,C是____________,F是___________;
(2) 反应①的化学方程式是________________________________________________;
(3) 反应②的离子方程式是________________________________________________。
15.镁在空气里点燃可以燃烧,放出大量的热并发出跃眼的白光, 生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,已知A有下列一系列变化:
(1) 写出A、C、D的化学式:A_________、C_________、D_________。
(2) 写出下列变化的化学方程式:
① A+盐酸:_______________________________________________________,
② 溶液B+NaOH溶液:___________________________________________________。
16.A、B、C、D、E、F是中学化学常见的6种物质,它们之间有如下转化关系。其中,B、D在通常情况下是气体物质,F溶液呈碱性,C是白色沉淀。试回答:
(1) C的化学式为 ,D的电子式为 。
(2) 写出D+E ® F的离子方程式: 。
17.下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物( 反应时加入或生成的水,以及生成沉淀J时的其它产物均已略去)。
请填写下列空白:
⑴ 物质B是_________,F是__________,J是___________;
⑵ 反应①的离子方程式是________________________________________________。
18.已知硫粉跟亚硫酸钠溶液共热可制得硫代硫酸钠。现以硫化亚铁为主要原料,按下图制取硫代硫酸钠。图中的A、B、C 和D是硫单质或硫的化合物,其它不含硫的反应产物已被略去,各步反应可以添加必要的试剂。
请填写下列空白:
(1) 反应(Ⅰ)的化学方程式是:____________________________________________。
(2) 物质B的分子式是:________________。
(3) 物质D的化学式是:_________________。
19.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。B、X的式量(相对分子质量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示:
(1) X的化学式是 ,G的化学式是 。
(2) 上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是 。
(3) 反应“D+丙”的化学方程式是 。
(4) 写出X与D在稀硫酸中反应的离子方程式 。
20.在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
⑴ 孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。上图中的F是
__________________。
⑵ 写出明矾溶液与过量NaOH溶液反应的离子方程式:
_____________________________。
⑶ 图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
________________________________________________________。
⑷ 每生成1 mol D,同时生成_________ mol E。
21.U、V、W、X、Y、Z六种物质之间存在如下反应:
(1)U+KOH→V+W+H2O(2)(3)X+W+H2SO4→U+Z+H2O
其中U和Y是单质,在常温下都是气体,Z是硫酸盐,由此可以推断它们是:
U_______________,V_______________,W_______________, X_______________,Y______________,Z_______________。
22.A、B、C、D、E五种物质的焰色都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出各物质的化学式:A____,B___,C____,D____,E___。
(2)写出A→C的化学方程式,并标出电子转移的方向和数目_________。
(3)写出C→D的离子方程式:______(4)写出化学方程式:E+BD+C+O2↑:_________。
23.中学化学常见物质间的转化关系,推断并完成下列空白:
⑴当A为两种非金属元素所组成的化合物时,化合物A的电子式:_________化合物B的电子式:___________单质乙的同素异形体的化学式:__________________________________反应①的化学方程式:__________________________________________________________。
⑵当A为金属元素与非金属元素所组成的化合物时,化合物B的化学式为______________单质甲少量时反应①的离子方程式为_______________。
单质甲过量时反应①的离子方程式为______________________________________________。
24.有一透明溶液,欲确定其是否含有下列离子:Mg2+、Fe2+、Ba2+、NO3-、SO42-、I-,各取少量该溶液进行实验,将实验过程及现象如下图所示:
根据以上实验,溶液中肯定存在的离子:__________;肯定不存在的离子:__________。
25.A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。C、H、I、J、K、L是常见化合物,其中C在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:
请回答下列问题:
(1)元素A在元素周期表中的位置为第__________周期__________族。(2)写出K的电子式__________。
(3)写出H和D反应的化学方程式__________。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式__________。
(5)写出A与G反应的化学方程式__________。
(6)K与E反应时产生的现象有__________;该反应的化学方程式为__________。