- 441.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高三化学实验简答题专项训练
1.有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸.现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其它试剂.简述如何用最简便的实验方法来判别哪瓶是强酸: .
2.能选用CCl4从碘水中萃取碘的原因是
3.Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂.简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O.
4.实验需用约10% H2O2溶液100mL,现用市售30%(密度近似为1g/cm3) H2O2来配制,其具体配制方法是
5. 在进行沉淀反应的实验时,如何认定沉淀已经完全?
________________________________________________
6. 中学化学实验中,在过滤器上洗涤沉淀的操作是
________________________________________________
7.用pH试纸测定溶液的pH,正确操作是:_________________________________
___________________________________________________________________________。
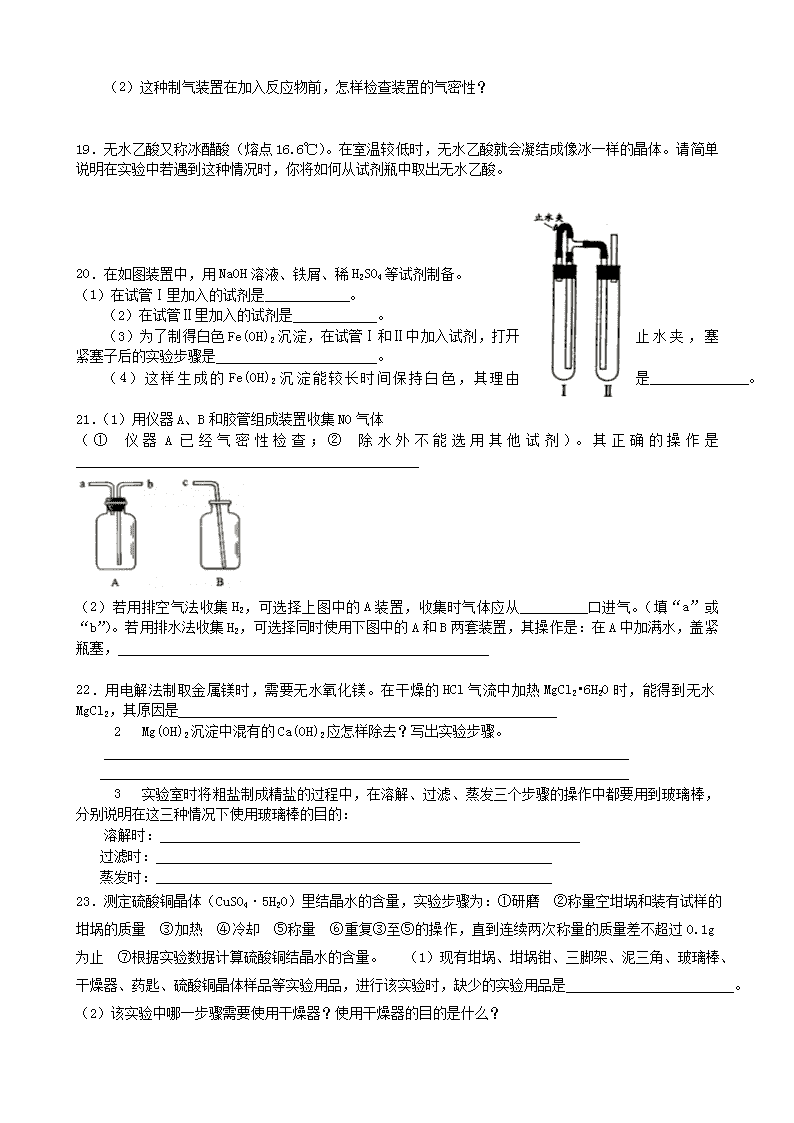
8.分离沸点不同但又互溶的液体混合物,常用什么方法?_______________
9.在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。________________________________________________________
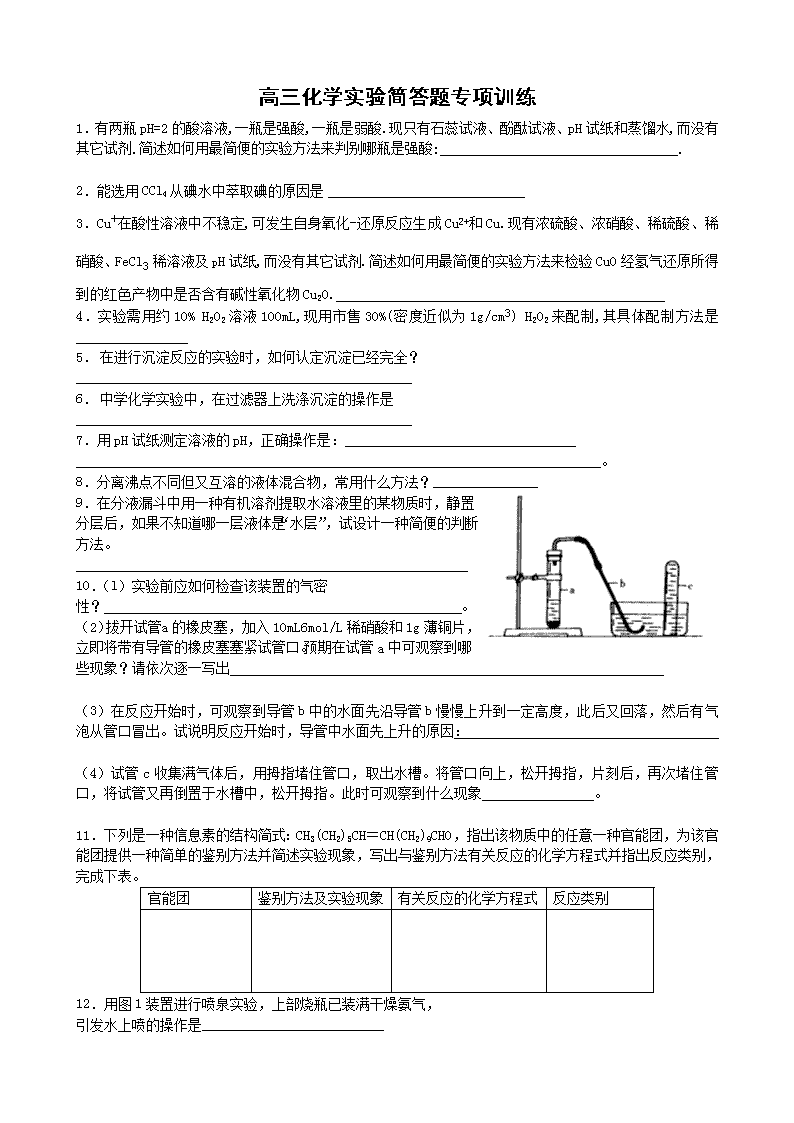
10.(l)实验前应如何检查该装置的气密性? 。
(2)拔开试管 a的橡皮塞,加入10mL 6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。预期在试管a中可观察到哪些现象?请依次逐一写出
(3)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。试说明反应开始时,导管中水面先上升的原因:
(4)试管c收集满气体后,用拇指堵住管口,取出水槽。将管口向上,松开拇指,片刻后,再次堵住管口,将试管又再倒置于水槽中,松开拇指。此时可观察到什么现象 。
11.下列是一种信息素的结构简式:CH3(CH2)5CH=CH(CH2)9CHO,指出该物质中的任意一种官能团,为该官能团提供一种简单的鉴别方法并简述实验现象,写出与鉴别方法有关反应的化学方程式并指出反应类别,完成下表。
官能团
鉴别方法及实验现象
有关反应的化学方程式
反应类别
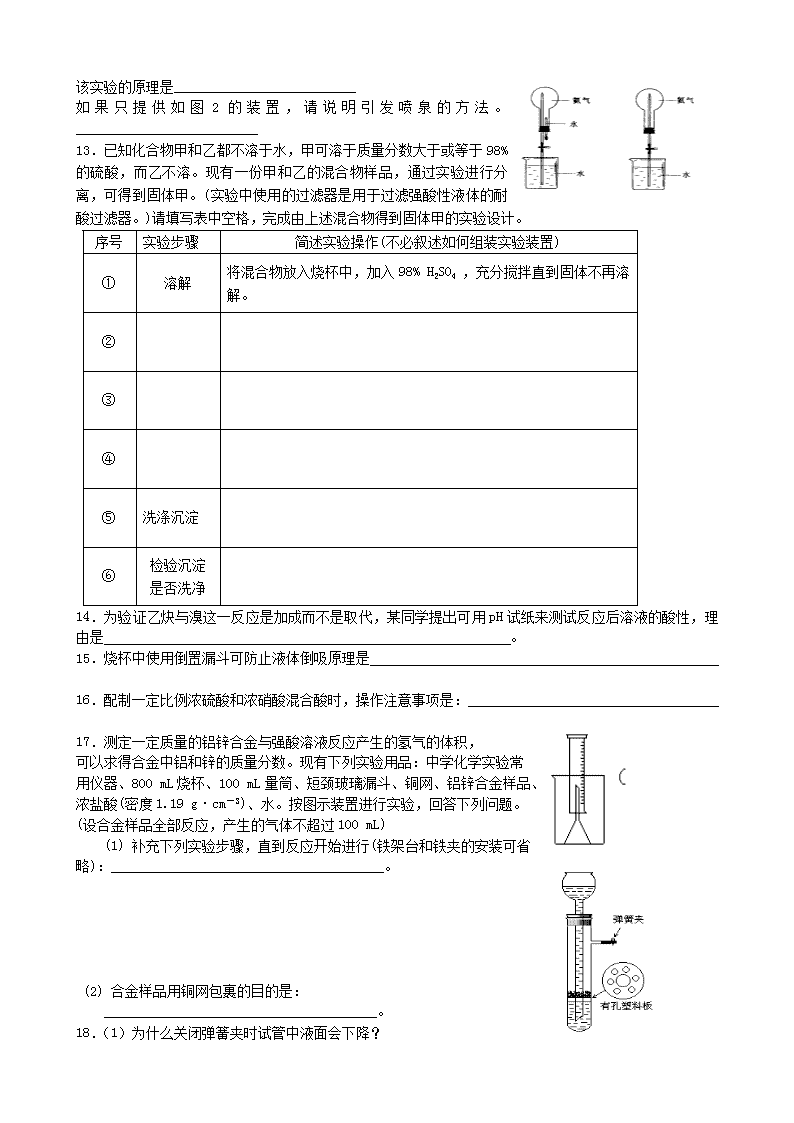
12.用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,
引发水上喷的操作是__________________________
该实验的原理是__________________________
如果只提供如图2的装置,请说明引发喷泉的方法。__________________________
13.已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)请填写表中空格,完成由上述混合物得到固体甲的实验设计。
序号
实验步骤
简述实验操作(不必叙述如何组装实验装置)
①
溶解
将混合物放入烧杯中,加入98% H2S04 ,充分搅拌直到固体不再溶解。
②
③
④
⑤
洗涤沉淀
⑥
检验沉淀是否洗净
14.为验证乙炔与溴这一反应是加成而不是取代,某同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
15.烧杯中使用倒置漏斗可防止液体倒吸原理是
16.配制一定比例浓硫酸和浓硝酸混合酸时,操作注意事项是:
17.测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,
可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常
用仪器、800 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、
浓盐酸(密度1.19 g·cm-3)、水。按图示装置进行实验,回答下列问题。
(设合金样品全部反应,产生的气体不超过100 mL)
(1) 补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省
略):_______________________________________。
(2) 合金样品用铜网包裹的目的是:_______________________________________。
18.(1)为什么关闭弹簧夹时试管中液面会下降?
(2)这种制气装置在加入反应物前,怎样检查装置的气密性?
19.无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。
20.在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
21.(1)用仪器A、B和胶管组成装置收集NO气体
(① 仪器A已经气密性检查;② 除水外不能选用其他试剂)。其正确的操作是_________________________________________________
(2)若用排空气法收集H2,可选择上图中的A装置,收集时气体应从 口进气。(填“a”或“b”)。若用排水法收集H2,可选择同时使用下图中的A和B两套装置,其操作是:在A中加满水,盖紧瓶塞,
22.用电解法制取金属镁时,需要无水氧化镁。在干燥的HCl气流中加热MgCl2•6H2O时,能得到无水MgCl2,其原因是
(2) Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
(3) 实验室时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:
过滤时:
蒸发时:
23.测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算硫酸铜结晶水的含量。 (1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是 。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答: 。
(3)实验步骤⑥的目的是 。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号): 。
A.被测样品中含有加热不挥发的杂质B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水 D.加热前所用的坩埚未完全干燥
24.根据下图及描述,回答下列问题:
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管口注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) 。
判断理由: 。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) ,
判断理由: 。
25.引发铝热反应的实验操作是
26.将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
① 两气体通入的先后顺序是 。
其理由是
② 氨气燃烧的化学方程式是 。
27.实验过程中,使用分液漏斗滴加浓硫酸的操作是
28.简述检验滤液中Fe3+的操作方法_________________________________________
29.下述装置中,在反应前用掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
30.请设计一个方案,说明苯酚、碳酸酸性依次增强(用化学方程式表示)。
31.
试管F中收集满气体(氧气)后,下一步实验操作是: 。
32.试管中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
33.如何判断在本实验中有CO生成?(简述实验方法和观察到的现象。)
34.除去不溶性杂质。操作是 ,需要玻璃棒、______________、______________等玻璃仪器。
35.某学生课外小组做淀粉水解的实验并制取银镜,首先在试管中加入0.5g淀粉,再加入4mL20%的硫酸溶液,加热使淀粉水解,待淀粉水解完全后,用碱液中和并加入银氨溶液,再把试管放在热水中,静置后形成银镜。怎样证明淀粉已经水解完全?
36.指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):____________。 ②容量瓶:__________________。
③滴定管:_________________________。④集气瓶(收集氯化氢):____________________。
⑤托盘天平_________________。
37.(1)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
。
(2)在纯碱溶液中滴入酚酞,溶液变红.若在该溶液中滴入过量的氯化钡溶液,所观察到的现象是_________________________.其原因是(以离子方程式和简要文字说明):_________________________________
(3)为探究纯碱溶液中CO32-的水解是吸热的,请你设计一个简单的实验方案。
。
答案:
1.各取等体积酸液用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH值,pH值变化大的那瓶是强酸.
2.CCl4与水不互溶;而且碘在CCl4中的溶解度比在水中的大很多
3.取少量该红色产物放入稀硫酸,(振荡)若溶液变为蓝色,说明产物中有Cu2O;若溶液不变色,说明产物中无Cu2O.
4.用量筒量取33(或34)毫升30%H2O2溶液加入烧杯中,再加入67(或66)毫升水(或加水稀释至100毫升),搅拌均匀
5.在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,如果不再产生沉淀,说明沉淀完全。
6.向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次。
7.把小块pH试纸放在表面皿(或玻璃片)上,用醮有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH。
8.蒸馏方法
9.取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,反之,则上层是水层。
10.(1)把导管b的下端浸入水中,用手紧握捂热试管a,导管口会有气泡冒出,松开手后,水又会回升到导管b中。
(2)①铜片和稀硝酸反应,有无色气泡产生,反应速率开始缓慢,逐渐加快。②试管a上部空间由无色变为浅棕色,又变为无色。③试管a中的溶液由无色变成浅蓝色。④反应结束时,铜片全部反应完。
(3)由于反应开始时产生的NO和试管a上部空气中的O2作用生成NO2;NO2易溶于水并与水起反应;使装置内的气体压强暂时减小,所以导管中的水面会上升至一定高度。
(4)水进入试管,上升到一定高度。试管中气体颜色由红棕色变为无色。
11.
官能团
鉴别方法及
实验现象
有关反应的化学方程式
反应类别
(碳碳双键)
加溴水
溴水褪色
CH3(CH2)5CH=CH(CH2)9CHO+Br2
→CH3(CH2)5CHBr-CHBr(CH2)9CHO+Br2
加成反应
(醛基)
加银氨溶液
生成银镜
CH3(CH2)5CH=CH(CH2)9CHO+2[Ag(NH2)2]+
+2OH-→CH3(CH2)5CH=CH(CH2)9COO-
+NH4++2Ag++3NH3+H2O
氧化反应
12.打开止水夹,挤出胶头滴管中的水。 氢气极易溶解于水,致使烧瓶内气体压强迅速减小。 打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
13. ②过滤 将烧杯中物质倒入耐酸过滤器中过滤,得滤液。
③析出沉淀 将滤液沿烧杯壁慢慢倒入足量水中,并不段搅拌,直至析出全部固体。
④过滤 将此烧杯中的物质倒入过滤器中过滤,得固体。
⑤ 用蒸馏水冲洗滤纸上的固体若干次,直至洗净。
⑥取新得到的洗出液少许,滴入用盐酸酸化的BaCl2 溶液 ,若没有白色浑浊出现,则说明沉淀已洗净,若有白色浑浊出现,则说明沉淀没有洗净。
14.如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。
15. 当气体被吸收时,液体上升到漏斗中,由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯内,从而防止了倒吸。
16.先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却。
17.(1) ① 将称量后的合金样品用铜网小心包裹好,放在800 mL烧杯底部,把短颈漏斗倒扣在样品上面。
② 往烧杯中注入水,直至水面没过漏斗颈。(没答水面没过漏斗颈不给分)
③ 在100 mL量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈伸入量筒中。烧杯中水面到杯口至少保留约100 mL空间。
④ 将长颈漏斗(或答玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生。
注:实验步骤顺序写错,或在步骤②中加入盐酸,则不论其它步骤回答是否正确,小题(1)均为0分。
(2) 使样品在反应时能保持在烧杯底适当的位置(或答避免反应时样品漂浮)
18.(1)关闭弹簧夹时,反应产生的气体使试管内液面上的压力增加,所以液面下降。
(2)塞紧橡皮塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气。
19.用热毛巾捂住试剂瓶,待冰醋酸融化后,即可取出试剂(其他合理的加热方法也可以)
20.(1)稀 H2SO4 铁屑(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。
21.(1) 在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中。(2)a,用胶管连接b和c接口,由a导入H2气体,(水通过b和c排入B中)。
22.在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水气,故能得到无水MgCl2(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
(3)搅拌,加速溶解; 使待滤液体沿玻璃棒流入漏斗,防止外洒; 搅拌,防止因局部过热液滴或晶体飞溅
23.(1)研钵、托盘天平、酒精灯(答与不答火柴,不给分不扣分)
(2)冷却 防止吸水
(3)检验样品中的结晶水是否已经全部除去
(4)A、C
24. (1) 不漏气;由于不漏气,加水后试管内气体体积减小,导致压强增大,长颈漏斗内的水面高出试管内的水面。
(2)无法确定;由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶。
25.加少量KClO3,插上镁条并将其点燃;
26.①先通入O2,后通入NH3。若先通氨气,氨在空气中不能点燃,逸出造成污染。
②4NH3+3O22N2+6H2O
27.打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
28.取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
29.反应前点燃酒精灯,加热烧瓶一小会儿。在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气。
30.
31.把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
32.先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸(如在试管a中最先加入浓硫酸,此题得0分)
33.当溶液有大量气泡冒出时,取一小试管收集出来的气体以检验气体纯度,实验证明出来的气体足够纯后将其点燃。若气体燃烧火焰呈蓝色;用一冷而干燥的小烧杯罩在该火焰上空,烧杯内壁不出现水珠,证明实验有CO生成。
34.加适量水溶解,搅拌,过滤;烧杯 漏斗
35.用洁净的滴管取少量淀粉水解液滴入碘水中;观察碘水是否变蓝色,若不变蓝色表示淀粉水解完全。
36.①把试纸用蒸馏水湿润 ②检查容量瓶是否漏水 ③用待装液润洗滴定管2~3次(也可以写:检查滴定管是否漏水) ④干燥集气瓶 ⑤调节零点
37.(1)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去。说明纯碱呈碱性是由CO32-引起的。
(2)产生白色沉淀,且红色褪去. 在纯碱溶液中, CO32- 水解:CO32-+H2OHCO3-+OH- 加入BaCl2后:Ba2++CO32-==BaCO3↓(白色),由于[CO32-]减小,CO32-水解平衡左移,[OH-]减小,酚酞褪色
(3)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再加热该溶液溶液的红色加深。说明CO32-水解是吸热的。