- 393.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013高考新课标全国卷1
可能用到的相对原子量 H 1 C 12 N 14 O 16 Mg 24 S 32 K 39 Mn 55
7. 化学无处不在,下列与化学有关的说法不正确的是
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成
8. 香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是
A. 香叶醇的分子式为C10H18O
B. 不能使溴的四氯化碳溶液褪色
C. 不能使酸性高锰酸钾溶液褪色
D. 能发生加成反应不能发生取代反应
9. 短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2- 、 X+ B. X+ 、Y3+ C. Y3+、 Z2- D. X+ 、Z2-
10. 银制器皿日久表面会逐渐变黑,这是生成了Ag2S 的缘故。根据电化学原理可以进行如下处理:在铝制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A. 处理过程中银器一直保持恒重 B. 银器为正极,Ag2S 被还原生成单质银
C. 该过程中总反应为2Al + 3Ag2S = 6Ag + Al2S3 D. 黑色褪去的原因是黑色Ag2S 转化为白色AgCl
11. 已知KSP(AgCl)=1.56×10-10 ,KSP(AgBr)=7.7×10-13 ,KSP(Ag2CrO4)=9.0×10-12。某溶液中含有Cl、Br、和CrO,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010mol·L-1 的AgNO3 溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl、 Br、 CrO B. CrO、 Br、 Cl C. Br、 Cl、 CrO D. Br、 CrO、 Cl
12. 分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些酸和醇重新组合可形成的酯共有 A. 15种 B. 28种 C. 32种 D. 40种
13. 下列实验中,所采取的分离方法与对应原理都正确的是
选项
目的
分离方法
A.
分离溶于水的碘
乙醇萃取
碘在乙醇中的溶解度很大
B.
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C.
除去KNO3 固体中混杂的NaCl
重结晶
NaCl 在水中的溶解度很大
D.
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
26.(13分)
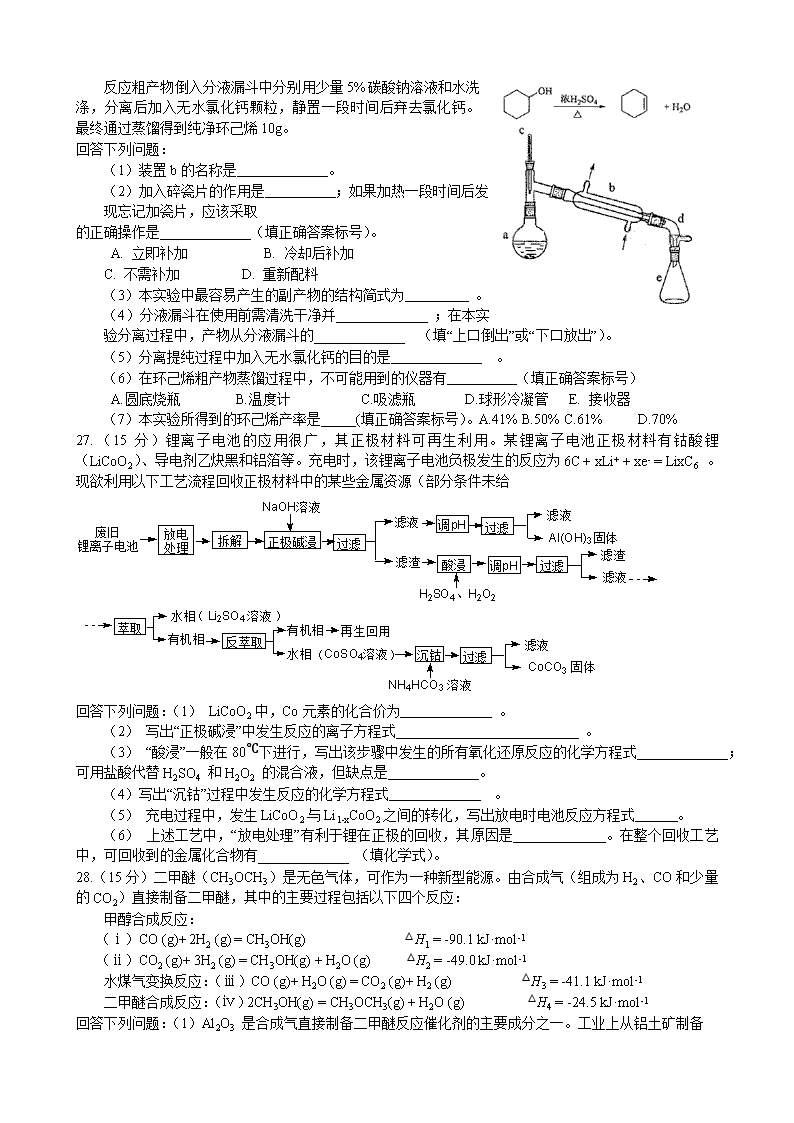
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
相对分子质量
密度/(g·cm-3)
沸点/℃
溶解性
环己醇
100
0.9618
161
微溶于水
环己烯
82
0.8102
83
难溶于水
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水中,开始慢慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取
的正确操作是 (填正确答案标号)。
A. 立即补加 B. 冷却后补加
C. 不需补加 D. 重新配料
(3)本实验中最容易产生的副产物的结构简式为 。
(4)分液漏斗在使用前需清洗干净并 ;在本实验分离过程中,产物从分液漏斗的 (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E. 接收器
(7)本实验所得到的环己烯产率是 (填正确答案标号)。A.41% B.50% C.61% D.70%
27.(15分)锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C + xLi+ + xe- = LixC6 。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给
回答下列问题:(1) LiCoO2中,Co元素的化合价为 。
(2) 写出“正极碱浸”中发生反应的离子方程式 。
(3) “酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4 和H2O2 的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5) 充电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6) 上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
28.(15分)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO (g)+ 2H2 (g) = CH3OH(g) △H1 = -90.1 kJ·mol -1
(ⅱ)CO2 (g)+ 3H2 (g) = CH3OH(g) + H2O (g) △H2 = -49.0 kJ·mol -1
水煤气变换反应:(ⅲ)CO (g)+ H2O (g) = CO2 (g)+ H2 (g) △H3 = -41.1 kJ·mol -1
二甲醚合成反应:(ⅳ)2CH3OH(g) = CH3OCH3(g) + H2O (g) △H4 = -24.5 kJ·mol -1
回答下列问题:(1)Al2O3 是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备
较高纯度Al2O3 的主要工艺流程是 (以化学方程式表示)。
(2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一种产物为水蒸气)的热化学方程式为 。
根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
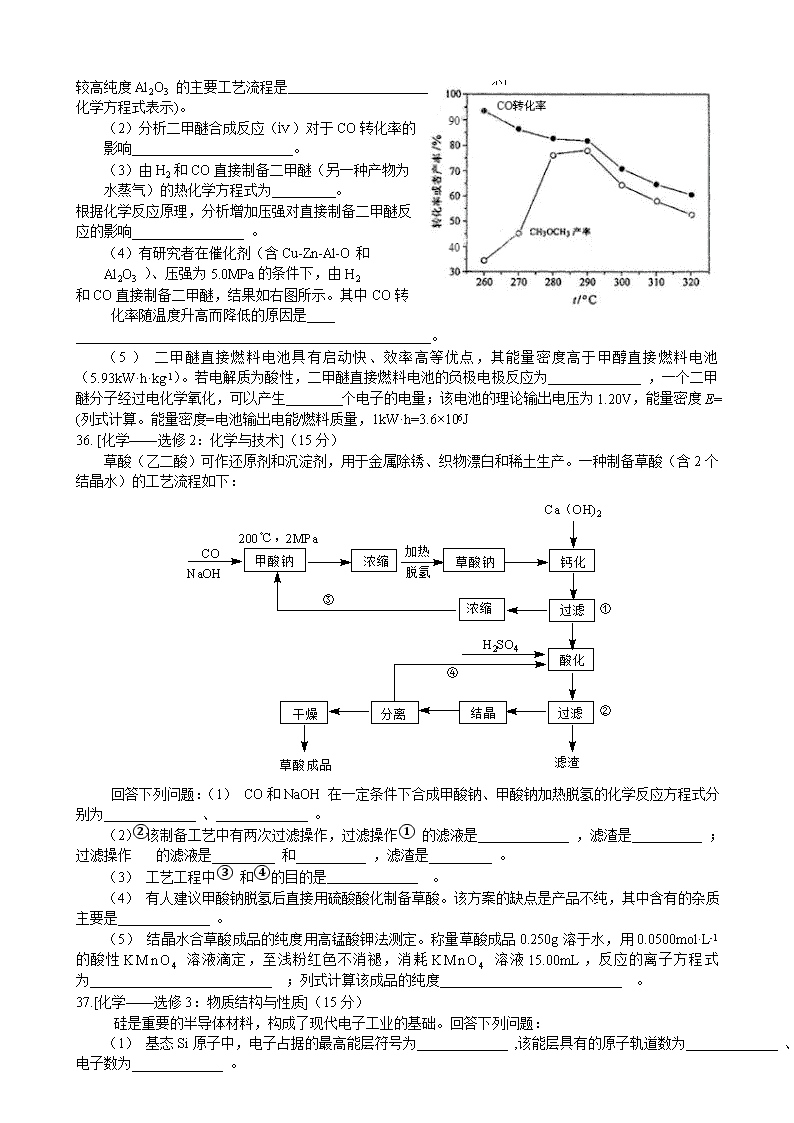
(4)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3 )、压强为5.0MPa的条件下,由H2
和CO直接制备二甲醚,结果如右图所示。其中CO转化率随温度升高而降低的原因是
。
(5) 二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极电极反应为 ,一个二甲醚分子经过电化学氧化,可以产生 个电子的电量;该电池的理论输出电压为1.20V,能量密度E= (列式计算。能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J
36. [化学 ——选修2:化学与技术](15分)
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
回答下列问题:(1) CO和NaOH 在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 、 。
(2) 该制备工艺中有两次过滤操作,过滤操作① 的滤液是 ,滤渣是 ;过滤操作② 的滤液是 和 ,滤渣是 。
(3) 工艺工程中③ 和④的目的是 。
(4) 有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5) 结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水,用0.0500mol·L-1 的酸性KMnO4 溶液滴定,至浅粉红色不消褪,消耗KMnO4 溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
37.[化学 ——选修3:物质结构与性质](15分)
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1) 基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2) 硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3) 单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl 在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键
C-C
C-H
C-O
Si-Si
Si-H
Si-O
键能/(kJ·mol-1)
356
413
336
226
318
452
① 硅与碳同主族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 .
② SiH4的稳定性小于CH4 ,更易生成氧化物,原因是 。
(6) 在硅酸盐中,SiO四面体[(如下图(a)]通过共用顶角氧原子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子个数比为 ,化学式为 。
38. [化学 ——选修5:有机化学基础] (15分)
查尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下:
已知以下信息:
① 芳香烃A的相对分子质量在100~110之间,1 mol A充分燃烧可生成72g水。
② C不能发生银镜反应。
③ D能发生银镜反应、可溶于饱和Na2CO3 溶液、核磁共振氢谱显示其中有4种氢。
④
⑤ RCOCH3 + R’CHO RCOCH=CHR’
回答下列问题:
(1) A的化学名称为 。
(2) 由B生成C的化学方程式为 .
(3) E的分子式为 ,由E生成F的反应类型为 。
(4) G的结构简式为 (不要求立体异构)。
(5) D的芳香同分异构体H既能发生银镜反应,又能发生水解反应,H在酸催化下发
生水解反应的化学方程式为 。
(6) F的同分异构体中,既能发生银镜反应,又能与FeCl3 溶液发生显色反应的共有 种,其中核磁共振氢谱为5组峰,且峰面积之比为2:2:2:1:1的为
(写结构简式)
2013高考全国卷1理综试题(化学)参考答案
7
8
9
10
11
12
13
C
A
C
B
C
D
D
26、(1)冷凝管
(2)防止暴沸 B
(3)
(4)检漏 上口倒出
(5)干燥
(6)C D
(7)C
27、(1)+3
(2)2Al+2OH-+2H2O==2AlO2-+3H2↑
(3)
(4)CoSO3+2NH4HCO3==CoCO3 ↓ +2(NH4)SO4 +H2O +CO2↑
(5)
(6)Li+ 从负极中脱出,经由电解质向正极移动并进入正极材料中;
Al(OH)3 、 CoCO3、Li2SO4
28、(1)1. Al2O3+2NaOH=2NaAlO2+H2O
2. NaAlO2+CO2+2H2O=Al(OH)3↓ (沉淀符号)+NaHCO3
3. 2Al(OH)3 Al2O3+3H2O
(2)消耗甲醇,促进甲醇合成反应(ⅰ)平衡右移,CO转化率变大;生成的水通过水煤气变换反应(ⅲ)消耗部分CO
(3)4H2(g)+2CO(g)==CH3OCH3(g)+H2O(g);△H=-204.7kJ/mol,该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加。压强升高使CO和H2浓度增大,反应速率增大。
(4)该反应为放热反应,其他条件不变的情况下,温度升高,平衡向逆反应方向移动,转化率降低。
(5)3H2O+CH3OCH3-12e-==2CO2+12H+ 12
36、(选修2)
(1)CO+NaOH HCOONa
2HCOONa==NaOOC-COONa+H2
(2) NaOH溶液 草酸钙; 草酸溶液 H2SO4溶液, CaSO4
(3)分别循环利用NaOH 和H2SO4 ,减小污染。
(4) Na2SO4
(5) 2MnO4-+5HOOC-COOH+6H+==5CO2+2Mn2++8H2O
37、(选修3)
(1)M 9 4
(2)二氧化硅
(3)非极性共价键 ,3
(4)Mg2Si+4NH4Cl==SiH4+2MgCl2+4NH3
(5)C-H键的键能大于C-O键,C-H键比C-O键稳定。而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键
38、(选修5)
(1)苯乙烯
(2)
(3)C7H5O2Na 取代反应
(4)
(5)
(6)13