- 11.47 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学实验
J1 化学实验常见仪器与基本方法
25.J2 J1 J4 D3 D4
[2013·福建卷] 固体硝酸盐加热易分解且产物较复杂。某学习小组以 Mg (NO3)2 为研究对
象,拟通过实验探究其热分解的产物,提出如下 4 种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1) 实 验 前 , 小 组 成 员 经 讨 论 认 定 猜 想 丁 不 成 立 , 理 由 是
________________________________________________________________________________
。
查阅资料得知:2NO2+2NaOH===NaNO3+NaNO2+H2O。
针对甲、乙、丙猜想,设计如图 0 所示的实验装置(图中加热、夹持仪器等均省略):
图 0
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭 k,微热硬质玻璃管(A),观察到 E 中有气泡连
续 放 出 , 表 明
________________________________________________________________________
________________________________________________________________________。
②称取 Mg(NO3)2 固体 3.7 g 置于 A 中,加热前通入 N2 以驱尽装置内的空气,其目的是
________________________________________________________________________
________________________________________________________________________;
关闭 k,用酒精灯加热时,正确操作是先____________,然后固定在管中固体部位下加热。
③观察到 A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为 1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量,经分析可初步确认猜想________是正确的。
②根据 D 中无明显现象,一位同学认为不能确认分解产物中有 O2,因为若有 O2,D 中将发
生 氧 化 还 原 反 应 :
________________________________________________________________________
________________________________________________________________________
(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有 O2 存在,未检测到的
原因是________________________________________________________________________
________________________________________________________________________。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
25.[答案] (1)不符合氧化还原反应原理(或其他合理答案)
(2)①装置气密性良好
②避免对产物 O2 的检验产生干扰(或其他合理答案) 移动酒精灯预热硬质玻璃管
(3)①乙
②2Na2SO3+O2===2Na2SO4 O2 在通过装置 B 时已参与反应(或其他合理答案)
[解析] (1)若 Mg(NO3)2 热分解产物为 MgO、NO2、N2,氮元素化合价部分由+5 价降为+4
价,另一部分由+5 价降为 0 价,元素的化合价只降不升,不符合氧化还原反应原理,故猜想
丁不成立;(2)①整套装置所含仪器连接后,放入固体试剂之前,关闭 k,微热硬质玻璃试管(A),
观察到 E 中有气泡连续放出,表明装置气密性良好;②猜想甲、乙、丙中均有 O2,通常条件
下氮气的性质很稳定,则加热前通入 N2 驱尽装置内空气的目的是避免空气对产物 O2 的检验产
生干扰;加热试管中固体时要预热,正确的操作方法是移动酒精灯预热硬质玻璃管,然后固
定在有固体部位下加热;(3)①A 中有红棕色气体,说明硝酸镁热分解产物中含有 NO2;剩余固
体中加入适量水,未见明显现象,说明硝酸镁热分解产物中不含亚硝酸镁,也不含氮化镁,
因为 Mg(NO2)2 可溶于水,Mg3N2 与水发生双水解反应,生成白色沉淀和刺激性气味的气体,由
此推断猜想乙成立;②氧气具有氧化性,亚硫酸钠具有还原性,二者发生氧化还原反应,生
成硫酸钠,配平可得:2Na2SO3+O2===2Na2SO4;实验时二氧化氮与氢氧化钠溶液反应可能存在
过量问题,若氢氧化钠不足,则 B 中不仅发生了反应 2NO2+2NaOH===NaNO3+NaNO2+H2O,而且
可能发生如下反应:3NO2+H2O===2HNO3+NO、2NO+O2===2NO2,即 O2 在通过装置 B 时已经参与
反应,导致硝酸镁热分解产生的氧气在 D 之前已经被消耗完全。
10.J1 J2 [2013·福建卷] 下列有关实验的做法不正确的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制 0.100 0 mol·L-1 氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验 NH +
4 时,往试样中加入 NaOH 溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气
体
10.D [解析] 分液时,分液漏斗中的下层液体先从下口放出,上层液体从上口倒出,A
项正确;碳酸氢钠受热易分解,生成二氧化碳、水和碳酸钠固体,而碳酸钠固体受热不分解,
B 项正确;配制 0.100 0 mol·L-1 氯化钠溶液时,需要玻璃棒将液体引流转移到容量瓶中,C
项正确;检验 NH +
4 时,往试样中加入 NaOH 溶液,微热,用湿润的红色石蕊试纸检验逸出的气
体,若试纸变蓝,说明试样中含有铵根离子,D 项错误。
33.J3 J1 D2 J4 J5 F3 F5 C5
[2013·广东卷] 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,
提升科学素养。
(1)在实验室中用浓盐酸与 MnO2 共热制取 Cl2 并进行相关实验。
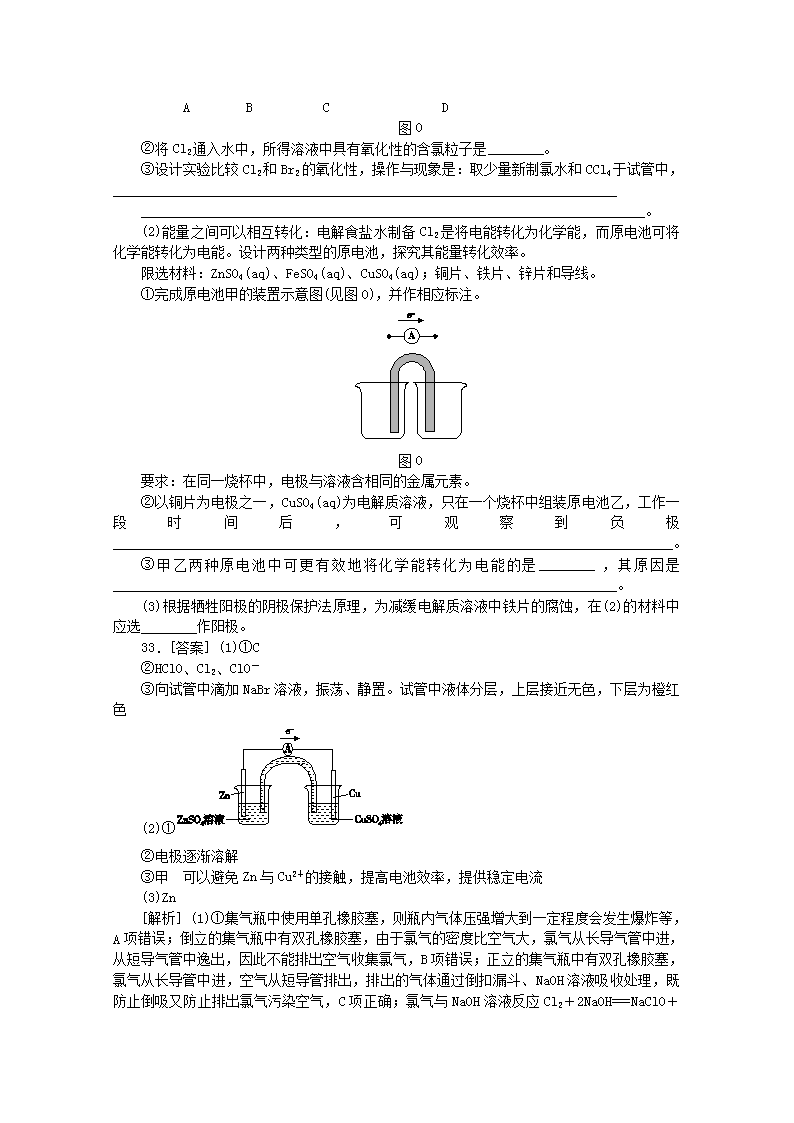
①下列收集 Cl2 的正确装置是________。
A B C D
图 0
②将 Cl2 通入水中,所得溶液中具有氧化性的含氯粒子是________。
③设计实验比较 Cl2 和 Br2 的氧化性,操作与现象是:取少量新制氯水和 CCl4 于试管中,
________________________________________________________________________
________________________________________________________________________。
(2)能量之间可以相互转化:电解食盐水制备 Cl2 是将电能转化为化学能,而原电池可将
化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq)、FeSO4(aq)、CuSO4(aq);铜片、铁片、锌片和导线。
①完成原电池甲的装置示意图(见图 0),并作相应标注。
图 0
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一
段 时 间 后 , 可 观 察 到 负 极
________________________________________________________________________________
。
③甲 乙两 种原 电 池中 可更 有 效地 将 化学 能转 化 为电 能的 是 ________ ,其 原因 是
________________________________________________________________________。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中
应选________作阳极。
33.[答案] (1)①C
②HClO、Cl2、ClO-
③向试管中滴加 NaBr 溶液,振荡、静置。试管中液体分层,上层接近无色,下层为橙红
色
(2)①
②电极逐渐溶解
③甲 可以避免 Zn 与 Cu2+的接触,提高电池效率,提供稳定电流
(3)Zn
[解析] (1)①集气瓶中使用单孔橡胶塞,则瓶内气体压强增大到一定程度会发生爆炸等,
A 项错误;倒立的集气瓶中有双孔橡胶塞,由于氯气的密度比空气大,氯气从长导气管中进,
从短导气管中逸出,因此不能排出空气收集氯气,B 项错误;正立的集气瓶中有双孔橡胶塞,
氯气从长导管中进,空气从短导管排出,排出的气体通过倒扣漏斗、NaOH 溶液吸收处理,既
防止倒吸又防止排出氯气污染空气,C 项正确;氯气与 NaOH 溶液反应 Cl2+2NaOH===NaClO+
NaCl+H2O,因此不能用排 NaOH 溶液的方法收集氯气,D 项错误;②氯气与水发生可逆反应 Cl2
+H2O H++Cl-+HClO,所得氯水中含 H2O、Cl2、H+、Cl-、HClO、ClO-、OH-等离子,其中
具有强氧化性的含氯粒子是 Cl2、HClO、ClO-;(2)①带盐桥的原电池甲可以设计锌铜原电池(或
铁铜原电池、锌铁原电池),由于外电路中电子从左移向右,说明左边烧杯中电极的金属性较
强,则左、右两边烧杯中电极材料及电解质溶液可以为锌片和硫酸锌溶液、铜片和硫酸铜溶
液(或者铁片和硫酸亚铁溶液、铜片和硫酸铜溶液,锌片和硫酸锌溶液、铁片和硫酸亚铁溶液);
②金属活动性 Zn>Fe>Cu,则原电池乙中铜片作正极,锌片或铁片作负极,工作一段时间后,
负极金属锌或铁被氧化,质量减轻,溶液中蓝色变浅;③甲、乙两种原电池都能将化学能转
化为电能,其中带有盐桥的原电池甲中的负极金属锌(或铁)和硫酸铜没有直接接触,二者不
会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极
金属锌(或铁)和硫酸铜直接接触发生置换反应,部分化学能会转化为热能,化学能不能全部
转化为电能;(3)铁片作正极(阴极)时被保护,而铁作负极(阳极)时被腐蚀,为了减缓电解质
溶液中铁片的腐蚀,在(2)的材料中应选择比铁活泼的锌片作负极(阳极),使铁片作正极(阴
极),从而牺牲锌片保护铁片;不能选择铜片,因为铜作正极(阴极),而铁片作负极(阳极),
此时铁片的腐蚀速率加快,而不是延缓。
28.J1 J2 J3 J4 J5
[2013·全国卷] 制备氮化镁的装置示意图如下:
图 0
回答下列问题:
(1) 检 查 装 置 气 密 性 的 方 法 是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________,
a 的名称是____________,b 的名称是____________。
(2) 写 出 NaNO2 和 (NH4)2SO4 反 应 制 备 氮 气 的 化 学 方 程 式
________________________________________________________________________。
(3)C 的作用是____________________,D 的作用是______________,是否可以把 C 与 D
的 位 置 对 调 并 说 明 理 由
________________________________________________________________________________
________________________________________________________________________。
(4) 写 出 E 中 发 生 反 应 的 化 学 方 程 式
________________________________________________________________________
________________________________________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及
现象________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
28.[答案] (1)微热 b,这时 G 中有气泡冒出,停止加热冷却后,G 中插在溶液里的玻璃
管形成一段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2=====△ 2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg=====△ Mg3N2
(5)取少量产物于试管中,加少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把
润湿的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,
若观察到有气泡产生,则证明产物中含有未反应的镁
[解析] (1) 气密性检查的基本思路: 装置形成封闭体系→操作(微热、手捂、热毛巾捂、
加水等)→描述现象→得出结论。(2) (NH4)2 SO4 与 NaNO2 发生氧化还原反应生成 N2。(3)硫酸
亚铁能被氧气氧化,故其作用是除去氧气。 浓硫酸的作用是除去水蒸气,如果 CD 对换,则
可能从硫酸亚铁溶液中带出水蒸气,无法干燥。(4)氮气与镁反应生成 Mg3N2。(5) 检验氮化镁
可根据氮化镁与水反应的现象判断,氮化镁会与水反应生成 NH3 和 Mg(OH)2 沉淀,NH3 为碱性气
体,挥发出来,遇红色石蕊试纸后会使其变蓝。
10.J1 J2 [2013·全国卷] 下列操作不能达到目的的是( )
选项 目的 操作
A 配制 100 mL 1.0 mol·L-1 CuSO4 溶液 将 25 g CuSO4·5H2O 溶于 100 mL 蒸馏水
中
B 除去 KNO3 中少量 NaCl 将混合物制成热的饱和溶液,冷却结晶,
过滤
C 在溶液中将 MnO -
4 完全转化为 Mn2+ 向酸性 KMnO4 溶液中滴加 H2O2 溶液至紫色
消失
D 确定 NaCl 溶液中是否混有 Na2CO3
取少量溶液滴加 CaCl2 溶液,观察是否出
现白色沉淀
10.A [解析] 应将 25 g CuSO4·5H2O 配成 100 mL 溶液而不是溶于 100 mL 水中, A 项
错误;NaCl 的溶解度受温度的影响比较小,冷却结晶时 KNO3 大量析出,过滤可分离,B 项正
确;H2O2 具有还原性,可将紫色 MnO -
4 还原为无色的 Mn2+,C 项正确;利用 Ca2+与 CO 2-
3 结合生
成 CaCO3 白色沉淀的反应来判断 Na2CO3 是否存在, D 项正确。
11.J1 J2
[2013·山东卷] 利用实验器材(规格和数量不限)能完成相应实验的一项是( )
选项 实验器材(省略夹持装置) 相应实验
A 烧杯、玻璃棒、蒸发皿 CuSO4 溶液的浓缩结晶
B 烧杯、玻璃棒、胶头滴管、滤纸 用盐酸除去 BaSO4 中少量 BaCO3
C 烧杯、玻璃棒、胶头滴管、容量瓶 用固体 NaCl 配制 0.5 mol·L-1 的溶液
D 烧杯、玻璃棒、胶头滴管、分液漏斗 用溴水和 CCl4 除去 NaBr 溶液中少量 NaI
11.D [解析] CuSO4 溶液浓缩结晶需要加热,缺少酒精灯,A 项错误;用盐酸除去 BaSO4
中的 BaCO3,方法是将固体样品溶于盐酸中后过滤、洗涤,缺少组成过滤器的仪器——漏斗,
B 项错误;配制一定物质的量浓度的 NaCl 溶液,需要称取一定质量的 NaCl,缺少称量用的托
盘天平,C 项错误;除去 NaBr 溶液中少量的 NaI,只需将溴水加入含有少量 NaI 的 NaBr 溶液
充分反应后,再采取萃取操作即可,因此需要的仪器有烧杯、玻璃棒、胶头滴管、分液漏斗,
D 项正确。
9.C3 F4 J1 J4
[2013·天津卷] FeCl3 在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程
制备无水 FeCl3,再用副产品 FeCl3 溶液吸收有毒的 H2S。
Ⅰ.经查阅资料得知:无水 FeCl3 在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
图 0
①检验装置的气密性;
②通入干燥的 Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入 Cl2,并用干燥的 N2 赶尽 Cl2,将收集器密封。
请回答下列问题:
(1) 装 置 A 中 反 应 的 化 学 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
(2)第③步加热后,生成的烟状 FeCl3 大部分进入收集器,少量沉积在反应管 A 右端。要
使 沉 积 的 FeCl3 进 入 收 集 器 , 第 ④ 步 操 作 是
________________________________________________________________________。
(3)操作步骤中,为防止 FeCl3 潮解所采取的措施有(填步骤序号)________。
(4) 装 置 B 中 冷 水 浴 的 作 用 为
________________________________________________________________________;
装置 C 的名称为________;装置 D 中 FeCl2 全部反应后,因失去吸收 Cl2 的作用而失效,
写出检验 FeCl2 是否失效的试剂:________。
(5)在虚线框中画出尾气吸收装置 E 并注明试剂。
Ⅱ.该组同学用装置 D 中的副产品 FeCl3 溶液吸收 H2S,得到单质硫;过滤后,再以石墨为
电极,在一定条件下电解滤液。
(6)FeCl3 与 H2S 反 应 的 离 子 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
(7) 电 解 池 中 H + 在 阴 极 放 电 产 生 H2 , 阳 极 的 电 极 反 应 式 为
________________________________________________________________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
① H2S 的 原 子 利 用 率 为 100% ;
②________________________________________________________________________。
9.[答案] (1)2Fe+ 3Cl2=====△ 2FeCl3
(2)在沉积的 FeCl3 固体下方加热
(3)②⑤
(4)冷却,使 FeCl3 沉积,便于收集产品 干燥管
K3[Fe(CN)6]溶液
(5)
(6)2Fe3++ H2S===2Fe2++S↓+2H+
(7)Fe2+-e-===Fe3+
(8)FeCl3 得到循环利用
[解析] (1)Cl2 与铁屑加热发生反应 2Fe+3Cl2=====△ 2FeCl3。
(2)根据 FeCl3 加热易升华,可在沉积 FeCl3 固体的下方用酒精灯加热,使 FeCl3 全部进入
收集器。
(3)第②步通入干燥的 Cl2 和第⑤步通入干燥的 N2,都是防止 FeCl3 潮解所采取的措施。
(4)装置 B 中冷水浴的作用是冷却 FeCl3,便于产品收集;Fe2+遇 K3[Fe(CN)6]溶液变蓝,
故可用 K3[Fe(CN)6]溶液检验 FeCl2 是否完全反应。
(5)用 NaOH 溶液吸收含 Cl2 的尾气。
(6)FeCl3 溶液吸收 H2S 有单质硫生成,故该反应的离子方程式为 2Fe3++H2S===2Fe2++S↓
+2H+。
(7)惰性电极电解 FeCl2 和 HCl 的混合溶液,由于还原性 Fe2+>Cl-,所以 Fe2+优先在阳极
上失去电子被氧化成 Fe3+。
(8)实验Ⅱ中 FeCl3 溶液吸收 H2S 后变成 FeCl2 和 HCl 的混合溶液,通过电解又变成 FeCl3
溶液,所以 FeCl3 溶液的循环利用是该实验的又一个优点。
4.J1 [2013·天津卷] 下列实验误差分析错误的是( )
A.用润湿的 pH 试纸测稀碱溶液的 pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
4.B [解析] 用润湿的 pH 试纸测稀碱溶液 pH 时,碱溶液被稀释,溶液 c(OH-)减小,测
定值偏小,A 项正确;定容时俯视刻度线,导致所配溶液的体积偏小,浓度偏大,B 项错;滴
定管终点读数时由于气泡的存在,显然所测溶液的体积偏小,C 项正确;测定中和热时,将碱
缓慢倒入酸,导致热量散失大,所测温度值偏小,D 项正确。
4.J1 J2 [2013·重庆卷] 按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性
的天然产物。下列说法错误的是( )
图 0
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
4.C [解析] 样品粉末加入甲苯和甲醇后,形成的是固体和液体的混合物,步骤(1)得
到溶液和不溶性物质,应该采用过滤的方法,A 项正确;步骤(2)分离水层溶液和有机层溶液,
需要用到分液漏斗,B 项正确;步骤(3)从水层溶液得到固体粗产品,采用蒸发结晶的方法,
需要用到蒸发皿,C 项错误;步骤(4)从有机层溶液得到甲苯,应该采用蒸馏的方法,D 项正
确。
11.B2 J1 J2 N4
[2013·四川卷] 明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备 Al、K2SO4 和
H2SO4 的工艺过程如下所示:
图 0
焙烧明矾的化学方程式为 4KAl(SO4)2·12H2O+3S===2K2SO4+2Al2O3+9SO2↑+48H2O。
请回答下列问题。
(1)在焙烧明矾的反应中,还原剂是________。
(2) 从 水 浸 后 的 滤 液 中 得 到 K2SO4 晶 体 的 方 法 是
________________________________________________________________________
________________________________________________________________________。
(3)Al2O3 在一定条件下可制得 AlN,其晶体结构如图所示,该晶体中 Al 的配位数是
________。
图 0
(4)以 Al 和 NiO(OH)为电极,NaOH 溶液为电解液组成一种新型电池,放电时 NiO(OH)转化
为 Ni(OH)2 , 该 电 池 反 应 的 化 学 方 程 式 是
________________________________________________________________________。
(5)焙烧产生的 SO2 可用于制硫酸。已知 25 ℃、101 kPa 时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ/mol;
H2O(g)===H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ/mol。
则:
① SO3(g) 与 H2O(l) 反 应 的 热 化 学 方 程 式 是
________________________________________________________________________
________________________________________________________________________。
②焙烧 948 t 明矾(M=474 g/mol),若 SO2 的利用率为 96%,可生产质量分数为 98%的硫
酸________t。
11.[答案] (1)S(硫)
(2)蒸发结晶
(3)4
(4)Al+3NiO(OH)+NaOH+H2O===NaAlO2+3Ni(OH)2
(5)①SO3(g)+H2O(l)===H2SO4(l)
ΔH=-130 kJ/mol
②432
[解析] (1)结合明矾煅烧的方程式可知,S 的化合价升高,被氧化,作还原剂。(2)从溶
液中得到晶体的方法为蒸发浓缩、冷却结晶、过滤。(3)结合 AlN 的晶体图可推出处于晶胞体
心的 Al 与 4 个 N 直接相连,因此该晶体中 Al 的配位数为 4。(4)利用题中放电时信息可知 NiOOH
作正极(放电时发生还原反应),则 Al 作负极,因电解质溶液为 NaOH,则放电时 Al 极发生氧
化 反 应 生 成 NaAlO2 , 由 此 容 易 写 出 电 池 总 反 应 。 (5)① 首 先 写 出 该 反 应 为 SO3(g) +
H2O(l)===H2SO4(l),利用盖斯定律,将方程式进行叠加:③-①-②×2,则ΔH=-545 kJ/mol
-(-197 kJ/mol)-(-44 kJ/mol)×2=-260 kJ/mol;②结合题中给出煅烧明矾的方程式
可得关系式:4KAl(SO4)2·12H2O~9SO2~9H2SO4,可知 948 t 明矾可得到 98%的浓硫酸的质量为
948×106 g
474 g·mol-1×9
4
×96%×98 g·mol-1
98%
×10-6 g·t-1=432 t。
26.J1 J2 J5
[2013·新课标全国卷Ⅰ] 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实
验装置如下:
OH ――→浓 H2SO4
△ +H2O
图 0
可能用到的有关数据如下:
相对分子质量 密度/(g·cm-3) 沸点/℃ 溶解性
环己醇 100 0.961 8 161 微溶于水
环己烯 82 0.810 2 83 难溶于水
合成反应:
在 a 中加入 20 g 环己醇和 2 小片碎瓷片,冷却搅动下慢慢加入 1 mL 浓硫酸。b 中通入冷
却水后,开始缓慢加热 a,控制馏出物的温度不超过 90 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,分别用少量 5%碳酸钠溶液和水洗涤,分离后加入无水氯
化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净的环己烯 10 g。
回答下列问题:
(1)装置 b 的名称是________。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正
确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏
斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50%
C.61% D.70%
26.[答案] (1)直形冷凝管
(2)防止暴沸 B
(3)O
(4)检漏 上口倒出
(5)干燥(或除水除醇)
(6)C D (7)C
[解析] (1)冷凝管有直形冷凝管、空气冷凝管、球形冷凝管和蛇形冷凝管。根据形状进
行识别,可知装置 b 的名称为直形冷凝管。
(2)碎瓷片具有防止暴沸的作用;在加热开始后发现没加沸石,应停止加热,待稍冷却后
再加入沸石,否则易发生爆炸。
(3)醇在浓硫酸、加热条件下可发生分子内消去生成烯或分子间脱水生成醚,另一副产物
为分子间脱水生成的 O。
(4)分液漏斗使用前有两处需检漏,分别为上口及旋塞处;环己烯密度小于水,分液后应
从上口倒出。
(5)无水氯化钙具有干燥作用(或除水除醇)。
(6)观察蒸馏装置,可知不需要的仪器有吸滤瓶、球形冷凝管。
(7)环己烯的产率=10 g÷
20 g× 82
100 ×100%=61%。
36.B1 F3 J1
[2013·新课标全国卷Ⅱ] [化学——选修 2:化学与技术]锌锰电池(俗称干电池)在生活
中的用量很大。两种锌锰电池的构造如图 0 所示。
两种干电池的构造示意图
图 0
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主
要 反 应 是
________________________________________________________________________。
② 与 普 通 锌 锰 电 池 相 比 , 碱 性 锌 锰 电 池 的 优 点 及 其 理 由 是
________________________________________________________________________。
(2)图 0 表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量
其他金属)。
一种回收利用废旧普通锌锰电池的工艺
图 0
① 图 0 中 产 物 的 化 学 式 分 别 为 A________ ,
B________________________________________________________________________。
②操作 a 中得到熔块的主要成分是 K2MnO4。操作 b 中,绿色的 K2MnO4 溶液反应后生成紫
色 溶 液 和 一 种 黑 褐 色 固 体 , 该 反 应 的 离 子 方 程 式 为
________________________________________________________________________。
③采用惰性电极电解 K2MnO4 溶液也能得到化合物 D,则阴极处得到的主要物质是
________(填化学式)。
36.[答案] (1)①Zn NH4Cl
MnO2+NH+
4 +e-===MnOOH+NH3
②碱性电池不易发生电解质的泄漏,因为消耗的负极改装在电池的内部;碱性电池使用
寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高(答对一条即可)
(2)①ZnCl2 NH4Cl
②3MnO2-
4 +2CO2===2MnO-
4 +MnO2↓+2CO2-
3
③H2
[解析] (1)①结合普通电池的主要反应可知,负极材料为 Zn,正极 MnO2 得电子形成 MnOOH,
电解质溶液即是 NH4Cl。②普通干电池的负极即是外壳,容易漏液;碱性锌锰干电池的金属外
壳在碱性条件下稳定性增强,使用寿命延长。(2)①黑色固体混合物即是 ZnCl2、NH4Cl、MnOOH,
可溶性物质 ZnCl2、NH4Cl 在加热过程中,NH4Cl 分解,直接得到固体 A 为 ZnCl2,分解产生的
NH3、HCl 冷却重新化合成 NH4Cl。②K2MnO4 反应得到紫色溶液即是 KMnO4 溶液,黑色固体即是
MnO2,即+6 价 Mn 发生歧化反应,配平该反应即可。③阴极处为阳离子 H+放电得到 H2。
27.C5 J1 J2
[2013·新课标全国卷Ⅱ] 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工
业级氧化锌[含有 Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业 ZnO ――→稀硫酸
① 浸出液 ――→调 pH 约为 5适量高锰酸钾溶液
② ――→过滤 滤液――→Zn
③ ――→过滤 滤液――→Na2CO3
④ ――→过滤 滤饼
――→煅烧
⑤ ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是 MnO2。
回答下列问题:
(1) 反 应 ② 中 除 掉 的 杂 质 离 子 是 ________ , 发 生 反 应 的 离 子 方 程 式 为
________________________________________________________________________;
在 加 高 锰 酸 钾 溶 液 前 , 若 pH 较 低 , 对 除 杂 的 影 响 是
________________________________________________________________________
________________________________________________________________________。
(2)反应③的反应类型为________ ,过滤得到的滤渣中,除了过量的锌外还有________。
(3) 反 应 ④ 形 成 的 沉 淀 要 用 水 洗 , 检 验 沉 淀 是 否 洗 涤 干 净 的 方 法 是
________________________________________________________________________
________________________________________________________________________。
(4)反应④中产物的成分可能是 ZnCO3·xZn(OH)2。取干燥后的滤饼 11.2 g,煅烧后可得
到产品 8.1 g,则 x 等于________。
27.[答案] (1)Fe2+和 Mn2+ MnO-
4 +3Fe2++7H2O===3Fe(OH)3↓+MnO2↓+5H+,2MnO-
4 +3Mn2
++2H2O===5MnO2↓+4H+ 铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
(2)置换反应 镍
(3)取少量水洗液于试管中,滴入 1~2 滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生
成,则说明沉淀已经洗涤干净
(4)1
[解析] (1)反应②加入强氧化剂,能将还原剂离子氧化至高价态,信息明确 Ni2+不被氧
化,即是 Fe2+和 Mn2+被氧化除去;结合信息,欲除去该离子,被氧化后的高价离子应生成对
应的沉淀物,据氧化还原反应方程式的配平原理配平即可;若酸性较强,生成的沉淀将会发
生溶解。(2)反应③是 Zn 将 Ni2+置换出来,那么滤渣成分是过量锌与产物镍。(3)分析流程图
可知反应④沉淀上吸附有杂质 SO2-
4 ,因此,检验沉淀是否洗涤干净的方法是:取最后一次洗涤
液,滴加硝酸酸化,再加入 Ba(NO3)2 溶液看是否有沉淀生成。(4)生成 ZnO 的质量为 8.1 g,
n(ZnO) = 8.1 g
81 g·mol-1 = 0.1 mol , 则 n(Zn) = 0.1 mol , 据 Zn 守 恒 , 有
11.2 g
125 g·mol-1+99 g·mol-1·x
(1+x)=0.1 mol,解得 x=1。
26.J1 J4 L2 L4
[2013·新课标全国卷Ⅱ] 正丁醛是一种化工原料。某实验小组利用如下装置合成正丁
醛。
图 0
发生的反应如下:
CH3CH2CH2CH2OH ――→Na2Cr2O7
H2SO4 △CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ 密度/(g·cm-3) 水中溶解性
正丁醇 117.2 0.810 9 微溶
正丁醛 75.7 0.801 7 微溶
实验步骤如下:
将 6.0 g Na2Cr2O7 放入 100 mL 烧杯中,加 30 mL 水溶解,再缓慢加入 5 mL 浓硫酸,将所
得溶液小心转移至 B 中。在 A 中加入 4.0 g 正丁醇和几粒沸石,加热。当有蒸气出现时,开
始滴加 B 中溶液。滴加过程中保持反应温度为 90~95 ℃,在 E 中收集 90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集 75~77 ℃馏分,产量
2.0 g。
回答下列问题:
(1) 实 验 中 , 能 否 将 Na2Cr2O7 溶 液 加 到 浓 硫 酸 中 , 说 明 理 由
________________________________________________________________________。
(2) 加 入 沸 石 的 作 用 是
________________________________________________________________________。
若 加 热 后 发 现 未 加 沸 石 , 应 采 取 的 正 确 方 法 是
________________________________________________________________________。
(3)上述装置图中,B 仪器的名称是________,D 仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥
c.检漏 d.标定
(5) 将 正 丁 醛 粗 产 品 置 于 分 液 漏 斗 中 分 水 时 , 水 在
________________________________________________________________________
层(填“上”或“下”)。
(6) 反 应 温 度 应 保 持 在 90 ~ 95 ℃ , 其 原 因 是
________________________________________________________________________
________________________________________________________________________。
(7)本实验中,正丁醛的产率为________%。
26.[答案] (1)不能,易迸溅
(2)防止暴沸 冷却后补加
(3)滴液漏斗 直形冷凝管
(4)c
(5)下
(6)既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(7)51
[解析] (1)溶液加入浓硫酸,相当于水加入浓硫酸中,易使液体飞溅出来造成实验事故,
因此不能将 Na2Cr2O7 溶液加入到浓硫酸中。(2)沸石的作用是防止局部受热发生暴沸。加热后
发现未加沸石,只能选择停止加热,冷却后再添加沸石。(4)分液漏斗有接口,应首先检漏。
(5)正丁醛的密度小于水的密度,正丁醛在上层,水在下层。(6)正丁醇的沸点为 117.2 ℃,
正丁醛的沸点为 75.7 ℃,控制温度,一方面是为了蒸出正丁醛,另一方面避免温度过高醛基
被氧化。(7)结合 C4H10O→C4H8O,正丁醛的理论产量为 4 g×72
74
,产率为
2 g
4 g×72
74
×100%=51%。
J2 物质的分离、提纯与检验
13.J2 [2013·江苏卷] 下列依据相关实验得出的结论正确的是( )
A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是
碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯
D.向某溶液中滴加 KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含
Fe2+
13.D [解析] 所述溶液中含有 HCO -
3 也会有类似现象,A 项错误;焰色反应是元素的性
质,故原溶液也可能是 NaOH 溶液,B 项错误; SO2、甲醛、乙烯、丙烯等气体都能使溴水褪
色,C 项错误;向某溶液中加入 KSCN 溶液不变色,证明溶液中无 Fe3+,滴加氯水后显红色则
证明溶液中有 Fe2+被氧化成 Fe3+,D 项正确。
27.J2 J4 [2013·安徽卷] 二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏
生产过程中产生大量的废玻璃粉末(含 SiO2、Fe2O3、CeO2 以及其他少量可溶于稀酸的物质)。某
课题组以此粉末为原料回收铈,设计实验流程如下:
图 0
(1)洗涤滤渣 A 的目的是为了除去________(填离子符号),检验该离子是否洗净的方法是
________________________________________________________________________。
(2) 第 ② 步 反 应 的 离 子 方 程 式 是
________________________________________________________________________,
滤渣 B 的主要成分是________。
(3)萃取是分离稀土元素的常用方法,已知化合物 TBP 作为萃取剂能将铈离子从水溶液中
萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要
玻璃仪器有________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的 Ce(OH)4 产品 0.536 g,加硫酸溶解后,用 0.100 0 mol·L-1 FeSO4
标准溶液滴定至终点时(铈被还原为 Ce3+),消耗 25.00 mL 标准溶液。该产品中 Ce(OH)4 的质
量分数为________。
27.[答案] (1)Fe3+ 取最后一次洗涤液,加入 KSCN 溶液,若不出现红色,则已洗净;
反之,未洗净(其他合理答案均可)
(2)2CeO2+H2O2+6H+===2Ce3++O2↑+4H2O SiO2(其他合理答案均可)
(3)不能 分液漏斗
(4)97.0%
[解析] (1)由流程图可知,利用滤渣 A 最终可回收铈,故可推知滤渣 A 中含有 CeO2 和不
溶于盐酸的 SiO2,滤液 A 中的溶质则为 Fe2O3 与盐酸反应生成的 FeCl3,滤渣 A 是从 FeCl3 溶液
中过滤得到,故洗涤滤渣 A 的目的是除去表面沾附的 Fe3+;检验是否洗净可通过取最后一次
洗涤液,用 KSCN 溶液来检验洗涤液中是否含有 Fe3+。(2)第②步是在酸性条件下,CeO2 与 H2O2
发生氧化还原反应,CeO2 被还原为 Ce3+,则 H2O2 被氧化为 O2,故可写出反应的离子方程式;结
合(1)中分析可知滤渣 B 的主要成分是 SiO2。(3)由 TBP 可用作从水溶液中萃取铈离子的萃取
剂可知 TBP 不能与水互溶;萃取操作用到的仪器有分液漏斗、烧杯、玻璃棒、量筒等。(4)利
用电子守恒、原子守恒可得关系式:Ce(OH)4~Ce4+~Fe2+,由此可得 0.536 g 样品中含有
m[Ce(OH)4]=0.100 0 mol·L-1×0.025 L×208 g·mol-1=0.52 g,所以产品中 Ce(OH)4 的质
量分数为 0.52 g÷0.536 g×100%=97.0%。
25.J2 J1 J4 D3 D4
[2013·福建卷] 固体硝酸盐加热易分解且产物较复杂。某学习小组以 Mg (NO3)2 为研究对
象,拟通过实验探究其热分解的产物,提出如下 4 种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1) 实 验 前 , 小 组 成 员 经 讨 论 认 定 猜 想 丁 不 成 立 , 理 由 是
________________________________________________________________________________
。
查阅资料得知:2NO2+2NaOH===NaNO3+NaNO2+H2O。
针对甲、乙、丙猜想,设计如图 0 所示的实验装置(图中加热、夹持仪器等均省略):
图 0
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭 k,微热硬质玻璃管(A),观察到 E 中有气泡连
续 放 出 , 表 明
________________________________________________________________________
________________________________________________________________________。
②称取 Mg(NO3)2 固体 3.7 g 置于 A 中,加热前通入 N2 以驱尽装置内的空气,其目的是
________________________________________________________________________
________________________________________________________________________;
关闭 k,用酒精灯加热时,正确操作是先____________,然后固定在管中固体部位下加热。
③观察到 A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为 1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量,经分析可初步确认猜想________是正确的。
②根据 D 中无明显现象,一位同学认为不能确认分解产物中有 O2,因为若有 O2,D 中将发
生 氧 化 还 原 反 应 :
________________________________________________________________________
________________________________________________________________________
(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有 O2 存在,未检测到的
原因是________________________________________________________________________
________________________________________________________________________。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
25.[答案] (1)不符合氧化还原反应原理(或其他合理答案)
(2)①装置气密性良好
②避免对产物 O2 的检验产生干扰(或其他合理答案) 移动酒精灯预热硬质玻璃管
(3)①乙
②2Na2SO3+O2===2Na2SO4 O2 在通过装置 B 时已参与反应(或其他合理答案)
[解析] (1)若 Mg(NO3)2 热分解产物为 MgO、NO2、N2,氮元素化合价部分由+5 价降为+4
价,另一部分由+5 价降为 0 价,元素的化合价只降不升,不符合氧化还原反应原理,故猜想
丁不成立;(2)①整套装置所含仪器连接后,放入固体试剂之前,关闭 k,微热硬质玻璃试管(A),
观察到 E 中有气泡连续放出,表明装置气密性良好;②猜想甲、乙、丙中均有 O2,通常条件
下氮气的性质很稳定,则加热前通入 N2 驱尽装置内空气的目的是避免空气对产物 O2 的检验产
生干扰;加热试管中固体时要预热,正确的操作方法是移动酒精灯预热硬质玻璃管,然后固
定在有固体部位下加热;(3)①A 中有红棕色气体,说明硝酸镁热分解产物中含有 NO2;剩余固
体中加入适量水,未见明显现象,说明硝酸镁热分解产物中不含亚硝酸镁,也不含氮化镁,
因为 Mg(NO2)2 可溶于水,Mg3N2 与水发生双水解反应,生成白色沉淀和刺激性气味的气体,由
此推断猜想乙成立;②氧气具有氧化性,亚硫酸钠具有还原性,二者发生氧化还原反应,生
成硫酸钠,配平可得:2Na2SO3+O2===2Na2SO4;实验时二氧化氮与氢氧化钠溶液反应可能存在
过量问题,若氢氧化钠不足,则 B 中不仅发生了反应 2NO2+2NaOH===NaNO3+NaNO2+H2O,而且
可能发生如下反应:3NO2+H2O===2HNO3+NO、2NO+O2===2NO2,即 O2 在通过装置 B 时已经参与
反应,导致硝酸镁热分解产生的氧气在 D 之前已经被消耗完全。
24.J2 H5 D2 B3 B4
[2013·福建卷] 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产 ClO2 方法。
①用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO 2-
4 等杂质。某次除杂操作时,往粗盐
水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的 Na2CO3 和 NaOH,
充 分 反 应 后 将 沉 淀 一 并 滤 去 。 经 检 测 发 现 滤 液 中 仍 含 有 一 定 量 的 SO 2-
4 , 其 原 因 是
________________________________________________________________________
________________________________________________________________________
[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9]。
②该法工艺原理示意图如下。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)
与盐酸反应生成 ClO2。工艺中可以利用的单质有________(填化学式),发生器中生成 ClO2 的
化 学 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
图 0
(2)纤维素还原法制 ClO2 是一种新方法,其原理是:纤维素水解得到的最终产物 D 与 NaClO3
反应生成 ClO2。完成反应的化学方程式:K(D)+24NaClO3+12H2SO4===KClO2↑+KCO2↑+
18H2O+K________
(3)ClO2 和 Cl2 均能将电镀废水中的 CN-氧化为无毒的物质,自身被还原为 Cl-。处理含 CN
-相同量的电镀废水,所需 Cl2 的物质的量是 ClO2 的________倍。
24.[答案] (1)①BaCl2 BaSO4 和 BaCO3 的 Ksp 相差不大,当溶液中存在大量 CO 2-
3 时,BaSO4(s)
会部分转化为 BaCO3(s)(或其他合理答案)
②H2、Cl2 2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
(2) 1 C6H12O6+24NaClO3+12H2SO4=== 24 ClO2↑+ 6 CO2↑+18H2O+ 12 Na2SO4
(3)2.5
[解析] (1)①根据后加入的除杂试剂逆推,加入过量 Na2CO3 的目的是除去粗盐溶液中的
Ca2+,加入过量 NaOH 的目的是除去粗盐溶液中的 Mg2+,加入除杂试剂的目的是除去粗盐溶液
中的 SO2-
4 ,除杂质时引入的新杂质需要后续步骤除去,因此应先加入过量的 BaCl2;BaSO4 和
BaCO3 的 Ksp 相差不大,当溶液中存在大量 CO 2-
3 时,使 BaSO4(s)+CO2-
3 BaCO3(s)+SO 2-
4 的平
衡右移,BaSO4(s)会部分转化为 BaCO3(s),所以滤液中仍含有 SO2-
4 ;②由图中补充 Cl2 推断,
氯化氢合成塔中反应为 H2+Cl2=====点燃2HCl,则该工艺流程中可以利用的单质是 H2、Cl2;二氧化
氯发生器中反应物为氯化钠、电解池中得到的 NaClO3 和氯化氢合成塔中得到的 HCl,生成物为
ClO2,可通入氯化氢合成塔中循环利用的 Cl2,可通入氯化钠电解槽中循环利用的 NaCl 和 H2O,
根据氯元素优先变为相邻价态可得,氯酸钠被还原为二氧化氯,氯化氢被氧化为氯气,配平
可得:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O;(2)纤维素是多糖,其水解的最终产物
是葡萄糖(C6H12O6),所含氢为+1 价、氧为-2 价,由葡萄糖中各元素化合价代数和为零可得
碳的平均化合价为 0 价,配平可得:C6H12O6+24NaClO3+12H2SO4===24ClO2↑+6CO2↑+18H2O+
12Na2SO4;(3)设处理含 CN-相同量的电镀废水时转移电子的物质的量均为 x mol,根据化合价
降低总数等于转移电子数可得关系式:①ClO2→Cl-~5e-,②Cl2→2Cl-~2e-,①②式中氧化
剂与转移电子数的物质的量之比等于化学计量数之比,则 n(ClO2)=x mol×1
5
=0.2x mol,n(Cl2)
=x mol×1
2
=0.5x mol,所以 n(Cl2)
n(ClO2)
=0.5
0.2
=2.5。
10.J1 J2 [2013·福建卷] 下列有关实验的做法不正确的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制 0.100 0 mol·L-1 氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验 NH +
4 时,往试样中加入 NaOH 溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气
体
10.D [解析] 分液时,分液漏斗中的下层液体先从下口放出,上层液体从上口倒出,A
项正确;碳酸氢钠受热易分解,生成二氧化碳、水和碳酸钠固体,而碳酸钠固体受热不分解,
B 项正确;配制 0.100 0 mol·L-1 氯化钠溶液时,需要玻璃棒将液体引流转移到容量瓶中,C
项正确;检验 NH +
4 时,往试样中加入 NaOH 溶液,微热,用湿润的红色石蕊试纸检验逸出的气
体,若试纸变蓝,说明试样中含有铵根离子,D 项错误。
32.F4 D4 C2 C3 B1 B3 A4 B4 C4 J2
[2013·广东卷] 银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的
工艺如下:
图 0
[注:Al(OH)3 和 Cu(OH)2 开始分解的温度分别为 450 ℃和 80 ℃]
(1) 电 解 精 炼 银 时 , 阴 极 反 应 式 为
________________________________________________________________________;
滤渣 A 与稀 HNO3 反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方
程式为________________________________________________________________________
________________________________________________________________________。
(2)固体混合物 B 的组成为________;在生成固体 B 的过程中,需控制 NaOH 的加入量,
若 NaOH 过 量 , 则 因 过 量 引 起 的 反 应 的 离 子 方 程 式 为
________________________________________________________________________。
(3)完成煅烧过程中一个反应的化学方程式:
CuO+____Al2O3=====高温____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为 63.5%,理论上 5.0 kg 废料中的铜可完全转化为
________mol CuAlO2,至少需要 1.0 mol·L-1 的 Al2(SO4)3 溶液________L。
(5)CuSO4 溶 液 也 可 用 于 制 备 胆 矾 , 其 基 本 操 作 是
________________________________________________________________________
____________、过滤、洗涤和干燥。
32.[答案] (1)Ag++e-===Ag 2NO+O2===2NO2
(2)Al(OH)3 和 CuO Al(OH)3+OH-===AlO-
2 +2H2O
(3)4CuO+2Al2O3=====高温4CuAlO2+O2↑
(4)50 25
(5)蒸发浓缩,冷却结晶
[解析] (1)电解精炼银与电解精炼铜类似,纯银作阴极,粗银作阳极,硝酸银溶液作电
解液,阳极主要反应式为 Ag-e-===Ag+,阴极反应式为 Ag++e-===Ag;银是金属活动顺序表
中氢后金属,不溶于稀硫酸,因为稀硫酸是非氧化性酸,则滤渣 A 的主要成分是 Ag,稀硝酸
是氧化性酸,能溶解银,即 3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O,产生的无色气体一氧化氮
在空气中迅速被氧化为红棕色的二氧化氮气体,即 2NO+O2===2NO2;(2)CuAlO2 中氧为-2 价,
铝为+3 价,则铜为+1 价,其化学式也可以写为 Cu2O·Al2O3,相当于氧化亚铜和氧化铝按物
质的量之比为 1∶1 熔合在一起,由此逆推,固体 B 的主要成分是物质的量之比为 1∶1 的
Al(OH)3 和 CuO,因为 Cu(OH)2 开始分解的温度为 80 ℃,水的沸点大于 80 ℃,则煮沸前后发
生的反应为 Al3++3OH-=== Al(OH)3↓、Cu2++2OH-===Cu(OH)2↓、Cu(OH)2 =====80 ℃CuO+H2O,Al(OH)3
开始分解的温度为 450 ℃,在惰性气体中锻烧时发生的反应为 2Al(OH)3 =====450 ℃Al2O3+3H2O、
4CuO =====450 ℃2Cu2O+O2↑;氢氧化铝是两性氢氧化物,NaOH 是强碱,过量的 NaOH 能溶解部分或
全部氢氧化铝,其离子方程式为 Al(OH)3+OH-===AlO-
2 +2H2O,这必将导致目标产物产量的减
少;(3)根据氧化还原反应的特征推断,铜元素由+2 价降为+1 价,铝元素化合价不变,由
此推断反应前后升价元素一定是氧,且化合价由-2 价升为相邻的 0 价,即缺少的生成物为氧
气;根据化合价升降法配平可得:4CuO+2Al2O3=====高温4CuAlO2+O2↑;(4)5.0 kg=5.0×103 g,
银铜合金废料中铜的质量为 5.0×103 g×63.5%,由m
M
=n 可知 n(Cu)为 5.0×103 g×63.5%÷
63.5 g/mol=50 mol,根据铜守恒则有关系式:Cu~CuAlO2,则铜完全转化可以变为 50 mol
CuAlO2;根据铝守恒则有关系式:Al2(SO4)3~2CuAlO2,则至少需要 25 mol Al2(SO4)3;由 V=n
V
可求至少需要 V[Al2(SO4)3]=25 mol÷1.0 mol/L=25 L;(5)胆矾是硫酸铜溶液结晶析出的结
晶水合物 CuSO4·5H2O,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、
洗涤和干燥。
28.J1 J2 J3 J4 J5
[2013·全国卷] 制备氮化镁的装置示意图如下:
图 0
回答下列问题:
(1) 检 查 装 置 气 密 性 的 方 法 是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________,
a 的名称是____________,b 的名称是____________。
(2) 写 出 NaNO2 和 (NH4)2SO4 反 应 制 备 氮 气 的 化 学 方 程 式
________________________________________________________________________。
(3)C 的作用是____________________,D 的作用是______________,是否可以把 C 与 D
的 位 置 对 调 并 说 明 理 由
________________________________________________________________________________
________________________________________________________________________。
(4) 写 出 E 中 发 生 反 应 的 化 学 方 程 式
________________________________________________________________________
________________________________________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及
现象________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
28.[答案] (1)微热 b,这时 G 中有气泡冒出,停止加热冷却后,G 中插在溶液里的玻璃
管形成一段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2=====△ 2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg=====△ Mg3N2
(5)取少量产物于试管中,加少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把
润湿的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,
若观察到有气泡产生,则证明产物中含有未反应的镁
[解析] (1) 气密性检查的基本思路: 装置形成封闭体系→操作(微热、手捂、热毛巾捂、
加水等)→描述现象→得出结论。(2) (NH4)2 SO4 与 NaNO2 发生氧化还原反应生成 N2。(3)硫酸
亚铁能被氧气氧化,故其作用是除去氧气。 浓硫酸的作用是除去水蒸气,如果 CD 对换,则
可能从硫酸亚铁溶液中带出水蒸气,无法干燥。(4)氮气与镁反应生成 Mg3N2。(5) 检验氮化镁
可根据氮化镁与水反应的现象判断,氮化镁会与水反应生成 NH3 和 Mg(OH)2 沉淀,NH3 为碱性气
体,挥发出来,遇红色石蕊试纸后会使其变蓝。
10.J1 J2 [2013·全国卷] 下列操作不能达到目的的是( )
选项 目的 操作
A 配制 100 mL 1.0 mol·L-1 CuSO4 溶液 将 25 g CuSO4·5H2O 溶于 100 mL 蒸馏水
中
B 除去 KNO3 中少量 NaCl 将混合物制成热的饱和溶液,冷却结晶,
过滤
C 在溶液中将 MnO -
4 完全转化为 Mn2+ 向酸性 KMnO4 溶液中滴加 H2O2 溶液至紫色
消失
D 确定 NaCl 溶液中是否混有 Na2CO3
取少量溶液滴加 CaCl2 溶液,观察是否出
现白色沉淀
10.A [解析] 应将 25 g CuSO4·5H2O 配成 100 mL 溶液而不是溶于 100 mL 水中, A 项
错误;NaCl 的溶解度受温度的影响比较小,冷却结晶时 KNO3 大量析出,过滤可分离,B 项正
确;H2O2 具有还原性,可将紫色 MnO -
4 还原为无色的 Mn2+,C 项正确;利用 Ca2+与 CO 2-
3 结合生
成 CaCO3 白色沉淀的反应来判断 Na2CO3 是否存在, D 项正确。
11.J1 J2
[2013·山东卷] 利用实验器材(规格和数量不限)能完成相应实验的一项是( )
选项 实验器材(省略夹持装置) 相应实验
A 烧杯、玻璃棒、蒸发皿 CuSO4 溶液的浓缩结晶
B 烧杯、玻璃棒、胶头滴管、滤纸 用盐酸除去 BaSO4 中少量 BaCO3
C 烧杯、玻璃棒、胶头滴管、容量瓶 用固体 NaCl 配制 0.5 mol·L-1 的溶液
D 烧杯、玻璃棒、胶头滴管、分液漏斗 用溴水和 CCl4 除去 NaBr 溶液中少量 NaI
11.D [解析] CuSO4 溶液浓缩结晶需要加热,缺少酒精灯,A 项错误;用盐酸除去 BaSO4
中的 BaCO3,方法是将固体样品溶于盐酸中后过滤、洗涤,缺少组成过滤器的仪器——漏斗,
B 项错误;配制一定物质的量浓度的 NaCl 溶液,需要称取一定质量的 NaCl,缺少称量用的托
盘天平,C 项错误;除去 NaBr 溶液中少量的 NaI,只需将溴水加入含有少量 NaI 的 NaBr 溶液
充分反应后,再采取萃取操作即可,因此需要的仪器有烧杯、玻璃棒、胶头滴管、分液漏斗,
D 项正确。
4.J1 J2 [2013·重庆卷] 按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性
的天然产物。下列说法错误的是( )
图 0
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
4.C [解析] 样品粉末加入甲苯和甲醇后,形成的是固体和液体的混合物,步骤(1)得
到溶液和不溶性物质,应该采用过滤的方法,A 项正确;步骤(2)分离水层溶液和有机层溶液,
需要用到分液漏斗,B 项正确;步骤(3)从水层溶液得到固体粗产品,采用蒸发结晶的方法,
需要用到蒸发皿,C 项错误;步骤(4)从有机层溶液得到甲苯,应该采用蒸馏的方法,D 项正
确。
27.B3 C2 C3 J2
[2013·北京卷] 用含有 Al2O3、SiO2 和少量 FeO·xFe2O3 的铝灰制备 Al2(SO4)3·18H2O,工
艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀 H2SO4,过滤;
Ⅱ.向滤液中加入过量 KMnO4 溶液,调节溶液的 pH 约为 3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入 MnSO4 至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4 溶 解 Al2O3 的 离 子 方 程 式 是
________________________________________________________________________
________________________________________________________________________。
(2)将 MnO -
4 氧化 Fe2+的离子方程式补充完整:
1 MnO-
4 +KFe2++K________= 1 Mn2++KFe3++K________
(3)已知:
生成氢氧化物沉淀的 pH
Al(OH)3 Fe(OH)2 Fe(OH)3
开始沉淀时 3.4 6.3 1.5
完全沉淀时 4.7 8.3 2.8
注:金属离子的起始浓度为 0.1 mol·L-1
根 据 表 中 数 据 解 释 步 骤 Ⅱ 的 目 的 :
________________________________________________________________________
________________________________________________________________________。
(4)已知:一定条件下,MnO -
4 可与 Mn2+反应生成 MnO2。
① 向 Ⅲ 的 沉 淀 中 加 入 浓 盐 酸 并 加 热 , 能 说 明 沉 淀 中 存 在 MnO2 的 现 象 是
________________________________________________________________________。
② Ⅳ 中 加 入 MnSO4 的 目 的 是
________________________________________________________________________。
27.[答案] (1)Al2O3+6H+===2Al3++3H2O
(2)5 8H+ 5 4H2O
(3)pH 约为 3 时,Fe2+和 Al3+不能形成沉淀,将 Fe2+氧化为 Fe3+,可使铁完全沉淀
(4)①生成黄绿色气体
②除去过量的 MnO-
4
[解析] (2)首先根据化合价升降总数可知 Fe2+、Fe3+的化学计量数均为 5;然后根据电荷
守恒可知反应物中的缺项为 8H+;最后根据原子守恒可知生成物中的缺项为 4H2O。
(3)向滤液中加入过量 KMnO4 溶液是为了将 Fe2+氧化为 Fe3+,因为 pH 约为 3 时,Fe3+已经
完全沉淀,而 Al3+还未沉淀,从而达到使铁元素完全沉淀的目的。
(4)①加热 MnO2 和浓盐酸的混合物可产生黄绿色的氯气。②根据题给已知条件可知,Ⅳ中
加入 MnSO4 是为了将过量 MnO -
4 沉淀为 MnO2,从而达到除去过量 MnO -
4 的目的。
12.J2 I1 L1 [2013·北京卷] 用下图所示装置检验乙烯时不需要除杂的是( )
图 0
乙烯的制备 试剂 X 试剂 Y
A CH3CH2Br 与 NaOH 乙醇溶液共热 H2O KMnO4 酸性溶液
B CH3CH2Br 与 NaOH 乙醇溶液共热 H2O Br2 的 CCl4 溶液
C C2H5OH 与浓 H2SO4 加热至 170 ℃ NaOH 溶液 KMnO4 酸性溶液
D C2H5OH 与浓 H2SO4 加热至 170 ℃ NaOH 溶液 Br2 的 CCl4 溶液
12.B [解析] CH3CH2Br 与 NaOH 乙醇溶液共热制得的乙烯中混有挥发出来的乙醇,乙醇也
能使 KMnO4 酸性溶液褪色,但乙醇不能使 Br2 的 CCl4 溶液褪色,故 A 项应除杂,B 项无需除杂;
C2H5OH 与浓硫酸加热至 170 ℃制得的乙烯中混有杂质 CO2、SO2 及水蒸气等,SO2 能使 KMnO4 酸性
溶液褪色,C 项应除杂;因反应 SO2+Br2+H2O===H2SO4+2HBr 也能使 Br2 的 CCl4 溶液褪色,SO2
需除去,故 D 项应除杂。
8.B4 J2 [2013·北京卷] 下列解释事实的方程式不准确的是( )
A.用浓盐酸检验氨:NH3+HCl===NH4Cl
B.碳酸钠溶液显碱性:CO2-
3 +H2O HCO-
3 +OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2===CaCO3↓+H2O
8.C [解析] 钢铁发生吸氧腐蚀时,负极的电极反应式应为 Fe-2e-===Fe2+。
11.B2 J1 J2 N4
[2013·四川卷] 明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备 Al、K2SO4 和
H2SO4 的工艺过程如下所示:
图 0
焙烧明矾的化学方程式为 4KAl(SO4)2·12H2O+3S===2K2SO4+2Al2O3+9SO2↑+48H2O。
请回答下列问题。
(1)在焙烧明矾的反应中,还原剂是________。
(2) 从 水 浸 后 的 滤 液 中 得 到 K2SO4 晶 体 的 方 法 是
________________________________________________________________________
________________________________________________________________________。
(3)Al2O3 在一定条件下可制得 AlN,其晶体结构如图所示,该晶体中 Al 的配位数是
________。
图 0
(4)以 Al 和 NiO(OH)为电极,NaOH 溶液为电解液组成一种新型电池,放电时 NiO(OH)转化
为 Ni(OH)2 , 该 电 池 反 应 的 化 学 方 程 式 是
________________________________________________________________________。
(5)焙烧产生的 SO2 可用于制硫酸。已知 25 ℃、101 kPa 时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ/mol;
H2O(g)===H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ/mol。
则:
① SO3(g) 与 H2O(l) 反 应 的 热 化 学 方 程 式 是
________________________________________________________________________
________________________________________________________________________。
②焙烧 948 t 明矾(M=474 g/mol),若 SO2 的利用率为 96%,可生产质量分数为 98%的硫
酸________t。
11.[答案] (1)S(硫)
(2)蒸发结晶
(3)4
(4)Al+3NiO(OH)+NaOH+H2O===NaAlO2+3Ni(OH)2
(5)①SO3(g)+H2O(l)===H2SO4(l)
ΔH=-130 kJ/mol
②432
[解析] (1)结合明矾煅烧的方程式可知,S 的化合价升高,被氧化,作还原剂。(2)从溶
液中得到晶体的方法为蒸发浓缩、冷却结晶、过滤。(3)结合 AlN 的晶体图可推出处于晶胞体
心的 Al 与 4 个 N 直接相连,因此该晶体中 Al 的配位数为 4。(4)利用题中放电时信息可知 NiOOH
作正极(放电时发生还原反应),则 Al 作负极,因电解质溶液为 NaOH,则放电时 Al 极发生氧
化 反 应 生 成 NaAlO2 , 由 此 容 易 写 出 电 池 总 反 应 。 (5)① 首 先 写 出 该 反 应 为 SO3(g) +
H2O(l)===H2SO4(l),利用盖斯定律,将方程式进行叠加:③-①-②×2,则ΔH=-545 kJ/mol
-(-197 kJ/mol)-(-44 kJ/mol)×2=-260 kJ/mol;②结合题中给出煅烧明矾的方程式
可得关系式:4KAl(SO4)2·12H2O~9SO2~9H2SO4,可知 948 t 明矾可得到 98%的浓硫酸的质量为
948×106 g
474 g·mol-1×9
4
×96%×98 g·mol-1
98%
×10-6 g·t-1=432 t。
9.J2 J4 J5
[2013·四川卷] 为了探究 AgNO3 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3 的氧化性
将光亮的铁丝伸入 AgNO3 溶液中,一段时间后将铁丝取出。为检验溶液中 Fe 的氧化产物,
将溶液中的 Ag+除尽后,进行了如下实验。可选用的试剂:KSCN 溶液、K3[Fe(CN)6]溶液、氯
水。
(1)请完成下表:
操作 现象 结论
取少量除尽 Ag+后的溶液于试管中,加
入 KSCN 溶液,振荡 ____①____ 存在 Fe3+
取少量除尽 Ag+后的溶液于试管中,加
入____②____,振荡 ____③____ 存在 Fe2+
【实验结论】Fe 的氧化产物为 Fe2+和 Fe3+。
Ⅱ.AgNO3 的热稳定性
用下图所示的实验装置 A 加热 AgNO3 固体,产生红棕色气体,在装置 D 中收集到无色气
体。当反应结束后,试管中残留固体为黑色。
图 0
(2) 装 置 B 的 作 用 是
________________________________________________________________________。
(3) 经 小 组 讨 论 并 验 证 该 无 色 气 体 为 O2 , 其 验 证 方 法 是
________________________________________________________________________
________________________________________________________________________。
(4)【查阅资料】Ag2O 和粉末状的 Ag 均为黑色;Ag2O 可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag 和 Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实
验。
实验编号 操作 现象
a 加入足量氨水,振荡 黑色固体不溶解
b 加入足量稀硝酸,振荡 黑色固体溶解,并有气体产生
【实验评价】根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出 AgNO3 固体热分解的产物有________。
9.[答案] (1)①溶液呈红色 ②K3[Fe(CN)6]溶液
③产生蓝色沉淀
(2)防倒吸
(3)用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为 O2
(4)①b ②Ag、NO2、O2
[解析] (1)Fe3+与 KSCN 溶液混合生成 Fe(SCN)3 血红色溶液,Fe2+与 K3[Fe(CN)6]溶液反应
生成蓝色沉淀,故看到溶液变为血红色,说明含有 Fe3+,若加入 K3[Fe(CN)6]溶液,看到有蓝
色沉淀,说明溶液中含有 Fe2+。(2)装置 B 连接反应装置 A 和除杂装置 C,为防止 C 装置中的
水进入加热的试管,所以 B 装置起到安全瓶作用,防倒吸。(3)氧气可使带火星的木条复燃,
据此可进行实验设计。(4)结合题干【查阅资料】提供的信息知,氨水能溶解 Ag2O,因此实验
a 可确定产物只含 Ag;Ag2O、Ag 均可溶于稀硝酸,但只有 Ag 与稀硝酸发生氧化还原反应放出
气体,故实验 b 只能确定含有 Ag,不能判断是否含有 Ag2O。
8.J2 L2 M2
[2013·浙江卷] 下列说法正确的是( )
A.实验室从海带提取单质碘的方法是取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓 H2SO4 制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接存放在铝制容器
中
D.将(NH4)2SO4、CuSO4 溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变
性
8.C [解析] 从海带中提取碘,需要将 I-氧化,缺少此步操作,A 项错误;用乙醇和浓
硫酸制乙烯时,需加热到 170 ℃,水浴加热达不到这一温度要求,B 项错误;氯离子存在时
会破坏铝表面的氧化膜,加速铝的腐蚀,C 项正确; (NH4)2SO4 使蛋白质发生盐析,而非变性,
D 项错误。
26.J1 J2 J5
[2013·新课标全国卷Ⅰ] 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实
验装置如下:
OH ――→浓 H2SO4
△ +H2O
图 0
可能用到的有关数据如下:
相对分子质量 密度/(g·cm-3) 沸点/℃ 溶解性
环己醇 100 0.961 8 161 微溶于水
环己烯 82 0.810 2 83 难溶于水
合成反应:
在 a 中加入 20 g 环己醇和 2 小片碎瓷片,冷却搅动下慢慢加入 1 mL 浓硫酸。b 中通入冷
却水后,开始缓慢加热 a,控制馏出物的温度不超过 90 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,分别用少量 5%碳酸钠溶液和水洗涤,分离后加入无水氯
化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净的环己烯 10 g。
回答下列问题:
(1)装置 b 的名称是________。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正
确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏
斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50%
C.61% D.70%
26.[答案] (1)直形冷凝管
(2)防止暴沸 B
(3)O
(4)检漏 上口倒出
(5)干燥(或除水除醇)
(6)C D (7)C
[解析] (1)冷凝管有直形冷凝管、空气冷凝管、球形冷凝管和蛇形冷凝管。根据形状进
行识别,可知装置 b 的名称为直形冷凝管。
(2)碎瓷片具有防止暴沸的作用;在加热开始后发现没加沸石,应停止加热,待稍冷却后
再加入沸石,否则易发生爆炸。
(3)醇在浓硫酸、加热条件下可发生分子内消去生成烯或分子间脱水生成醚,另一副产物
为分子间脱水生成的 O。
(4)分液漏斗使用前有两处需检漏,分别为上口及旋塞处;环己烯密度小于水,分液后应
从上口倒出。
(5)无水氯化钙具有干燥作用(或除水除醇)。
(6)观察蒸馏装置,可知不需要的仪器有吸滤瓶、球形冷凝管。
(7)环己烯的产率=10 g÷
20 g× 82
100 ×100%=61%。
13.J2 [2013·新课标全国卷Ⅰ] 下列实验中,所采取的分离方法与对应原理都正确的
是( )
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去 KNO3 固体中混杂的 NaCl 重结晶 NaCl 在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
13.D [解析] 乙醇与水互溶,不能萃取水中的碘,A 项错误;乙酸乙酯与乙醇互溶,无
分层现象,无法进行分液,B 项错误;利用 KNO3 的溶解度随温度变化较大,用重结晶法分离出
氯化钠,而非因氯化钠在水中的溶解度很大,C 项错误;乙醚与丁醇的沸点相差较大,进行蒸
馏分离,D 项正确。
27.C5 J1 J2
[2013·新课标全国卷Ⅱ] 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工
业级氧化锌[含有 Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业 ZnO ――→稀硫酸
① 浸出液 ――→调 pH 约为 5适量高锰酸钾溶液
② ――→过滤 滤液――→Zn
③ ――→过滤 滤液――→Na2CO3
④ ――→过滤 滤饼
――→煅烧
⑤ ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是 MnO2。
回答下列问题:
(1) 反 应 ② 中 除 掉 的 杂 质 离 子 是 ________ , 发 生 反 应 的 离 子 方 程 式 为
________________________________________________________________________;
在 加 高 锰 酸 钾 溶 液 前 , 若 pH 较 低 , 对 除 杂 的 影 响 是
________________________________________________________________________
________________________________________________________________________。
(2)反应③的反应类型为________ ,过滤得到的滤渣中,除了过量的锌外还有________。
(3) 反 应 ④ 形 成 的 沉 淀 要 用 水 洗 , 检 验 沉 淀 是 否 洗 涤 干 净 的 方 法 是
________________________________________________________________________
________________________________________________________________________。
(4)反应④中产物的成分可能是 ZnCO3·xZn(OH)2。取干燥后的滤饼 11.2 g,煅烧后可得
到产品 8.1 g,则 x 等于________。
27.[答案] (1)Fe2+和 Mn2+ MnO-
4 +3Fe2++7H2O===3Fe(OH)3↓+MnO2↓+5H+,2MnO-
4 +3Mn2
++2H2O===5MnO2↓+4H+ 铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
(2)置换反应 镍
(3)取少量水洗液于试管中,滴入 1~2 滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生
成,则说明沉淀已经洗涤干净
(4)1
[解析] (1)反应②加入强氧化剂,能将还原剂离子氧化至高价态,信息明确 Ni2+不被氧
化,即是 Fe2+和 Mn2+被氧化除去;结合信息,欲除去该离子,被氧化后的高价离子应生成对
应的沉淀物,据氧化还原反应方程式的配平原理配平即可;若酸性较强,生成的沉淀将会发
生溶解。(2)反应③是 Zn 将 Ni2+置换出来,那么滤渣成分是过量锌与产物镍。(3)分析流程图
可知反应④沉淀上吸附有杂质 SO2-
4 ,因此,检验沉淀是否洗涤干净的方法是:取最后一次洗涤
液,滴加硝酸酸化,再加入 Ba(NO3)2 溶液看是否有沉淀生成。(4)生成 ZnO 的质量为 8.1 g,
n(ZnO) = 8.1 g
81 g·mol-1 = 0.1 mol , 则 n(Zn) = 0.1 mol , 据 Zn 守 恒 , 有
11.2 g
125 g·mol-1+99 g·mol-1·x
(1+x)=0.1 mol,解得 x=1。
J3 气体的制取
8.J3 [2013·安徽卷] 实验室中某些气体的制取、收集及尾气处理装置如图 0 所示(省
略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
图 0
选项 a 中的物质 b 中的物质 c 中收集的气体 d 中的物质
A 浓氨水 CaO NH3 H2O
B 浓硫酸 Na2SO3 SO2 NaOH 溶液
C 稀硝酸 Cu NO2 H2O
D 浓盐酸 MnO2 Cl2 NaOH 溶液
8.B [解析] NH3 的密度小于空气,收集时需用向下排空气法,即 c 中导管应是“短进长
出”,A 项错误;SO2 的密度大于空气,收集时需用向上排空气法,即 c 中导管应是“长进短
出”,尾气可用碱液吸收,B 项正确;制取 NO2 需选用 Cu 与浓硝酸反应,C 项错误;采用浓盐
酸与 MnO2 制取氯气时需要加热,D 项错误。
33.J3 J1 D2 J4 J5 F3 F5 C5
[2013·广东卷] 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,
提升科学素养。
(1)在实验室中用浓盐酸与 MnO2 共热制取 Cl2 并进行相关实验。
①下列收集 Cl2 的正确装置是________。
A B C D
图 0
②将 Cl2 通入水中,所得溶液中具有氧化性的含氯粒子是________。
③设计实验比较 Cl2 和 Br2 的氧化性,操作与现象是:取少量新制氯水和 CCl4 于试管中,
________________________________________________________________________
________________________________________________________________________。
(2)能量之间可以相互转化:电解食盐水制备 Cl2 是将电能转化为化学能,而原电池可将
化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq)、FeSO4(aq)、CuSO4(aq);铜片、铁片、锌片和导线。
①完成原电池甲的装置示意图(见图 0),并作相应标注。
图 0
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一
段 时 间 后 , 可 观 察 到 负 极
________________________________________________________________________________
。
③甲 乙两 种原 电 池中 可更 有 效地 将 化学 能转 化 为电 能的 是 ________ ,其 原因 是
________________________________________________________________________。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中
应选________作阳极。
33.[答案] (1)①C
②HClO、Cl2、ClO-
③向试管中滴加 NaBr 溶液,振荡、静置。试管中液体分层,上层接近无色,下层为橙红
色
(2)①
②电极逐渐溶解
③甲 可以避免 Zn 与 Cu2+的接触,提高电池效率,提供稳定电流
(3)Zn
[解析] (1)①集气瓶中使用单孔橡胶塞,则瓶内气体压强增大到一定程度会发生爆炸等,
A 项错误;倒立的集气瓶中有双孔橡胶塞,由于氯气的密度比空气大,氯气从长导气管中进,
从短导气管中逸出,因此不能排出空气收集氯气,B 项错误;正立的集气瓶中有双孔橡胶塞,
氯气从长导管中进,空气从短导管排出,排出的气体通过倒扣漏斗、NaOH 溶液吸收处理,既
防止倒吸又防止排出氯气污染空气,C 项正确;氯气与 NaOH 溶液反应 Cl2+2NaOH===NaClO+
NaCl+H2O,因此不能用排 NaOH 溶液的方法收集氯气,D 项错误;②氯气与水发生可逆反应 Cl2
+H2O H++Cl-+HClO,所得氯水中含 H2O、Cl2、H+、Cl-、HClO、ClO-、OH-等离子,其中
具有强氧化性的含氯粒子是 Cl2、HClO、ClO-;(2)①带盐桥的原电池甲可以设计锌铜原电池(或
铁铜原电池、锌铁原电池),由于外电路中电子从左移向右,说明左边烧杯中电极的金属性较
强,则左、右两边烧杯中电极材料及电解质溶液可以为锌片和硫酸锌溶液、铜片和硫酸铜溶
液(或者铁片和硫酸亚铁溶液、铜片和硫酸铜溶液,锌片和硫酸锌溶液、铁片和硫酸亚铁溶液);
②金属活动性 Zn>Fe>Cu,则原电池乙中铜片作正极,锌片或铁片作负极,工作一段时间后,
负极金属锌或铁被氧化,质量减轻,溶液中蓝色变浅;③甲、乙两种原电池都能将化学能转
化为电能,其中带有盐桥的原电池甲中的负极金属锌(或铁)和硫酸铜没有直接接触,二者不
会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极
金属锌(或铁)和硫酸铜直接接触发生置换反应,部分化学能会转化为热能,化学能不能全部
转化为电能;(3)铁片作正极(阴极)时被保护,而铁作负极(阳极)时被腐蚀,为了减缓电解质
溶液中铁片的腐蚀,在(2)的材料中应选择比铁活泼的锌片作负极(阳极),使铁片作正极(阴
极),从而牺牲锌片保护铁片;不能选择铜片,因为铜作正极(阴极),而铁片作负极(阳极),
此时铁片的腐蚀速率加快,而不是延缓。
28.J1 J2 J3 J4 J5
[2013·全国卷] 制备氮化镁的装置示意图如下:
图 0
回答下列问题:
(1) 检 查 装 置 气 密 性 的 方 法 是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________,
a 的名称是____________,b 的名称是____________。
(2) 写 出 NaNO2 和 (NH4)2SO4 反 应 制 备 氮 气 的 化 学 方 程 式
________________________________________________________________________。
(3)C 的作用是____________________,D 的作用是______________,是否可以把 C 与 D
的 位 置 对 调 并 说 明 理 由
________________________________________________________________________________
________________________________________________________________________。
(4) 写 出 E 中 发 生 反 应 的 化 学 方 程 式
________________________________________________________________________
________________________________________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及
现象________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
28.[答案] (1)微热 b,这时 G 中有气泡冒出,停止加热冷却后,G 中插在溶液里的玻璃
管形成一段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2=====△ 2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg=====△ Mg3N2
(5)取少量产物于试管中,加少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把
润湿的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,
若观察到有气泡产生,则证明产物中含有未反应的镁
[解析] (1) 气密性检查的基本思路: 装置形成封闭体系→操作(微热、手捂、热毛巾捂、
加水等)→描述现象→得出结论。(2) (NH4)2 SO4 与 NaNO2 发生氧化还原反应生成 N2。(3)硫酸
亚铁能被氧气氧化,故其作用是除去氧气。 浓硫酸的作用是除去水蒸气,如果 CD 对换,则
可能从硫酸亚铁溶液中带出水蒸气,无法干燥。(4)氮气与镁反应生成 Mg3N2。(5) 检验氮化镁
可根据氮化镁与水反应的现象判断,氮化镁会与水反应生成 NH3 和 Mg(OH)2 沉淀,NH3 为碱性气
体,挥发出来,遇红色石蕊试纸后会使其变蓝。
J4 综合实验(实验方案的设计与评价)
19.J4
[2013·江苏卷] 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)
通过下列反应制备:
FeSO4+Na2CO3===FeCO3↓+Na2SO4
FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的 pH(开始沉淀的 pH 按金属离子浓度为 1.0
mol·L-1 计算)。
金属离子 开始沉淀的 pH 沉淀完全的 pH
Fe3+ 1.1 3.2
Al3+ 3.0 5.0
Fe2+ 5.8 8.8
(1)制备 FeCO3 时,选用的加料方式是________(填字母),原因是____________。
a.将 FeSO4 溶液与 Na2CO3 溶液同时加入到反应容器中
b.将 FeSO4 溶液缓慢加入到盛有 Na2CO3 溶液的反应容器中
c.将 Na2CO3 溶液缓慢加入到盛有 FeSO4 溶液的反应容器中
(2) 生 成 的 FeCO3 沉 淀 需 经 充 分 洗 涤 , 检 验 洗 涤 是 否 完 全 的 方 法 是
________________________________________________________________________
________________________________________________________________________。
(3)将制得的 FeCO3 加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是________________。
② 反 应 结 束 后 , 无 需 过 滤 , 除 去 过 量 铁 粉 的 方 法 是
________________________________________________________________________
________________________________________________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶
体 。 分 离 过 程 中 加 入 无 水 乙 醇 的 目 的 是
________________________________________________________________________
________________________________________________________________________。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为 Fe2O3、SiO2、Al2O3)出发,先制备绿矾,
再合成柠檬酸亚铁。请结合图 0 的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备 FeSO4·7H2O
晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和 NaOH 溶液):向一定量烧渣中加入足量的稀
硫酸充分反应,____________,得到 FeSO4 溶液,__________,得到 FeSO4·7H2O 晶体。
图 0
19.[答案] (1)c 避免生成 Fe(OH)2 沉淀
(2)取最后一次的洗涤滤液 1~2 mL 于试管中,向其中滴加用盐酸酸化的 BaCl2 溶液,若
无白色沉淀产生,则表明已洗涤干净
(3)①防止+2 价的铁元素被氧化 ②加入适量柠檬酸让铁粉反应完全
(4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
(5)过滤,向反应液中加入足量的铁粉,充分搅拌后,滴加 NaOH 溶液调节反应液的 pH 约
为 5,过滤(或过滤,向滤液中滴加过量的 NaOH 溶液,过滤,充分洗涤固体,向固体中加入足
量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤) (滴加稀硫酸酸化,)加
热浓缩得到 60 ℃饱和溶液,冷却至 0 ℃结晶,过滤,少量冰水洗涤,低温干燥
[解析] (1)Na2CO3 溶液显碱性,若将 Fe2+加入时,会生成 Fe(OH)2 沉淀。所以应将 Na2CO3
溶液加入 FeSO4 溶液中。(2)由制备 FeCO3 的方程式知,沉淀表面会附有 Na2SO4,故只要检验洗
涤液中是否含有 SO2-
4 ,即可证明沉淀是否洗净。(3)①Fe2+在溶解过程中,易被氧化成 Fe3+,
加入铁粉可以使 Fe3+还原为 Fe2+。②过量的铁粉用柠檬酸溶解,可得更多产物柠檬酸亚铁。
(4)柠檬酸亚铁晶体在乙醇中的溶解量比在水中的小,故有利于其析出。(5)硫铁矿烧渣中加
入稀硫酸,SiO2 不溶,先过滤除去。含有的 Fe2O3 和 Al2O3 被溶解成 Fe3+和 Al3+,加入铁粉,可
以将 Fe3+还原为 Fe2+,以增加 FeSO4 的产量。然后调节 pH 为 5,除去 Al3+,此时溶液仅为 FeSO4。
从溶解度曲线知,在 60 ℃时 FeSO4 的溶解度最大,故将温度控制在 60 ℃时,可获得含量最
多的 FeSO4,降低温度到 0 ℃,可析出 FeSO4·7H2O 晶体。
28.G5 J4 [2013·安徽卷] 某酸性工业废水中含有 K2Cr2O7。光照下,草酸(H2C2O4)能将
其中的 Cr2O 2-
7 转化为 Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应
起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在 25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始
pH 和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 初始 pH 废水样品
体积/mL
草酸溶液
体积/mL
蒸馏水
体积/mL
① 4 60 10 30
② 5 60 10 30
③ 5 60
测得实验①和②溶液中的 Cr2O 2-
7 浓度随时间变化关系如图 0 所示。
图 0
(2)上述反应后草酸被氧化为________(填化学式)。
(3) 实 验 ① 和 ② 的 结 果 表 明
________________________________________________________________________;
实验①中 0~t1 时间段反应速率 v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成
假设二和假设三:
假设一:Fe2+起催化作用;
假 设 二 :
________________________________________________________________________;
假 设 三 :
________________________________________________________________________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有 K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、
Al2(SO4)3 等。溶液中 Cr2O 2-
7 的浓度可用仪器测定]
实验方案(不要求写具体操作过程) 预期实验结果和结论
28.[答案] (1)
实验编号 初始 pH 废水样品
体积/mL
草酸溶液
体积/mL
蒸馏水
体积/mL
③ 20 20
(2)CO2
(3)溶液 pH 对该反应的速率有影响 2(c0-c1)
t1
(4)Al3+起催化作用 SO 2-
4 起催化作用
(5)
实验方案(不要求写具体操作过程) 预期实验结果和结论
用等物质的量 K2SO4·Al2(SO4)3·24H2O 代替实
验①中的铁明矾,控制其他反应条件与实验
①相同,进行对比实验
反应进行相同时间后,若溶液中 c(Cr2O2-
7 )大
于实验①中的 c(Cr2O2-
7 ),则假设一成立;若
两溶液中的 c(Cr2O2-
7 )相同,则假设一不成立
(本题属于开放性试题,合理答案均可)
[解析] (1)三组实验加入废水的体积相同,为保证废水样品初始浓度相同,则应保证加
入草酸、蒸馏水后的反应液总体积都相等。为探究不同草酸浓度对反应的影响,实验③需改
变加入草酸溶液体积与蒸馏水的体积,参照实验①、②可知实验③加入草酸溶液体积与蒸馏
水的体积之和应是 40 mL。(2)草酸中碳元素为+3 价,因此草酸被氧化后生成 CO2。(3)实验
①、②只有反应的 pH 不同,故结合 c(Cr2O2-
7 )随时间的变化图示知溶液的 pH 对反应速率有影
响;v(Cr3+)=2v(Cr2O2-
7 )=2(c0-c1)
t1
。(4)铁明矾溶液中存在 Fe2+、Al3+、SO2-
4 ,均有可能起
催化作用,因此假设二、三分别假设 Al3+、SO 2-
4 具有催化作用。(5)可采用对比实验,采取逐
一验证其催化作用的离子,如用等物质的量明矾代替实验①中的铁明矾,控制其他实验条件
与实验①相同,通过看相同时间内 c(Cr2O2-
7 )的变化,从而得知假设一是否正确。
27.J2 J4 [2013·安徽卷] 二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏
生产过程中产生大量的废玻璃粉末(含 SiO2、Fe2O3、CeO2 以及其他少量可溶于稀酸的物质)。某
课题组以此粉末为原料回收铈,设计实验流程如下:
图 0
(1)洗涤滤渣 A 的目的是为了除去________(填离子符号),检验该离子是否洗净的方法是
________________________________________________________________________。
(2) 第 ② 步 反 应 的 离 子 方 程 式 是
________________________________________________________________________,
滤渣 B 的主要成分是________。
(3)萃取是分离稀土元素的常用方法,已知化合物 TBP 作为萃取剂能将铈离子从水溶液中
萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要
玻璃仪器有________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的 Ce(OH)4 产品 0.536 g,加硫酸溶解后,用 0.100 0 mol·L-1 FeSO4
标准溶液滴定至终点时(铈被还原为 Ce3+),消耗 25.00 mL 标准溶液。该产品中 Ce(OH)4 的质
量分数为________。
27.[答案] (1)Fe3+ 取最后一次洗涤液,加入 KSCN 溶液,若不出现红色,则已洗净;
反之,未洗净(其他合理答案均可)
(2)2CeO2+H2O2+6H+===2Ce3++O2↑+4H2O SiO2(其他合理答案均可)
(3)不能 分液漏斗
(4)97.0%
[解析] (1)由流程图可知,利用滤渣 A 最终可回收铈,故可推知滤渣 A 中含有 CeO2 和不
溶于盐酸的 SiO2,滤液 A 中的溶质则为 Fe2O3 与盐酸反应生成的 FeCl3,滤渣 A 是从 FeCl3 溶液
中过滤得到,故洗涤滤渣 A 的目的是除去表面沾附的 Fe3+;检验是否洗净可通过取最后一次
洗涤液,用 KSCN 溶液来检验洗涤液中是否含有 Fe3+。(2)第②步是在酸性条件下,CeO2 与 H2O2
发生氧化还原反应,CeO2 被还原为 Ce3+,则 H2O2 被氧化为 O2,故可写出反应的离子方程式;结
合(1)中分析可知滤渣 B 的主要成分是 SiO2。(3)由 TBP 可用作从水溶液中萃取铈离子的萃取
剂可知 TBP 不能与水互溶;萃取操作用到的仪器有分液漏斗、烧杯、玻璃棒、量筒等。(4)利
用电子守恒、原子守恒可得关系式:Ce(OH)4~Ce4+~Fe2+,由此可得 0.536 g 样品中含有
m[Ce(OH)4]=0.100 0 mol·L-1×0.025 L×208 g·mol-1=0.52 g,所以产品中 Ce(OH)4 的质
量分数为 0.52 g÷0.536 g×100%=97.0%。
25.J2 J1 J4 D3 D4
[2013·福建卷] 固体硝酸盐加热易分解且产物较复杂。某学习小组以 Mg (NO3)2 为研究对
象,拟通过实验探究其热分解的产物,提出如下 4 种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1) 实 验 前 , 小 组 成 员 经 讨 论 认 定 猜 想 丁 不 成 立 , 理 由 是
________________________________________________________________________________
。
查阅资料得知:2NO2+2NaOH===NaNO3+NaNO2+H2O。
针对甲、乙、丙猜想,设计如图 0 所示的实验装置(图中加热、夹持仪器等均省略):
图 0
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭 k,微热硬质玻璃管(A),观察到 E 中有气泡连
续 放 出 , 表 明
________________________________________________________________________
________________________________________________________________________。
②称取 Mg(NO3)2 固体 3.7 g 置于 A 中,加热前通入 N2 以驱尽装置内的空气,其目的是
________________________________________________________________________
________________________________________________________________________;
关闭 k,用酒精灯加热时,正确操作是先____________,然后固定在管中固体部位下加热。
③观察到 A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为 1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量,经分析可初步确认猜想________是正确的。
②根据 D 中无明显现象,一位同学认为不能确认分解产物中有 O2,因为若有 O2,D 中将发
生 氧 化 还 原 反 应 :
________________________________________________________________________
________________________________________________________________________
(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有 O2 存在,未检测到的
原因是________________________________________________________________________
________________________________________________________________________。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
25.[答案] (1)不符合氧化还原反应原理(或其他合理答案)
(2)①装置气密性良好
②避免对产物 O2 的检验产生干扰(或其他合理答案) 移动酒精灯预热硬质玻璃管
(3)①乙
②2Na2SO3+O2===2Na2SO4 O2 在通过装置 B 时已参与反应(或其他合理答案)
[解析] (1)若 Mg(NO3)2 热分解产物为 MgO、NO2、N2,氮元素化合价部分由+5 价降为+4
价,另一部分由+5 价降为 0 价,元素的化合价只降不升,不符合氧化还原反应原理,故猜想
丁不成立;(2)①整套装置所含仪器连接后,放入固体试剂之前,关闭 k,微热硬质玻璃试管(A),
观察到 E 中有气泡连续放出,表明装置气密性良好;②猜想甲、乙、丙中均有 O2,通常条件
下氮气的性质很稳定,则加热前通入 N2 驱尽装置内空气的目的是避免空气对产物 O2 的检验产
生干扰;加热试管中固体时要预热,正确的操作方法是移动酒精灯预热硬质玻璃管,然后固
定在有固体部位下加热;(3)①A 中有红棕色气体,说明硝酸镁热分解产物中含有 NO2;剩余固
体中加入适量水,未见明显现象,说明硝酸镁热分解产物中不含亚硝酸镁,也不含氮化镁,
因为 Mg(NO2)2 可溶于水,Mg3N2 与水发生双水解反应,生成白色沉淀和刺激性气味的气体,由
此推断猜想乙成立;②氧气具有氧化性,亚硫酸钠具有还原性,二者发生氧化还原反应,生
成硫酸钠,配平可得:2Na2SO3+O2===2Na2SO4;实验时二氧化氮与氢氧化钠溶液反应可能存在
过量问题,若氢氧化钠不足,则 B 中不仅发生了反应 2NO2+2NaOH===NaNO3+NaNO2+H2O,而且
可能发生如下反应:3NO2+H2O===2HNO3+NO、2NO+O2===2NO2,即 O2 在通过装置 B 时已经参与
反应,导致硝酸镁热分解产生的氧气在 D 之前已经被消耗完全。
33.J3 J1 D2 J4 J5 F3 F5 C5
[2013·广东卷] 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,
提升科学素养。
(1)在实验室中用浓盐酸与 MnO2 共热制取 Cl2 并进行相关实验。
①下列收集 Cl2 的正确装置是________。
A B C D
图 0
②将 Cl2 通入水中,所得溶液中具有氧化性的含氯粒子是________。
③设计实验比较 Cl2 和 Br2 的氧化性,操作与现象是:取少量新制氯水和 CCl4 于试管中,
________________________________________________________________________
________________________________________________________________________。
(2)能量之间可以相互转化:电解食盐水制备 Cl2 是将电能转化为化学能,而原电池可将
化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq)、FeSO4(aq)、CuSO4(aq);铜片、铁片、锌片和导线。
①完成原电池甲的装置示意图(见图 0),并作相应标注。
图 0
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一
段 时 间 后 , 可 观 察 到 负 极
________________________________________________________________________________
。
③甲 乙两 种原 电 池中 可更 有 效地 将 化学 能转 化 为电 能的 是 ________ ,其 原因 是
________________________________________________________________________。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中
应选________作阳极。
33.[答案] (1)①C
②HClO、Cl2、ClO-
③向试管中滴加 NaBr 溶液,振荡、静置。试管中液体分层,上层接近无色,下层为橙红
色
(2)①
②电极逐渐溶解
③甲 可以避免 Zn 与 Cu2+的接触,提高电池效率,提供稳定电流
(3)Zn
[解析] (1)①集气瓶中使用单孔橡胶塞,则瓶内气体压强增大到一定程度会发生爆炸等,
A 项错误;倒立的集气瓶中有双孔橡胶塞,由于氯气的密度比空气大,氯气从长导气管中进,
从短导气管中逸出,因此不能排出空气收集氯气,B 项错误;正立的集气瓶中有双孔橡胶塞,
氯气从长导管中进,空气从短导管排出,排出的气体通过倒扣漏斗、NaOH 溶液吸收处理,既
防止倒吸又防止排出氯气污染空气,C 项正确;氯气与 NaOH 溶液反应 Cl2+2NaOH===NaClO+
NaCl+H2O,因此不能用排 NaOH 溶液的方法收集氯气,D 项错误;②氯气与水发生可逆反应 Cl2
+H2O H++Cl-+HClO,所得氯水中含 H2O、Cl2、H+、Cl-、HClO、ClO-、OH-等离子,其中
具有强氧化性的含氯粒子是 Cl2、HClO、ClO-;(2)①带盐桥的原电池甲可以设计锌铜原电池(或
铁铜原电池、锌铁原电池),由于外电路中电子从左移向右,说明左边烧杯中电极的金属性较
强,则左、右两边烧杯中电极材料及电解质溶液可以为锌片和硫酸锌溶液、铜片和硫酸铜溶
液(或者铁片和硫酸亚铁溶液、铜片和硫酸铜溶液,锌片和硫酸锌溶液、铁片和硫酸亚铁溶液);
②金属活动性 Zn>Fe>Cu,则原电池乙中铜片作正极,锌片或铁片作负极,工作一段时间后,
负极金属锌或铁被氧化,质量减轻,溶液中蓝色变浅;③甲、乙两种原电池都能将化学能转
化为电能,其中带有盐桥的原电池甲中的负极金属锌(或铁)和硫酸铜没有直接接触,二者不
会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极
金属锌(或铁)和硫酸铜直接接触发生置换反应,部分化学能会转化为热能,化学能不能全部
转化为电能;(3)铁片作正极(阴极)时被保护,而铁作负极(阳极)时被腐蚀,为了减缓电解质
溶液中铁片的腐蚀,在(2)的材料中应选择比铁活泼的锌片作负极(阳极),使铁片作正极(阴
极),从而牺牲锌片保护铁片;不能选择铜片,因为铜作正极(阴极),而铁片作负极(阳极),
此时铁片的腐蚀速率加快,而不是延缓。
23.J4 D3 D4 I2 C3
[2013·广东卷] 下列实验的现象与对应结论均正确的是( )
选项 操作 现象 结论
A 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸有脱水性和强氧化性
B 常温下将 Al 片放入浓硝酸中 无明显现象 Al 与浓硝酸不反应
C 将一小块 Na 放入无水乙醇中 产生气泡 Na 能置换出醇羟基中的氢
D 将水蒸气通过灼热的铁粉 粉末变红 铁与水在高温下发生反应
23.AC [解析] 浓硫酸具有脱水性,能使蔗糖脱水炭化而变黑,生成单质碳和水,浓硫
酸和水混合时放出大量的热量,单质碳与浓硫酸发生氧化还原反应,生成二氧化碳和二氧化
硫气体,使黑色固体体积膨胀,说明浓硫酸具有脱水性和强氧化性,A 项正确;常温下浓硝酸
能使铝钝化,表面生成一层致密的保护膜,阻止内层金属与酸的反应,钝化是化学变化, B
项错误;金属钠置换了乙醇羟基中的氢,生成氢气和乙醇钠,C 项正确;黑色的铁粉高温下与
水蒸气发生置换反应,生成黑色四氧化三铁固体和氢气,D 项错误。
28.J1 J2 J3 J4 J5
[2013·全国卷] 制备氮化镁的装置示意图如下:
图 0
回答下列问题:
(1) 检 查 装 置 气 密 性 的 方 法 是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________,
a 的名称是____________,b 的名称是____________。
(2) 写 出 NaNO2 和 (NH4)2SO4 反 应 制 备 氮 气 的 化 学 方 程 式
________________________________________________________________________。
(3)C 的作用是____________________,D 的作用是______________,是否可以把 C 与 D
的 位 置 对 调 并 说 明 理 由
________________________________________________________________________________
________________________________________________________________________。
(4) 写 出 E 中 发 生 反 应 的 化 学 方 程 式
________________________________________________________________________
________________________________________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及
现象________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
28.[答案] (1)微热 b,这时 G 中有气泡冒出,停止加热冷却后,G 中插在溶液里的玻璃
管形成一段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2=====△ 2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg=====△ Mg3N2
(5)取少量产物于试管中,加少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把
润湿的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,
若观察到有气泡产生,则证明产物中含有未反应的镁
[解析] (1) 气密性检查的基本思路: 装置形成封闭体系→操作(微热、手捂、热毛巾捂、
加水等)→描述现象→得出结论。(2) (NH4)2 SO4 与 NaNO2 发生氧化还原反应生成 N2。(3)硫酸
亚铁能被氧气氧化,故其作用是除去氧气。 浓硫酸的作用是除去水蒸气,如果 CD 对换,则
可能从硫酸亚铁溶液中带出水蒸气,无法干燥。(4)氮气与镁反应生成 Mg3N2。(5) 检验氮化镁
可根据氮化镁与水反应的现象判断,氮化镁会与水反应生成 NH3 和 Mg(OH)2 沉淀,NH3 为碱性气
体,挥发出来,遇红色石蕊试纸后会使其变蓝。
30.C5 J4
[2013·山东卷] TiO2 既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应 TiO2 (s)+CCl4(g)=====△ TiCl4 (g) +CO2 (g) ,在无水无氧条件下制
备 TiCl4,实验装置示意图如下:
图 0
有关物质性质如下表:
物质 熔点/℃ 沸点/℃ 其他
CCl4 -23 76 与 TiCl4 互溶
TiCl4 -25 136 遇潮湿空气产生白雾
仪 器 A 的 名 称 是 ________ 。 装 置 E 中 的 试 剂 是
________________________________________________________________________。
反应开始前依次进行如下操作:
组装仪器、________________、加装药品、通 N2 一段时间后点燃酒精灯。反应结束后的
操作包括:①停止通 N2;②熄灭酒精灯;③冷却至室温。正确的顺序为________(填序号)。
欲分离 D 中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含 Fe2O3、SiO2 等杂质)制备 TiO2 的有关反应包括:
酸溶
FeTiO3(s) +2H2SO4(aq)===FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解
TiOSO4(aq)+2H2O(l) =====90 ℃H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
图 0
①试剂 A 为________。钛液Ⅰ需冷却至 70 ℃左右,若温度过高会导致产品 TiO2 收率降低,
原因是________________________________________________________________________
________________________________________________________________________。
②取少量酸洗后的 H2TiO3,加入盐酸并振荡,滴加 KSCN 溶液后无明显现象,再加 H2O2 后
出现微红色,说明 H2TiO3 中存在的杂质离子是________。这种 H2TiO3 即使用水充分洗涤,煅
烧后获得的 TiO2 也会发黄,发黄的杂质是________(填化学式)。
30.[答案] (1)干燥管 浓 H2SO4 检查气密性 ②③① 分馏(或蒸馏)
(2)①Fe 温度过高会导致 TiOSO4 提前水解,产生 H2TiO3 沉淀
②Fe2+ Fe2O3
[解析] (1)利用有关物质的性质和实验目的,可知在装置 D 中冷却得到液态 TiCl4,则 E
中需盛装浓硫酸试剂,目的是为防止空气中水蒸气进入 D 与 TiCl4 发生水解反应;该反应流程
中有气体参与和生成,因此在组装好仪器,添加药品前需要检查装置的气密性;实验结束时,
为防止 D 中液体产物倒吸入装置 C 中,应熄灭酒精灯,然后让产品在氮气流中冷却到室温,
最后再停止通入氮气;D 中为互溶的 CCl4 与 TiCl4 液体,二者沸点相差较大,因此可采用蒸馏
或分馏的方法对该混合物进行分离提纯。(2)① 利用题中信息可知铁钛矿采用硫酸酸溶后的
钛液Ⅰ中含有 FeSO4、TiOSO4 以及铁钛矿中杂质 Fe2O3 与 H2SO4 作用生成 Fe2(SO4)3,利用流程知
加入试剂 A 的目的是将 Fe3+还原为 Fe2+,遵循除杂不引入新杂质的原则可知试剂 A 是铁;利
用题中 TiOSO4 发生水解的信息知,若得到钛液Ⅰ温度过高,TiOSO4 提前发生水解生成 H2TiO3
沉淀,与硫酸亚铁晶体一起被过滤去,会造成 Ti 损失。② 利用题中叙述的实验现象可知溶
液中含有 Fe2+;H2TiO3 中含有的杂质 Fe2+在加热过程中发生氧化反应,转化为 Fe2O3 导致获得
的 TiO2 发黄。
9.C3 F4 J1 J4
[2013·天津卷] FeCl3 在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程
制备无水 FeCl3,再用副产品 FeCl3 溶液吸收有毒的 H2S。
Ⅰ.经查阅资料得知:无水 FeCl3 在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
图 0
①检验装置的气密性;
②通入干燥的 Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入 Cl2,并用干燥的 N2 赶尽 Cl2,将收集器密封。
请回答下列问题:
(1) 装 置 A 中 反 应 的 化 学 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
(2)第③步加热后,生成的烟状 FeCl3 大部分进入收集器,少量沉积在反应管 A 右端。要
使 沉 积 的 FeCl3 进 入 收 集 器 , 第 ④ 步 操 作 是
________________________________________________________________________。
(3)操作步骤中,为防止 FeCl3 潮解所采取的措施有(填步骤序号)________。
(4) 装 置 B 中 冷 水 浴 的 作 用 为
________________________________________________________________________;
装置 C 的名称为________;装置 D 中 FeCl2 全部反应后,因失去吸收 Cl2 的作用而失效,
写出检验 FeCl2 是否失效的试剂:________。
(5)在虚线框中画出尾气吸收装置 E 并注明试剂。
Ⅱ.该组同学用装置 D 中的副产品 FeCl3 溶液吸收 H2S,得到单质硫;过滤后,再以石墨为
电极,在一定条件下电解滤液。
(6)FeCl3 与 H2S 反 应 的 离 子 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
(7) 电 解 池 中 H + 在 阴 极 放 电 产 生 H2 , 阳 极 的 电 极 反 应 式 为
________________________________________________________________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
① H2S 的 原 子 利 用 率 为 100% ;
②________________________________________________________________________。
9.[答案] (1)2Fe+ 3Cl2=====△ 2FeCl3
(2)在沉积的 FeCl3 固体下方加热
(3)②⑤
(4)冷却,使 FeCl3 沉积,便于收集产品 干燥管
K3[Fe(CN)6]溶液
(5)
(6)2Fe3++ H2S===2Fe2++S↓+2H+
(7)Fe2+-e-===Fe3+
(8)FeCl3 得到循环利用
[解析] (1)Cl2 与铁屑加热发生反应 2Fe+3Cl2=====△ 2FeCl3。
(2)根据 FeCl3 加热易升华,可在沉积 FeCl3 固体的下方用酒精灯加热,使 FeCl3 全部进入
收集器。
(3)第②步通入干燥的 Cl2 和第⑤步通入干燥的 N2,都是防止 FeCl3 潮解所采取的措施。
(4)装置 B 中冷水浴的作用是冷却 FeCl3,便于产品收集;Fe2+遇 K3[Fe(CN)6]溶液变蓝,
故可用 K3[Fe(CN)6]溶液检验 FeCl2 是否完全反应。
(5)用 NaOH 溶液吸收含 Cl2 的尾气。
(6)FeCl3 溶液吸收 H2S 有单质硫生成,故该反应的离子方程式为 2Fe3++H2S===2Fe2++S↓
+2H+。
(7)惰性电极电解 FeCl2 和 HCl 的混合溶液,由于还原性 Fe2+>Cl-,所以 Fe2+优先在阳极
上失去电子被氧化成 Fe3+。
(8)实验Ⅱ中 FeCl3 溶液吸收 H2S 后变成 FeCl2 和 HCl 的混合溶液,通过电解又变成 FeCl3
溶液,所以 FeCl3 溶液的循环利用是该实验的又一个优点。
28.D2 D3 J4
[2013·北京卷] 某学生对 SO2 与漂粉精的反应进行实验探究:
操作 现象
取 4 g 漂粉精固体,加入 100 mL 水 部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的 pH pH 试纸先变蓝(约为 12),后褪色
A
ⅰ.液面上方出现白雾
ⅱ.稍后,出现浑浊,溶液变为黄绿色
ⅲ.稍后,产生大量白色沉淀,黄绿色褪去
(1)Cl2 和 Ca(OH)2 制 取 漂 粉 精 的 化 学 方 程 式 是
________________________________________________________________________
________________________________________________________________________。
(2)pH 试 纸 颜 色 的 变 化 说 明 漂 粉 精 溶 液 具 有 的 性 质 是
________________________________________________________________________________
。
(3)向水中持续通入 SO2,未观察到白雾。推测现象 i 的白雾由盐酸小液滴形成,进行如
下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的 AgNO3 溶液检验白雾,产生白色沉淀。
① 实 验 a 的 目 的 是
________________________________________________________________________。
② 由 实 验 a 、 b 不 能 判 断 白 雾 中 含 有 HCl , 理 由 是
________________________________________________________________________
________________________________________________________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和 Cl-
发 生 反 应 。 通 过 进 一 步 实 验 确 认 了 这 种 可 能 性 , 其 实 验 方 案 是
________________________________________________________________________
________________________________________________________________________。
(5)将 A 瓶中混合物过滤、洗涤,得到沉淀 X。
①向沉淀 X 中加入稀盐酸,无明显变化。取上层清液,加入 BaCl2 溶液,产生白色沉淀。
则沉淀 X 中含有的物质是________。
② 用 离 子 方 程 式 解 释 现 象 ⅲ 中 黄 绿 色 褪 去 的 原 因 :
________________________________________________________________________
________________________________________________________________________。
28.[答案] (1)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2)碱性、漂白性
(3)①检验白雾中是否含有 Cl2,排除 Cl2 干扰
②白雾中混有 SO2,SO2 可与酸化的 AgNO3 反应产生白色沉淀
(4)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色
(5)①CaSO4
②SO2+Cl2+2H2O===SO2-
4 +2Cl-+4H+
[解析] (2)pH 试纸先变蓝,说明漂粉精溶液显碱性,后褪色,说明具有漂白性。
(3)实验 a 说明白雾中无 Cl2,从而排除了 Cl2 的干扰;在酸性溶液中 SO2 可被 NO -
3 氧化成
SO2-
4 ,SO 2-
4 也能与 Ag+反应生成白色沉淀,故不能判断白雾中含有盐酸。
(4)可根据反应 Cl-+ClO-+2H+===Cl2↑+H2O 来设计实验验证这种可能性。
(5)①向沉淀 X 中加入稀盐酸,无明显变化,说明沉淀 X 中不含 SO2-
3 ;向上层清液中加入
BaCl2 溶液,产生白色沉淀,说明 X 中含 SO2-
4 ,故沉淀 X 为微溶物 CaSO4。②黄绿色溶液中含有
Cl2,向该溶液中通入 SO2 可发生反应 SO2+Cl2+2H2O===SO2-
4 +2Cl-+4H+。
9.J2 J4 J5
[2013·四川卷] 为了探究 AgNO3 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3 的氧化性
将光亮的铁丝伸入 AgNO3 溶液中,一段时间后将铁丝取出。为检验溶液中 Fe 的氧化产物,
将溶液中的 Ag+除尽后,进行了如下实验。可选用的试剂:KSCN 溶液、K3[Fe(CN)6]溶液、氯
水。
(1)请完成下表:
操作 现象 结论
取少量除尽 Ag+后的溶液于试管中,加
入 KSCN 溶液,振荡 ____①____ 存在 Fe3+
取少量除尽 Ag+后的溶液于试管中,加
入____②____,振荡 ____③____ 存在 Fe2+
【实验结论】Fe 的氧化产物为 Fe2+和 Fe3+。
Ⅱ.AgNO3 的热稳定性
用下图所示的实验装置 A 加热 AgNO3 固体,产生红棕色气体,在装置 D 中收集到无色气
体。当反应结束后,试管中残留固体为黑色。
图 0
(2) 装 置 B 的 作 用 是
________________________________________________________________________。
(3) 经 小 组 讨 论 并 验 证 该 无 色 气 体 为 O2 , 其 验 证 方 法 是
________________________________________________________________________
________________________________________________________________________。
(4)【查阅资料】Ag2O 和粉末状的 Ag 均为黑色;Ag2O 可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag 和 Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实
验。
实验编号 操作 现象
a 加入足量氨水,振荡 黑色固体不溶解
b 加入足量稀硝酸,振荡 黑色固体溶解,并有气体产生
【实验评价】根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出 AgNO3 固体热分解的产物有________。
9.[答案] (1)①溶液呈红色 ②K3[Fe(CN)6]溶液
③产生蓝色沉淀
(2)防倒吸
(3)用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为 O2
(4)①b ②Ag、NO2、O2
[解析] (1)Fe3+与 KSCN 溶液混合生成 Fe(SCN)3 血红色溶液,Fe2+与 K3[Fe(CN)6]溶液反应
生成蓝色沉淀,故看到溶液变为血红色,说明含有 Fe3+,若加入 K3[Fe(CN)6]溶液,看到有蓝
色沉淀,说明溶液中含有 Fe2+。(2)装置 B 连接反应装置 A 和除杂装置 C,为防止 C 装置中的
水进入加热的试管,所以 B 装置起到安全瓶作用,防倒吸。(3)氧气可使带火星的木条复燃,
据此可进行实验设计。(4)结合题干【查阅资料】提供的信息知,氨水能溶解 Ag2O,因此实验
a 可确定产物只含 Ag;Ag2O、Ag 均可溶于稀硝酸,但只有 Ag 与稀硝酸发生氧化还原反应放出
气体,故实验 b 只能确定含有 Ag,不能判断是否含有 Ag2O。
26.C3 D4 J4
[2013·浙江卷] 氢能源是一种重要的清洁能源。现有两种可产生 H2 的化合物甲和乙。将
6.00 g 甲加热至完全分解,只得到一种短周期元素的金属单质和 6.72 L 的 H2(已折算成标准
状况)。甲与水反应也能放出 H2,同时还产生一种白色沉淀物,该白色沉淀可溶于 NaOH 溶液。
化合物乙在催化剂存在下可分解得到 H2 和另一种单质气体丙,丙在标准状况下的密度为 1.25
g·L-1。请回答下列问题:
(1)甲的化学式是________;乙的电子式是________。
(2) 甲 与 水 反 应 的 化 学 方 程 式 是
________________________________________________________________________
________________________________________________________________________。
(3)气体丙与金属镁反应的产物是________(用化学式表示)。
(4)乙在加 热条件下 与 CuO 反应可 生成 Cu 和气体 丙,写出该 反应的化 学方程式
________________________________________________________________________。
有 人 提 出 产 物 Cu 中 可 能 还 混 有 Cu2O , 请 设 计 实 验 方 案 验 证 之
________________________________________________________________________
____________。
(已知:Cu2O+2H+===Cu+Cu2++H2O)
(5)甲与乙之间________(填“可能”或“不可能”)发生反应产生 H2 ,判断理由是
________________________________________________________________________
________________________________________________________________________。
26.[答案] (1)AlH3 H∶N , H ∶H
(2)AlH3+3H2O===Al(OH)3+3H2↑
(3)Mg3N2
(4)2NH3+3CuO=====△ 3Cu+N2+3H2O
取样后加稀 H2SO4,如果溶液变蓝,说明产物中含有 Cu2O。反之则无 Cu2O
(5)可能 AlH3 中的氢化合价为-1 价,NH3 中的氢为+1 价,因而有可能发生氧化还原反
应生成氢气
[解析] (1)甲加热只得到一种金属单质和 H2,则甲只含有两种元素,又甲与水反应生成
H2 和一种能溶于碱的白色沉淀,由此可推断甲中含有铝和氢两种元素,其中 H 为-1 价,故甲
的化学式为 AlH3。乙分解得 H2 和另一气体丙,故乙也仅含有两种元素,丙的相对分子质量为
1.25×22.4=28,则应为 N2,由题(4)知,乙能还原 CuO 生成 Cu,由此推知乙为 NH3。(2)AlH3
中 H 为-1 价,H2O 中 H 为+1 价,两者发生氧化还原反应生成 H2,铝元素转化为 Al(OH)3 沉淀。
(3)N2 与 Mg 反应生成 Mg3N2。(4)NH3 还原 CuO,根据氧化还原反应得失电子守恒可配平。由题中
信息知,Cu2O 能溶于 H+,生成蓝色的 Cu2+。由 Cu 不能溶于非氧化性酸,故可用稀 H2SO4 来检
验 Cu2O 的存在。(5)AlH3 中的 H 为-1 价,而 NH3 中的 H 为+1 价,两者可发生氧化还原反应,
生成 0 价的 H2。
13.J4 [2013·浙江卷] 现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制
剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
图 0
已知:控制溶液 pH=4 时,Fe(OH)3 沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
A.根据现象 1 可推出该试液中含有 Na+
B.根据现象 2 可推出该试液中并不含有葡萄糖酸根
C.根据现象 3 和 4 可推出该试液中含有 Ca2+,但没有 Mg2+
D.根据现象 5 可推出该试液中一定含有 Fe2+
13.C [解析] 由于之前操作中加过 NaOH 溶液,所以不能确定原溶液中是否含有 Na+,A
项错误;葡萄糖酸中不存在醛基,所以无法用是否发生银镜反应来判断葡萄糖酸根的存在,B
项错误;现象 3 说明无 Mg2+,现象 4 说明存在 Ca2+,C 项正确;由于之前加过 H2O2,也没有进
行过是否存在 Fe2+的测定,最后检测得到存在 Fe3+,可能是原来存在的,也可能是由 Fe2+氧
化得到的,D 项错误。
26.J1 J4 L2 L4
[2013·新课标全国卷Ⅱ] 正丁醛是一种化工原料。某实验小组利用如下装置合成正丁
醛。
图 0
发生的反应如下:
CH3CH2CH2CH2OH ――→Na2Cr2O7
H2SO4 △CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ 密度/(g·cm-3) 水中溶解性
正丁醇 117.2 0.810 9 微溶
正丁醛 75.7 0.801 7 微溶
实验步骤如下:
将 6.0 g Na2Cr2O7 放入 100 mL 烧杯中,加 30 mL 水溶解,再缓慢加入 5 mL 浓硫酸,将所
得溶液小心转移至 B 中。在 A 中加入 4.0 g 正丁醇和几粒沸石,加热。当有蒸气出现时,开
始滴加 B 中溶液。滴加过程中保持反应温度为 90~95 ℃,在 E 中收集 90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集 75~77 ℃馏分,产量
2.0 g。
回答下列问题:
(1) 实 验 中 , 能 否 将 Na2Cr2O7 溶 液 加 到 浓 硫 酸 中 , 说 明 理 由
________________________________________________________________________。
(2) 加 入 沸 石 的 作 用 是
________________________________________________________________________。
若 加 热 后 发 现 未 加 沸 石 , 应 采 取 的 正 确 方 法 是
________________________________________________________________________。
(3)上述装置图中,B 仪器的名称是________,D 仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥
c.检漏 d.标定
(5) 将 正 丁 醛 粗 产 品 置 于 分 液 漏 斗 中 分 水 时 , 水 在
________________________________________________________________________
层(填“上”或“下”)。
(6) 反 应 温 度 应 保 持 在 90 ~ 95 ℃ , 其 原 因 是
________________________________________________________________________
________________________________________________________________________。
(7)本实验中,正丁醛的产率为________%。
26.[答案] (1)不能,易迸溅
(2)防止暴沸 冷却后补加
(3)滴液漏斗 直形冷凝管
(4)c
(5)下
(6)既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(7)51
[解析] (1)溶液加入浓硫酸,相当于水加入浓硫酸中,易使液体飞溅出来造成实验事故,
因此不能将 Na2Cr2O7 溶液加入到浓硫酸中。(2)沸石的作用是防止局部受热发生暴沸。加热后
发现未加沸石,只能选择停止加热,冷却后再添加沸石。(4)分液漏斗有接口,应首先检漏。
(5)正丁醛的密度小于水的密度,正丁醛在上层,水在下层。(6)正丁醇的沸点为 117.2 ℃,
正丁醛的沸点为 75.7 ℃,控制温度,一方面是为了蒸出正丁醛,另一方面避免温度过高醛基
被氧化。(7)结合 C4H10O→C4H8O,正丁醛的理论产量为 4 g×72
74
,产率为
2 g
4 g×72
74
×100%=51%。
J5 化学实验综合
21.E5 J5
[2013·江苏卷] A.[物质结构与性质]元素 X 位于第四周期,其基态原子的内层轨道全
部排满电子,且最外层电子数为 2。元素 Y 基态原子的 3p 轨道上有 4 个电子。元素 Z 的原子
最外层电子数是其内层的 3 倍。
(1)X 与 Y 所形成化合物晶体的晶胞如下图所示。
图 0
①在 1 个晶胞中,X 离子的数目为__________。
②该化合物的化学式为__________。
(2)在 Y 的氢化物(H2Y)分子中,Y 原子轨道的杂化类型是____________。
(3)Z 的 氢 化 物 (H2Z) 在 乙 醇 中 的 溶 解 度 大 于 H2Y , 其 原 因 是
________________________________________________________________________
________________________________________________________________________。
(4)Y 与 Z 可形成 YZ2-
4 。
① YZ 2-
4 的 空 间 构 型 为
________________________________________________________________________( 用 文 字
描述)。
②写出一种与 YZ 2-
4 互为等电子体的分子的化学式:____________。
(5)X 的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol 该配合物中含有σ键的数目
为________。
B.[实验化学]3,5二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素
的合成。一种以间苯三酚为原料的合成反应如下:
HOOHOH+2CH3OH ――→氯化氢的甲醇溶液
H3COOHOCH3+2H2O
甲醇、乙醚和 3,5二甲氧基苯酚的部分物理性质见下表:
物质 沸点/℃ 熔点/℃ 密度(20 ℃)/
g·cm-3 溶解性
甲醇 64.7 0.791 5 易溶于水
乙醚 34.5 0.713 8 微溶于水
3,5二甲氧基
苯酚 33~36 易溶于甲醇、
乙醚,微溶于水
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是
____________。②萃取用到的分液漏斗使用前需__________并洗净,分液时有机层在分液漏
斗的__________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和 NaHCO3 溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱
和 NaHCO3 溶 液 洗 涤 的 目 的 是 ________________ ; 用 饱 和 食 盐 水 洗 涤 的 目 的 是
________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水 CaCl2 干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________________,
再________________。
21.[答案] A.[物质结构与性质]
(1)①4 ②ZnS (2)sp3
(3)水分子与乙醇分子之间形成氢键
(4)①正四面体
②CCl4 或 SiCl4 等
(5)16 mol 或 16×6.02×1023 个
B.[实验化学]
(1)①蒸馏 ②检查是否漏水 上
(2)除去 HCl 除去少量 NaHCO3 且减少产物损失
(3)dcab
(4)拆去连接抽气泵和吸滤瓶的橡皮管 关闭抽气泵
[解析] A.X 为第四周期元素,且内层轨道电子数全满,最外层电子数为 2,则其基态电
子排布式应为[Ar]3d104s2,所以为 Zn。Y 的 3p 轨道上有 4 个电子,则应为 S。Z 的最外层电子
数是内层的 3 倍,故为 O。(1)从晶胞图分析,含有 X 离子为 8×1
8
+6×1
2
=4。Y 为 4 个,所以
化合物中 X 与 Y 原子个数之比为 1∶1,则化学式为 ZnS。(2)H2S 分子中,S 有两对孤对电子,
价层电子对数为 2+2=4,所以 S 为 sp3 杂化。(3)H2O 与乙醇分子间形成氢键,增大了 H2O 在
乙醇中的溶解度。(4)SO 2-
4 中 S 无孤对电子,S 的价层电子对数为 4,则 S 为 sp3 杂化,所以 SO2-
4
为正四面体结构。等电子体的原子数相等,价电子数相等,SO 2-
4 的原子数为 5,价电子数为
32。(5)NH3 分子中的σ键数为 3,它与 Zn 形成的配位键也属于σ键,故 1 mol[Zn(NH3)4]Cl2
中的σ键为 16 mol。
B.(1)甲醇和乙醚是互溶的有机物,但沸点相差较大,因此可用蒸馏法分离。分液漏斗
使用前需要检查是否漏水,乙醚作萃取剂,其密度小于水,故有机层在上层。(2)反应在 HCl
的甲醇溶液中进行,所以有机层中会溶有 HCl,故用 NaHCO3 溶液可除去。用饱和食盐水可以降
低有机物的溶解度。(3)先加无水 CaCl2,吸收水分,然后过滤除去 CaCl2,再蒸馏除去乙醚杂
质,最后重结晶获得产物。(4)为防倒吸,应将吸滤瓶与抽气泵先断开,再关闭抽气泵。
16.B1 C3 J5
[2013·江苏卷] 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁
是一种新的探索。以菱镁矿(主要成分为 MgCO3,含少量 FeCO3)为原料制备高纯氧化镁的实验
流程如下:
图 0
(1)MgCO3 与 稀 硫 酸 反 应 的 离 子 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
(2) 加 入 H2O2 氧 化 时 , 发 生 反 应 的 化 学 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
(3)滤渣 2 的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C =====800 ℃2MgO+2SO2↑+CO2↑;
MgSO4+C =====800 ℃MgO+SO2↑+CO↑;
MgSO4+3C =====800 ℃MgO+S↑+3CO↑。
利用如图 0 装置对煅烧产生的气体进行分步吸收或收集。
图 0
①D 中收集的气体是________(填化学式)。
②B 中盛放的溶液可以是________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4 溶液
③A 中得到的淡黄色固体能与热的 NaOH 溶液反应,产物中元素的最高价态为+4,写出该
反 应 的 离 子 方 程 式 :
________________________________________________________________________________
。
16.[答案] (1)MgCO3+2H+===Mg2++CO2↑+H2O
(2)2FeSO4+H2O2+H2SO4===Fe2(SO4)3+2H2O
(3)Fe(OH)3
(4)①CO
②d
③3S+6OH-=====△ 2S2-+SO2-
3 +3H2O
[解析] (1)MgCO3 为难溶性物质,写离子方程式不能拆分成离子。(2)根据菱镁矿的成分,
可知滤液中含有 Fe2+,H2O2 的作用是将 Fe2+氧化成 Fe3+。加入稀硫酸则溶液显酸性,所以离子
方程式为 2FeSO4+H2SO4+H2O2===Fe2(SO4)3+2H2O。(3)要提取镁元素,必须除去不溶性杂质和铁
元素。根据流程图可知滤渣 1 是不溶性杂质,滤渣 2 中含的是铁元素。结合加入一水合氨和
H2O2,可知滤渣 2 是 Fe(OH)3。(4)根据反应原理,可知气体中含有 SO2、CO2、CO 和硫蒸气。
①D 采用排水集气法,气体必然不溶于水,所以是 CO。②SO2 和 CO2 均属于酸性氧化物,均能
与 NaOH、Na2CO3 溶液反应,达不到分离的目的,a、b 错误。SO2 与稀 HNO3 反应同时得到 NO,产
生新杂质,干扰后续操作,c 错误。SO2 能被酸性 KMnO4 溶液氧化,而且没有新气体生成,d 正
确。③根据“淡黄色固体”,可知 A 中是硫单质。产物中有+4 价硫,说明是 Na2SO3,进而可
知发生氧化还原反应,必然有部分硫化合价降低转化成 Na2S。根据化合价升降总数相等,所
以有 3S+6OH-=====△ SO2-
3 +2S2-+3H2O。
33.J3 J1 D2 J4 J5 F3 F5 C5
[2013·广东卷] 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,
提升科学素养。
(1)在实验室中用浓盐酸与 MnO2 共热制取 Cl2 并进行相关实验。
①下列收集 Cl2 的正确装置是________。
A B C D
图 0
②将 Cl2 通入水中,所得溶液中具有氧化性的含氯粒子是________。
③设计实验比较 Cl2 和 Br2 的氧化性,操作与现象是:取少量新制氯水和 CCl4 于试管中,
________________________________________________________________________
________________________________________________________________________。
(2)能量之间可以相互转化:电解食盐水制备 Cl2 是将电能转化为化学能,而原电池可将
化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq)、FeSO4(aq)、CuSO4(aq);铜片、铁片、锌片和导线。
①完成原电池甲的装置示意图(见图 0),并作相应标注。
图 0
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一
段 时 间 后 , 可 观 察 到 负 极
________________________________________________________________________________
。
③甲 乙两 种原 电 池中 可更 有 效地 将 化学 能转 化 为电 能的 是 ________ ,其 原因 是
________________________________________________________________________。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中
应选________作阳极。
33.[答案] (1)①C
②HClO、Cl2、ClO-
③向试管中滴加 NaBr 溶液,振荡、静置。试管中液体分层,上层接近无色,下层为橙红
色
(2)①
②电极逐渐溶解
③甲 可以避免 Zn 与 Cu2+的接触,提高电池效率,提供稳定电流
(3)Zn
[解析] (1)①集气瓶中使用单孔橡胶塞,则瓶内气体压强增大到一定程度会发生爆炸等,
A 项错误;倒立的集气瓶中有双孔橡胶塞,由于氯气的密度比空气大,氯气从长导气管中进,
从短导气管中逸出,因此不能排出空气收集氯气,B 项错误;正立的集气瓶中有双孔橡胶塞,
氯气从长导管中进,空气从短导管排出,排出的气体通过倒扣漏斗、NaOH 溶液吸收处理,既
防止倒吸又防止排出氯气污染空气,C 项正确;氯气与 NaOH 溶液反应 Cl2+2NaOH===NaClO+
NaCl+H2O,因此不能用排 NaOH 溶液的方法收集氯气,D 项错误;②氯气与水发生可逆反应 Cl2
+H2O H++Cl-+HClO,所得氯水中含 H2O、Cl2、H+、Cl-、HClO、ClO-、OH-等离子,其中
具有强氧化性的含氯粒子是 Cl2、HClO、ClO-;(2)①带盐桥的原电池甲可以设计锌铜原电池(或
铁铜原电池、锌铁原电池),由于外电路中电子从左移向右,说明左边烧杯中电极的金属性较
强,则左、右两边烧杯中电极材料及电解质溶液可以为锌片和硫酸锌溶液、铜片和硫酸铜溶
液(或者铁片和硫酸亚铁溶液、铜片和硫酸铜溶液,锌片和硫酸锌溶液、铁片和硫酸亚铁溶液);
②金属活动性 Zn>Fe>Cu,则原电池乙中铜片作正极,锌片或铁片作负极,工作一段时间后,
负极金属锌或铁被氧化,质量减轻,溶液中蓝色变浅;③甲、乙两种原电池都能将化学能转
化为电能,其中带有盐桥的原电池甲中的负极金属锌(或铁)和硫酸铜没有直接接触,二者不
会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极
金属锌(或铁)和硫酸铜直接接触发生置换反应,部分化学能会转化为热能,化学能不能全部
转化为电能;(3)铁片作正极(阴极)时被保护,而铁作负极(阳极)时被腐蚀,为了减缓电解质
溶液中铁片的腐蚀,在(2)的材料中应选择比铁活泼的锌片作负极(阳极),使铁片作正极(阴
极),从而牺牲锌片保护铁片;不能选择铜片,因为铜作正极(阴极),而铁片作负极(阳极),
此时铁片的腐蚀速率加快,而不是延缓。
28.J1 J2 J3 J4 J5
[2013·全国卷] 制备氮化镁的装置示意图如下:
图 0
回答下列问题:
(1) 检 查 装 置 气 密 性 的 方 法 是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________,
a 的名称是____________,b 的名称是____________。
(2) 写 出 NaNO2 和 (NH4)2SO4 反 应 制 备 氮 气 的 化 学 方 程 式
________________________________________________________________________。
(3)C 的作用是____________________,D 的作用是______________,是否可以把 C 与 D
的 位 置 对 调 并 说 明 理 由
________________________________________________________________________________
________________________________________________________________________。
(4) 写 出 E 中 发 生 反 应 的 化 学 方 程 式
________________________________________________________________________
________________________________________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及
现象________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
28.[答案] (1)微热 b,这时 G 中有气泡冒出,停止加热冷却后,G 中插在溶液里的玻璃
管形成一段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2=====△ 2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg=====△ Mg3N2
(5)取少量产物于试管中,加少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把
润湿的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,
若观察到有气泡产生,则证明产物中含有未反应的镁
[解析] (1) 气密性检查的基本思路: 装置形成封闭体系→操作(微热、手捂、热毛巾捂、
加水等)→描述现象→得出结论。(2) (NH4)2 SO4 与 NaNO2 发生氧化还原反应生成 N2。(3)硫酸
亚铁能被氧气氧化,故其作用是除去氧气。 浓硫酸的作用是除去水蒸气,如果 CD 对换,则
可能从硫酸亚铁溶液中带出水蒸气,无法干燥。(4)氮气与镁反应生成 Mg3N2。(5) 检验氮化镁
可根据氮化镁与水反应的现象判断,氮化镁会与水反应生成 NH3 和 Mg(OH)2 沉淀,NH3 为碱性气
体,挥发出来,遇红色石蕊试纸后会使其变蓝。
9.J5 [2013·重庆卷] 某研究小组利用下图装置探究温度对 CO 还原 Fe2O3 的影响(固定
装置略)。
图 0
(1)MgCO3 的分解产物为________。
(2) 装 置 C 的 作 用 是
________________________________________________________________________,
处 理 尾 气 的 方 法 为
________________________________________________________________________。
(3)将研究小组分为两组,按图中装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对
装置 D 加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验。
步骤 操作 甲组现象 乙组现象
1 取黑色粉末加入稀盐酸 溶解,无气泡 溶解,有气泡
2 取步骤 1 中溶液,滴加 K3[Fe(CN)6]溶液 蓝色沉淀 蓝色沉淀
3 取步骤 1 中溶液,滴加 KSCN 溶液 变红 无现象
4 向步骤 3 溶液中滴加新制氯水 红色褪去 先变红,后褪色
①乙组得到的黑色粉末是________。
② 甲 组 步 骤 1 中 反 应 的 离 子 方 程 式 为
________________________________________________________________________
________________________________________________________________________。
③ 乙 组 步 骤 4 中 , 溶 液 变 红 的 原 因 为
________________________________________________________________________
________________________________________________________________________;
溶 液 褪 色 可 能 的 原 因 及 其 验 证 方 法 为
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
④ 从 实 验 安 全 考 虑 , 图 中 装 置 还 可 采 取 的 改 进 措 施 是
________________________________________________________________________
________________________________________________________________________。
9.[答案] (1)MgO、CO2
(2)除 CO2 点燃
(3)①Fe
②Fe3O4+8H+===2Fe3++Fe2++4H2O
③Fe2+被氧化为 Fe3+,Fe3+遇 SCN-显红色 假设 SCN-被 Cl2 氧化,向溶液中加入 KSCN 溶
液,若出现红色,则假设成立(其他合理答案均可)
④在装置 BC 之间添加装置 E 防倒吸(其他合理答案均可)
[解析] 难溶或微溶性碳酸盐受热分解生成对应的金属氧化物和 CO2, B 装置中的 Zn 将 CO2
还原为 CO,产物中残留的 CO2 用足量 NaOH 吸收,带出的 H2O(g)用无水 CaCl2 干燥;CO 与 Fe2O3
在不同温度下反应生成纯净的黑色粉末,该粉末能被盐酸溶解,不可能为 C,甲、乙两组现象
中均有蓝色沉淀产生,说明溶液中均含有 Fe2+,滴加 KSCN 溶液后,甲组变红,说明甲组还含
有 Fe3+,乙组无现象,说明乙组中只含有 Fe2+,结合元素守恒的相关知识可推断甲组得到的
黑色粉末为 Fe3O4,乙组得到的黑色粉末为 Fe;因氯气具有氧化性,SCN-具有还原性,褪色的
原因可能是二者发生了反应,取褪色后的溶液,加入足量的 KSCN 溶液,如果溶液恢复红色,
说明假设是正确的。
9.J2 J4 J5
[2013·四川卷] 为了探究 AgNO3 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3 的氧化性
将光亮的铁丝伸入 AgNO3 溶液中,一段时间后将铁丝取出。为检验溶液中 Fe 的氧化产物,
将溶液中的 Ag+除尽后,进行了如下实验。可选用的试剂:KSCN 溶液、K3[Fe(CN)6]溶液、氯
水。
(1)请完成下表:
操作 现象 结论
取少量除尽 Ag+后的溶液于试管中,加
入 KSCN 溶液,振荡 ____①____ 存在 Fe3+
取少量除尽 Ag+后的溶液于试管中,加 ____③____ 存在 Fe2+
入____②____,振荡
【实验结论】Fe 的氧化产物为 Fe2+和 Fe3+。
Ⅱ.AgNO3 的热稳定性
用下图所示的实验装置 A 加热 AgNO3 固体,产生红棕色气体,在装置 D 中收集到无色气
体。当反应结束后,试管中残留固体为黑色。
图 0
(2) 装 置 B 的 作 用 是
________________________________________________________________________。
(3) 经 小 组 讨 论 并 验 证 该 无 色 气 体 为 O2 , 其 验 证 方 法 是
________________________________________________________________________
________________________________________________________________________。
(4)【查阅资料】Ag2O 和粉末状的 Ag 均为黑色;Ag2O 可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag 和 Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实
验。
实验编号 操作 现象
a 加入足量氨水,振荡 黑色固体不溶解
b 加入足量稀硝酸,振荡 黑色固体溶解,并有气体产生
【实验评价】根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出 AgNO3 固体热分解的产物有________。
9.[答案] (1)①溶液呈红色 ②K3[Fe(CN)6]溶液
③产生蓝色沉淀
(2)防倒吸
(3)用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为 O2
(4)①b ②Ag、NO2、O2
[解析] (1)Fe3+与 KSCN 溶液混合生成 Fe(SCN)3 血红色溶液,Fe2+与 K3[Fe(CN)6]溶液反应
生成蓝色沉淀,故看到溶液变为血红色,说明含有 Fe3+,若加入 K3[Fe(CN)6]溶液,看到有蓝
色沉淀,说明溶液中含有 Fe2+。(2)装置 B 连接反应装置 A 和除杂装置 C,为防止 C 装置中的
水进入加热的试管,所以 B 装置起到安全瓶作用,防倒吸。(3)氧气可使带火星的木条复燃,
据此可进行实验设计。(4)结合题干【查阅资料】提供的信息知,氨水能溶解 Ag2O,因此实验
a 可确定产物只含 Ag;Ag2O、Ag 均可溶于稀硝酸,但只有 Ag 与稀硝酸发生氧化还原反应放出
气体,故实验 b 只能确定含有 Ag,不能判断是否含有 Ag2O。
26.J1 J2 J5
[2013·新课标全国卷Ⅰ] 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实
验装置如下:
OH ――→浓 H2SO4
△ +H2O
图 0
可能用到的有关数据如下:
相对分子质量 密度/(g·cm-3) 沸点/℃ 溶解性
环己醇 100 0.961 8 161 微溶于水
环己烯 82 0.810 2 83 难溶于水
合成反应:
在 a 中加入 20 g 环己醇和 2 小片碎瓷片,冷却搅动下慢慢加入 1 mL 浓硫酸。b 中通入冷
却水后,开始缓慢加热 a,控制馏出物的温度不超过 90 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,分别用少量 5%碳酸钠溶液和水洗涤,分离后加入无水氯
化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净的环己烯 10 g。
回答下列问题:
(1)装置 b 的名称是________。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正
确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏
斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50%
C.61% D.70%
26.[答案] (1)直形冷凝管
(2)防止暴沸 B
(3)O
(4)检漏 上口倒出
(5)干燥(或除水除醇)
(6)C D (7)C
[解析] (1)冷凝管有直形冷凝管、空气冷凝管、球形冷凝管和蛇形冷凝管。根据形状进
行识别,可知装置 b 的名称为直形冷凝管。
(2)碎瓷片具有防止暴沸的作用;在加热开始后发现没加沸石,应停止加热,待稍冷却后
再加入沸石,否则易发生爆炸。
(3)醇在浓硫酸、加热条件下可发生分子内消去生成烯或分子间脱水生成醚,另一副产物
为分子间脱水生成的 O。
(4)分液漏斗使用前有两处需检漏,分别为上口及旋塞处;环己烯密度小于水,分液后应
从上口倒出。
(5)无水氯化钙具有干燥作用(或除水除醇)。
(6)观察蒸馏装置,可知不需要的仪器有吸滤瓶、球形冷凝管。
(7)环己烯的产率=10 g÷
20 g× 82
100 ×100%=61%。
1.[2013·连云港模拟]下列有关实验原理、方法和结论都正确的是( )
A.用 HNO2 溶液作导电性实验,灯光较暗,说明 HNO2 是弱电解质
B.在滴有酚酞的 Na2CO3 溶液中逐滴加入 BaCl2 溶液,红色逐渐褪去,说明 Na2CO3 溶液中存
在水解平衡
C.将等体积、等 pH 的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的 pH 变化大
D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来
1.B [解析]导电性与离子的浓度有关,题中未指明浓度,不能证明,A 项错误;滴加酚
酞,溶液呈红色,说明溶液呈碱性,而加 BaCl2 溶液,会生成 BaCO3 沉淀,CO 2-
3 减少,红色褪
去,说明酚酞变红是由 CO 2-
3 水解引起的,B 项正确;醋酸是弱酸,不完全电离,在稀释过程中
又会电离,故其 pH 变化小,C 项错误;酒精与水互溶,不能从碘水中萃取碘,D 项错误。
2.[2013·东北三校联考]下列实验操作,对实验结果不产生影响的是( )
A.用酸碱中和滴定法测定未知浓度的碱液时,加入甲基橙或酚酞 1~2mL
B.用托盘天平称量 4.2gNaCl 时,左盘放砝码,右盘放 NaCl
C.用 pH 试纸测定 90℃时纯水的 pH
D.配制一定物质的量浓度的溶液时,容量瓶用蒸馏水洗净后未干燥
2.D [解析]指示剂本身为有机弱酸或有机弱碱,加入过多的指示剂,也会对实验产生
影响,且指示剂的用量一般为 2~3 滴,A 项错误;使用托盘天平应遵循“左物右码”的原则,
该实验放反了,实际质量为 4g-0.2g=3.8g,B 项错误;pH 试纸只能粗略测量溶液的 pH,C
项错误;配制溶液过程中,溶解、洗涤和定容过程中,均需用蒸馏水,D 项正确。
3.[2013·山东德州期末校际联考]硫酸工业中废渣的成分为 SiO2、Fe2O3、Al2O3、MgO。
某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离
开来。
图 K44-3
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下:
阳离子 Fe3+ Al3+ Mg2+
开始沉淀时的 pH 1.9 3.7 9.6
沉淀完全时的 pH 3.2 5.2 11.0
(1)固体 A 溶于 NaOH 溶液的化学方程式为_____________________________________。
________________________________________________________________________。
(2)实验室用 11.9mol/L 的浓盐酸配制 250mL3.0mol/L 的稀盐酸,所用的玻璃仪器除烧
杯、玻璃棒和量筒外,还需要_______________________________________________________。
(3)上述流程中的试剂 Y 最好选用下列中的 (选填字母编号)。
A.水 B.氧化镁 C.氨水 D.氢氧化钠
( 4 ) 写 出 溶 液 D 中 的 金 属 离 子 在 加 入 试 剂 Y 时 发 生 反 应 的 离 子 方 程 式
________________________________________________________________________。
(5)实验室可用大理石和稀盐酸反应制取上述流程中所需的 CO2,仪器如下,装置 A 产
生 CO2,按气流方向连接各仪器接口,顺序为 a→ ,装置 C 中应盛放的试剂为 。
图 K44-4
3.(1)SiO2+2NaOH===Na2SiO3+H2O
(2)250mL 容量瓶、胶头滴管 (3)D
(4)Al3++4OH-===AlO-
2 +2H2O
Mg2++2OH-===Mg(OH)2↓
(5)→d→e→c→b
4.[2013·广东六校模拟]锶(Sr)为第五周期第ⅡA 族元素。高纯六水氯化锶晶体
(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。
用工业碳酸锶粉末(含少量 Ba、Fe 的化合物)制备高纯六水氯化锶的过程如图 K45-6 所示。
图 K45-6
请回答下列问题。
(1)氯化锶溶液显 (填“酸性”“碱性”或“中性”)。
( 2 ) 写 出 步 骤 ② 在 浆 液 中 加 入 盐 酸 时 发 生 反 应 的 离 子 方 程 式
________________________________________________________________________。
(3)步骤③中调节溶液 pH 至 8~10,宜选用的试剂为 。
A.稀硫酸
B.氢氧化锶粉末
C.氢氧化钠
D.氧化锶粉末
所得滤渣的主要成分是 (填化学式)。
(4)步骤⑤中,洗涤氯化锶晶体最好选用 。
A.水
B.稀硫酸
C.氢氧化钠溶液
D.氯化锶饱和溶液
工 业 上 用 50 ~ 60℃ 热 风 吹 干 六 水 氯 化 锶 , 选 择 该 温 度 的 原 因 是
________________________________________________________________________。
(5)若滤液中 Ba2+浓度为 1×10-5mol·L-1,依据下表数据可以推算滤液中 Sr2+物质的量
浓度为 。
SrSO4 BaSO4 Sr(OH)2
Ksp 3.3×10-7 1.1×10-10 3.2×10-4
5.(1)中性
(2)SrCO3+2H+===Sr2++CO2↑+H2O
(3)B、D BaSO4、Fe(OH)3
(4)D 温度高有利于除去湿存(晶体表面附着的)水,但温度高于 61℃时,氯化锶晶体中
的结晶水也会失去
(5)不大于 0.03mol·L-1
[解析] (5)Ksp(BaSO4)=c(Ba2+)·c(SO2-
4 )=1×10-5·c(SO2-
4 )=1.1×10-10,解得 c(SO2-
4 )
=1.1×10-5mol/L。因溶液中无 SrSO4 沉淀,故 Qc(SrSO4)=c(Sr2+)·c(SO2-
4 )≤Ksp(SrSO4),所
以 c(Sr2+)≤Ksp(SrSO4)
c(SO2-
4 )
=3.3×10-7
1.1×10-5=0.03mol/L。
4.[2013·郑州一模]无水 AlCl3 是一种重要的有机合成催化剂,该物质在 183℃时升华,
遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水
AlCl3,实验装置如图 K45-5 所示。
图 K45-5
请回答下列问题。
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是 。
a.加入 MnO2 粉末
b.点燃 A 中酒精灯
c.加入浓盐酸
d.点燃 D 处酒精灯
( 2 ) 写 出 A 装 置 中 发 生 反 应 的 化 学 方 程 式 :
________________________________________________________________________
________________________________________________________________________。
( 3 ) 装 置 B 和 C 中 的 试 剂 分 别 是
________________________________________________________________________。
(4)甲同学认为 F 和 G 可以用一种仪器替代,且加入一种药品即可达到相同效果。这种
药品可以是 。
(5)E 中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学
方 程 式 表 示 其 原 因
________________________________________________________________________
________________________________________________________________________。
(6)制备过程中随着盐酸的浓度下降,氯气的制取反应会停止。为测定残余液中盐酸的
浓度,某同学量取残余液 10.00mL,加水稀释到 250.00mL。然后从中取出 20.00mL,用
0.1000mol·L-1 的 NaOH 标准溶液进行滴定,终点时消耗 NaOH 溶液 24.00mL。则该残余液体中
盐酸的浓度为 。
5.(1)acbd (2)MnO2+4HCl(浓)=====△ MnCl2+Cl2↑+2H2O
(3)饱和食盐水、浓硫酸 (4)碱石灰或氧化钙
(5)AlCl3+3H2O===Al(OH)3+3HCl
(6)3.00mol·L-1
[解析] (1)加入反应药品时要先固后液,加热产生氯气,使整个装置充满氯气后,点燃 D
处酒精灯使金属铝和氯气反应。
(2)A 装置为制备氯气装置,二氧化锰和浓盐酸发生氧化还原反应得到氯气、氯化锰和水。
(3)制备氯化铝需要干燥纯净的氯气,因此制备的氯气要先经过饱和食盐水除去氯化氢、
在经过浓硫酸除去水。
(4)F 装置中盛放有浓硫酸,防止氯化铝的水解,G 装置中盛放氢氧化钠溶液吸收没有反
应完的尾气。将两装置改为盛有碱石灰的干燥管,既可保证气体干燥又可吸收尾气。
(5)氯化铝易水解,遇水将生成氢氧化铝固体和氯化氢气体,进而形成白雾。
(6) 盐 酸 和 氢 氧 化 钠 1∶1 反 应 , 容 易 求 出 剩 余 盐 酸 的 浓 度 , c(HCl) =
24.00mL×0.1000mol/L
20.00mL
×250.00mL
10.00mL
=3.00mol/L。