- 631.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学平衡图像专题
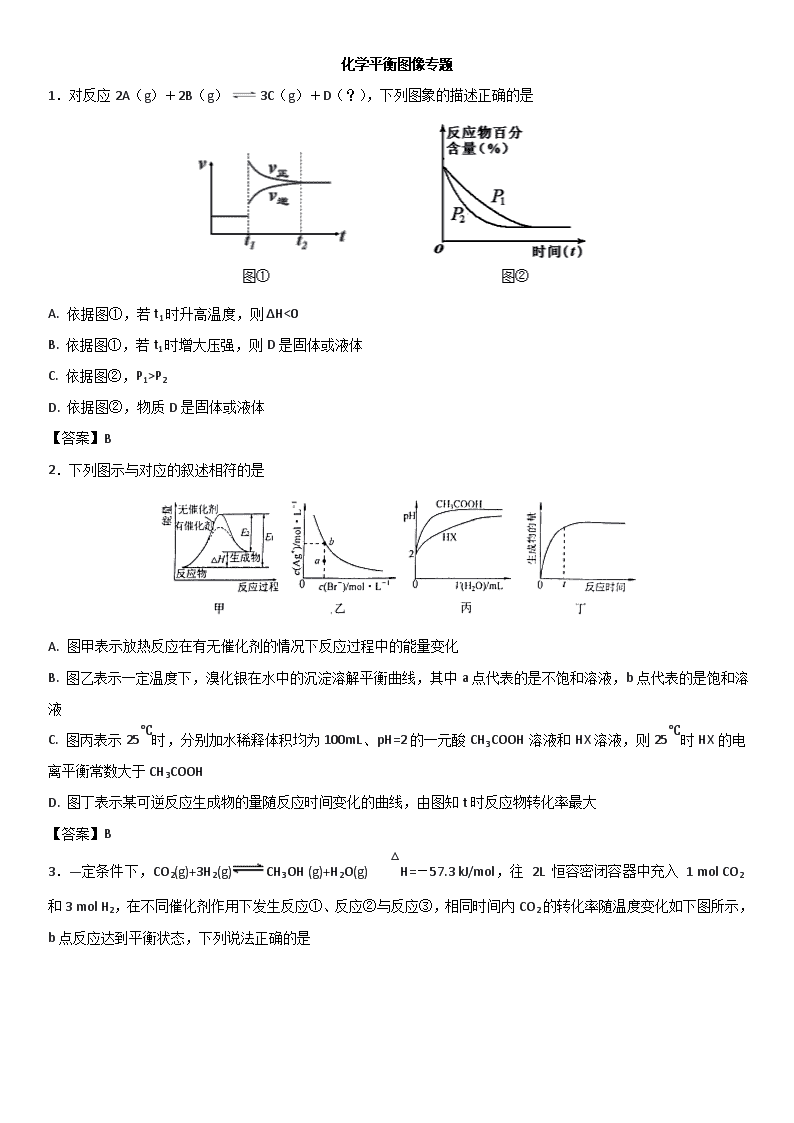
1.对反应2A(g)+2B(g)3C(g)+D(?),下列图象的描述正确的是
A. 依据图①,若t1时升高温度,则ΔH<0
B. 依据图①,若t1时增大压强,则D是固体或液体
C. 依据图②,P1>P2
D. 依据图②,物质D是固体或液体
【答案】B
2.下列图示与对应的叙述相符的是
A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化
B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液
C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH
D. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
【答案】B
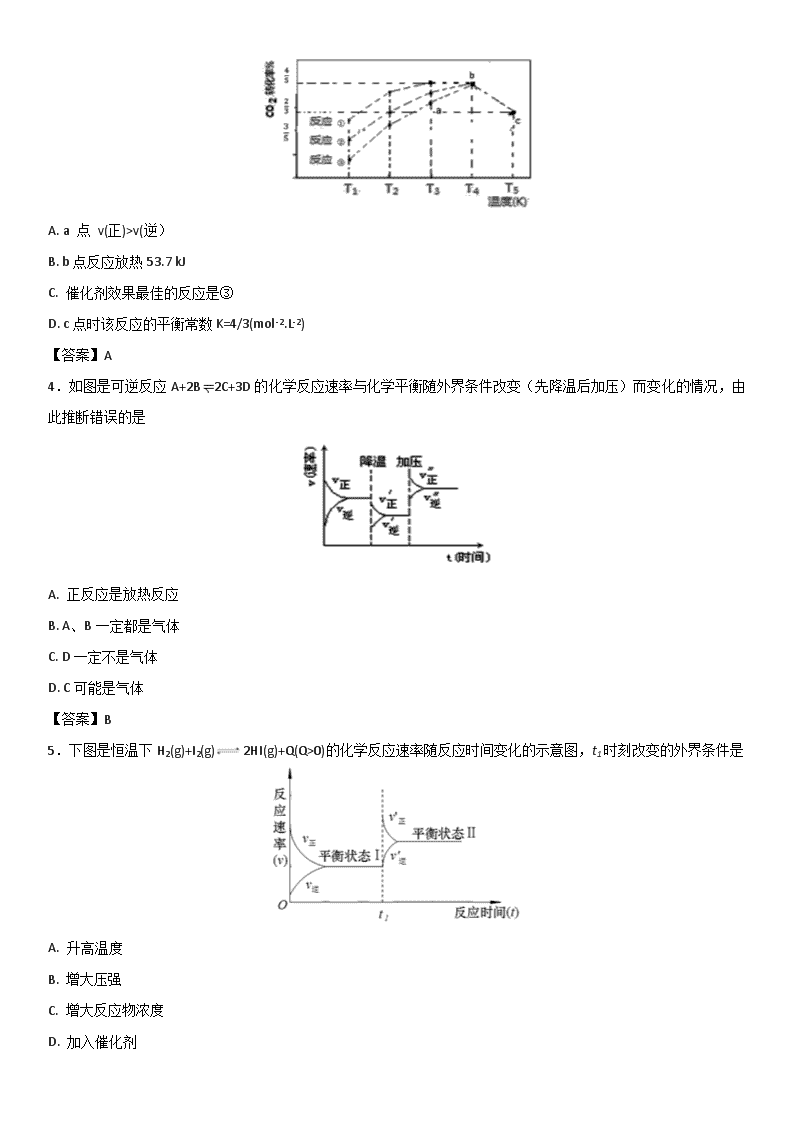
3.—定条件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
A. a 点 v(正)>v(逆)
B. b点反应放热53.7 kJ
C. 催化剂效果最佳的反应是③
D. c点时该反应的平衡常数K=4/3(mol-2.L-2)
【答案】A
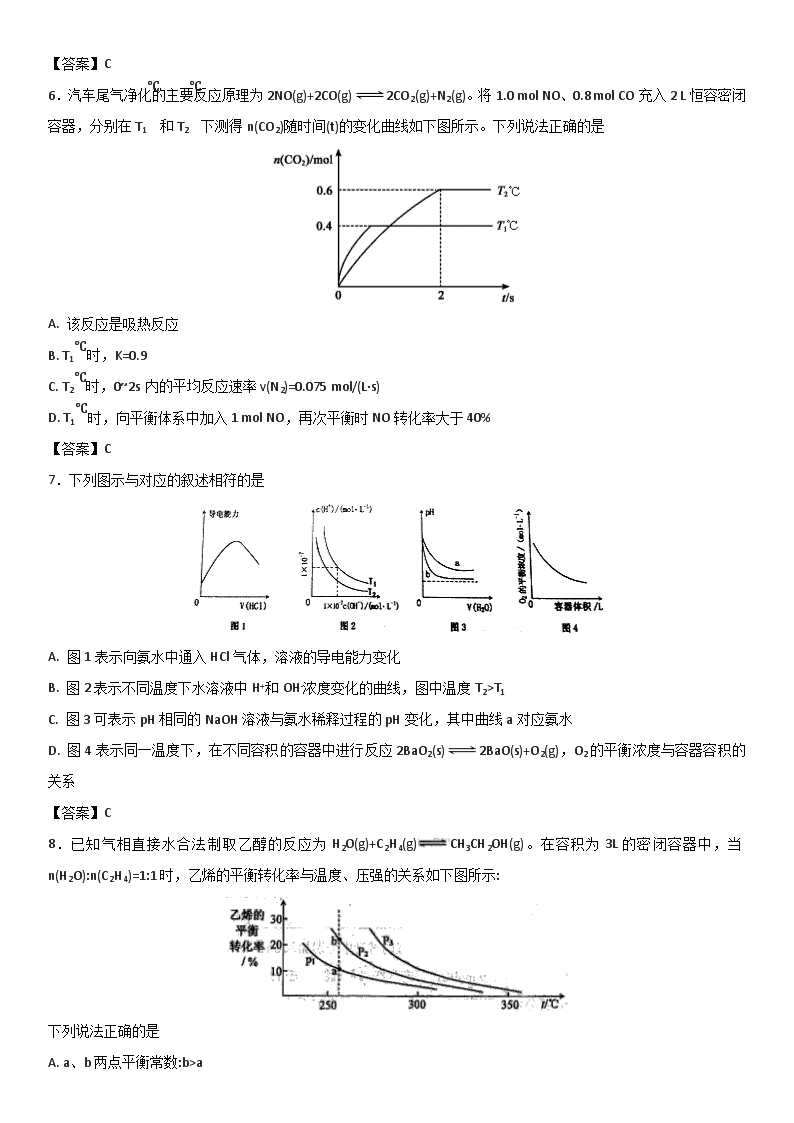
4.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
A. 正反应是放热反应
B. A、B一定都是气体
C. D一定不是气体
D. C可能是气体
【答案】B
5.下图是恒温下H2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
A. 升高温度
B. 增大压强
C. 增大反应物浓度
D. 加入催化剂
【答案】C
6.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。下列说法正确的是
A. 该反应是吸热反应
B. T1℃时,K=0.9
C. T2℃时,0~2s内的平均反应速率v(N2)=0.075 mol/(L·s)
D. T1℃时,向平衡体系中加入1 mol NO,再次平衡时NO转化率大于40%
【答案】C
7.下列图示与对应的叙述相符的是
A. 图1表示向氨水中通入HCl气体,溶液的导电能力变化
B. 图2表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1
C. 图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
【答案】C
8.已知气相直接水合法制取乙醇的反应为H2O(g)+C2H4(g)CH3CH2OH(g)。在容积为3L的密闭容器中,当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图所示:
下列说法正确的是
A. a、b两点平衡常数:b>a
B. 压强大小顺序: P1>P2>P3
C. 当混合气的密度不变时反应达到了平衡
D. 其他条件不变,增大起始投料,可提高乙烯转化率
【答案】D
9.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g).设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
A. 该反应的焓变△H>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中n(H2O)/n(CH4)=3
D. 温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
【答案】A
10.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )
A. 该反应的化学方程式为3X+Y2Z
B. 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态
C. 平衡时,体系的压强是开始时的1.8倍
D. 平衡时,Y的体积分数为50%
【答案】C
11.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是
A. 30 min~40 min 间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min 时降低温度,40 min 时升高温度
D. 30 min时减小压强,40 min时升高温度
【答案】D
12.下列说法正确的是( )
A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点的数值比b点的数值大
C. 由图丙可知,反应是吸热反应
D. 由图丁可知,反应金刚石,石墨,的焓变
【答案】A
13.工业上常用一氧化碳和氢气反应生甲醇。一定条件下,在体积为VL的密闭容器中,CO(g)+2H2(g) CH3OH(g),下图表示该反应在不同温度下的反应过程。关于该反应,下列说法正确的是
A. 反应达平衡后,升高温度,平衡常数K增大
B. 工业生产中温度越低,越有利于甲醇的合成
C. 500℃反应达到平衡时,该反应的反应速率是v(H2)= mol/(L·min)
D. 300℃反应达到平衡后,若其他条件不变,将容器体积扩大为2VL,c(H2)减小
【答案】D
14.下列关于各图像的解释或结论正确的是
A. 图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B. 图乙表示2SO2(g)+O2(g)2SO3(g) △H<0的平衡常数K与温度和压强的关系
C. 图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D. 图丁表示反应 2SO2+O2 2SO3,t1 时刻降低温度符合图示变化
【答案】D
15.反应:2X 在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示:下列判断正确的是
A.
B.
C.
D.
【答案】A
16.下列图示与对应的叙述相符的是
甲 乙 丙 丁
A. 图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH
B. 图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线
C. 图丙表示反应CH4(g)+H2O (g)CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D. 图丁表示反应2CO(g)+2NO(g)N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
【答案】D
17.在容积不变的密闭容器中存在如下反应:2SO2 (g)+O2 (g)2SO3 (g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是( )
A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅲ 表示的是温度对平衡的影响,且T甲小于T乙
C. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
D. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
【答案】C
18.T℃时,对于可逆反应:A(g)+B(g)2C(g) +D(g) △H>0。 下列各图中正确的是
【答案】D
19.如图所示为密闭容器中反应C(s)+H2O(g)CO(g)+H2(g) ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 新平衡时CO的浓度比原平衡小
D. 改变的条件是增大压强
【答案】C
20.在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2
下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
【答案】D
21.“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:
(1)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨.
①a表示____离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示______.E表示_______.
②阳极的电极反应式为___________________________________.
(2)Na2SO3溶液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO3²﹣):n(HSO3﹣)
99:1
1:1
1:99
pH
8.2
7.2
6.2
①Na2SO3溶液显______性,理由(请用离子方程式表示)_______________________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ____
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g) 2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
①图中A点时,SO2的转化率为________.
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,C点的正反应速率vc(正)与A点的逆反应速率vA (逆)的大小关系为vc(正)_____vA (逆)(填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=__________(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).
【答案】 阳 NaOH溶液 氢气 SO32﹣﹣2e﹣+H2O=2H++SO42﹣ 碱性 SO32-+H2O ⇌ HSO3-+OH- ab 45% > 24300(MPa)-1
22.氨在国民生产中占有重要的地位。工业合成氨的反应为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
时间(h)
物质的量(mol)
0
1
2
3
4
N2
1.50
n1
1.20
n3
1.00
H2
4.50
4.20
3.60
n4
3.00
NH3
0.00
0.20
n2
1.00
1.00
根据表中数据计算:
(1)反应进行到2小时时放出的热量为____________kJ。
(2)此条件下该反应的化学平衡常数K=____________(保留两位小数)。
(3)有两个密闭容器A和B,A容器保持恒容,B容器保持恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)3H2(g)+N2(g)。则:
①达到平衡所需的时间:t(A)_____t(B),平衡时,NH3的转化率:a(A)______a(B) (填“>”、“=”或“<”)。
②达到平衡后,在两容器中分别通入等量的氦气。A中平衡向_________移动,B中平衡向_________移动。(填“向正反应方向”、“向逆反应方向”、“不”)。
(4)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数[φ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是_____(填字母,下同)。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
【答案】 27.72 0.15 < < 不 向正反应方向 B
23.现将定量的H2O 与足量碳在体积可变的恒压密闭容器中发生反应:
C(s)+ H2O (g) CO(g)+H2(g) △H,测得压强、温度对CO 的平衡组成的影响如图所示。
(1)已知: 2H2 (g)+O2(g)==2H2O (g) △H1
2CO(g) + O2 (g)==2CO2(g) △H2
C(s) + O2 (g)==CO2(g) △H3
则△H=_________(用含△H1、△H2、△H3的式子表示)。
(2)①下列措施能够提高H2产率的是_______(填标号)
a.加压 b.分离出CO C.加热 d.增大碳固体的量
②a、b、c三点所对应的水的转化率最小的是______________。
(3)700℃、P3时,将1molH2O 与足量碳充入初始体积为1L的密闭容器中,恒温、恒压条件下,当反应进行到10min时,测得容器中H2的物质的量为0.12mol。
①10min内CO的平均反应速率为__________________ mol·L-1·min-1( 保 留 两 位 有 效 数 字)。
②此温度下该反应的平衡常数K___________。
③向容器中投料后,在下图中画出从0时刻到t1时刻达到平衡时容器中混合气体的平均摩尔质量的变化曲线。___________________
④从t1时刻开始,保持温度不变,对容器加压,混合气体平均摩尔质量从t2时刻后变化如上图,出现该变化的原因是____________________________________________。
【答案】 △H 3-1/2△H1-1/2△H2 bc b 0.011 0.8 (起点必须=18开始) 压强增大,水蒸气液化
24.400 ℃时,某密闭容器中有X、Y、Z三种气体,从反应开始到达到平衡时各物质浓度的变化如图甲所示(假定反应向正反应方向进行)。图乙为相应时刻仅改变反应体系中某一条件后正、逆反应速率随时间变化的情况。
(1)反应从开始至平衡时v(X)=________________;A、B、C三点的逆反应速率由大到小的顺序为_______________________________________________。
(2)若t3 s时改变的条件是降低压强,则Z物质的起始浓度是________;400 ℃时该反应的平衡常数为________。
(3)t4 s时改变的条件是________,若该反应具有自发性,则此时平衡向________________(填“正反应方向”或“逆反应方向”)移动。
(4)在图乙中绘制出t6 s时向容器中加入一定量X后建立新平衡的过程中(压强保持不变)正、逆反应速率的变化曲线并注明速率类型。____________________
(5)研究表明,该反应经过如下几个阶段:
3X(g)2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)Z(g) ΔH3
试写出X、Y、Z间反应的热化学方程式________________________________________。
【答案】 0.09 mol·L-1·s-1 C>B>A 0.2 mol·L-1 (或3.33) 升高温度 逆反应方向 3X(g)2Y(g)+Z(g) ΔH=ΔH1+2ΔH2+ΔH3
25.“低碳生活”是生态文明的前提和基础,减少二氧化碳的排放是“低碳”的一个重要方面,因此,二氧化碳的减排已引起国际社会的广泛关注。请回答下面二氧化碳回收利用的有关问题:
I.利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇时发生的主要反应是:CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)若二氧化碳加氢制甲醇反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到1,时刻达到平衡状态的是____________(填字母编号)
(2)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的△H=_____。
(3)在2L恒容密闭容器a和b中分别投入2molCO2和6molH2在不同温度下进行二氧化碳加氢制甲醇反应,各容器中甲醇的物质的量与时间关系如图2所示:
①若实验a、实验b的反应温度分别为T1、T2,则判断T1_____T2 (选填”>”、“<”或“=”)。若实验b中改变条件时,反应情况会由曲线b变为曲线c,则改变的条件是________。
②计算实验b条件下,0--10min段氢气的平均反应速率v(H2) = _____mol/(L·min)。
③在实验b条件下,该反应的平衡常数为_________。若平衡时向容器再充入1mol CO2和3molH2,重新达平衡时,混合气体中甲醇的物质的量分数______30%(选填“>”“ <” 或“=” )。
II.右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH 和O2 的原理示意图。
(4)催化剂a表面发生的电极反应式_________。
(5)标准状况下每回收44.8 L CO2转移的的电子数为_______个。
(6)常温下,0.1mol/L的HCOONa溶液的pH 为10,则常温下,HCOOH 的电离常数Ka 约为__________。
【答案】 bc -46kJ·mol-1 > 加入催化剂 0.225 (或5.33) > 2H2O - 4e- == O2↑+4H+ 2.408×1024(或4NA) 10-7