- 365.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014 高考化学考前阅读之四
化学反应中的能量变化
一、反应热:
主要考点:热化学方程式的书写;用盖斯定律进行有关反应热的简单计算。
【知识点】
化学反应中的能量变化主要是化学能和热能以及电能的转化,人类现在使用中的大部分
能量是来自于太阳能
反应热仅与反应体系的始状态和终状态有关,与反应的途径无关。(盖斯定律)。
△H 与化学方程式相对应,与反应量无关,与是否可逆无关。反应方程式确定,△H 确
定。
【例 1】将盛有 NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加
入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3 和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
2.热化学方程式
【知识点】
①反应热与化学反应方程式相对应;正、逆反应过程的反应热数值相等,符号相反;可逆反应的
△H 指完全反应时的反应热,与起始加入的量和实际反应的量无关。
②必须标明反应物和生成物的聚集状态,同素异形体还要写名称、稀溶液用(aq)表示
③必须注明△H 的“+”“ -”; 单位:一般为 kJ·mol-1
④△H 与转化率对应的简单计算是考查热点
【例 2】用 Cl2 生产某些含氯有机物时会产生副产物 HC1。利用反应 A,可实现氯的循环利
用。
反应 A: 4HCl+O2 2Cl 2+2H2O
已知:反应 A 中,2 mol Cl 2 和 2mol H2O 充分反应达平衡时,吸收 57.8kJ 的热量,此时 Cl 2 的转
化率为 50%,则反应 A 的热化学方程式是_______________
3.盖斯定律
【知识点】
①根据盖斯定律可计算某些难以直接测量的反应的焓变
②△H 与能量利用率、转移电子数等相对应的简单计算是考查热点
③应用盖斯定律计算反应热的一般方法:加减法
注意:已知反应不一定全部用到。
【例 3】
1.已知:某条件下,①N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
②N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
③2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
工业上利用氨的催化氧化来制备生产硝酸所需要的 NO,同时生成气态水。请结合上述
反应,写出该反应的热化学方程式______________________________________;若该反
应放出的热量为 226.3 kJ,则有_______g 氨气参加反应,转移的电子数为 ,用
这些热量在合适条件下转化成电能并放电引发反应①,共生成 0.2mol NO,则能量利用
率为__________。
2.工业上利用天然气(主要成分为 CH4)与 CO2 进行高温重整制备 CO,已知 CH4、H2 和 CO 的燃烧
热(△H)分别为 —890.3 KJ·mol-1、—285.8 KJ·mol-1、—283.0 KJ·mol-1,则生成 1 m3(标准
状况)CO 所需热量为 ;
二、电化学
主要考点:电极、电极材料、电极产物;电子、离子、电流移动方向;电极、电池反
应书写;电解质溶液 pH 计算;金属的腐蚀、防护;电解产物量、能量转化计算
1.原电池和电解池工作原理及电极反应式的书写
【规律】
①二次电池(蓄电池)放电时为原电池,充电时为电解池,原电池的两电极名称为正、
负极,电解池的两电极为阴、阳极,阴极、正极为还原反应;阳极、负极为氧化反应。
②以 H2、CO、CH4、C2H6、CH3OH、SO2 为燃料的燃料电池,通入燃料的一极为负极,
燃料 CO、CH4、C2H6、CH3OH 等在不同的电解质溶液中反应的产物分别为:
通入 O2 的一极为正极,通入 O2 的一极电极反应为:
③书写电极反应式的规律:写产物(从化合价变化入手分析,关注阳极,关注放电顺序,
关注目标产物)配守恒(化合价升降守恒)看介质,平氢氧(电极产物在电解质溶液
的环境中,应该能够稳定存在,如碱性介质中生成的 H+应该让其结合 OH-生成水,同
时遵循电子守恒和质量守恒)。
④计算反应物和产物的量、溶液的 pH、转移电子数等:注意找准反应中各物质间量的
关系,善于利用电子守恒和质量守恒规律。两极附近溶液的 pH 变化关键看离子(或
分子)的放电规律
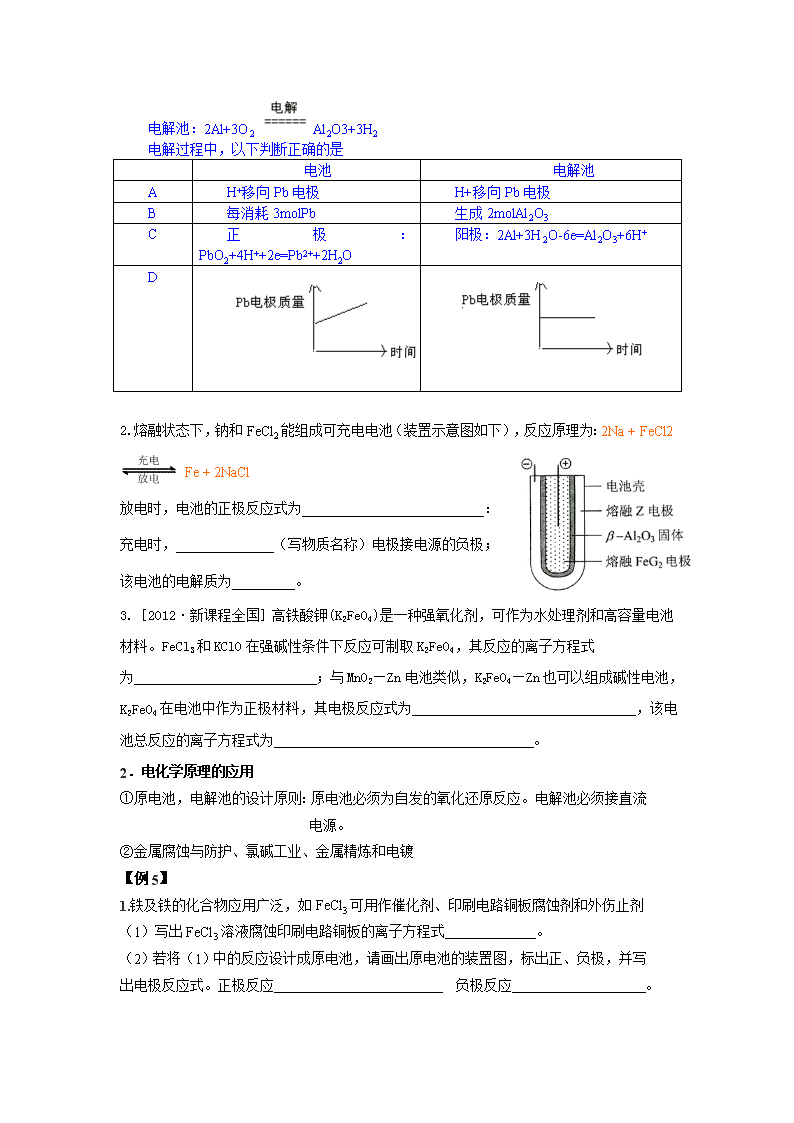
【例 4】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以 Al 作阳极、Pb 作阴极,电
解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)
电解质为酸性溶液或固体氧化物或熔融碳酸盐:CO2
电解液为碱性:CO32-
电解池:2Al+3O2 Al2O3+3H2
电解过程中,以下判断正确的是
电池 电解池
A H+移向 Pb 电极 H+移向 Pb 电极
B 每消耗 3molPb 生成 2molAl2O3
C 正 极 :
PbO2+4H++2e=Pb2++2H2O
阳极:2Al+3H2O-6e=Al2O3+6H+
D
2.熔融状态下,钠和 FeCl2 能组成可充电电池(装置示意图如下),反应原理为:2Na + FeCl2
Fe + 2NaCl
放电时,电池的正极反应式为__________________________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为_________。
3.[2012·新课程全国]高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池
材料。FeCl3 和 KClO 在强碱性条件下反应可制取 K2FeO4,其反应的离子方程式
为 ;与 MnO2—Zn 电池类似,K2FeO4—Zn 也可以组成碱性电池,
K2FeO4 在电池中作为正极材料,其电极反应式为 ,该电
池总反应的离子方程式为 。
2.电化学原理的应用
①原电池,电解池的设计原则:原电池必须为自发的氧化还原反应。电解池必须接直流
电源。
②金属腐蚀与防护、氯碱工业、金属精炼和电镀
【例 5】
1.铁及铁的化合物应用广泛,如 FeCl3 可用作催化剂、印刷电路铜板腐蚀剂和外伤止剂
(1)写出 FeCl3 溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写
出电极反应式。正极反应 负极反应 。
充电
放电
思考:若要设计装置完成反应 Cu+2H2O=Cu(OH)2+H2.说出装置名称并指出两极及
材料,电解质溶液?
2.(1)以铝材为阳极,在 H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为
____________________________________________。
(2) MnO2 的生产方法之一是以石墨为电极,电解酸化的 MnSO4 溶液。阴极的电极反
应式是 。若电解电路中通过 2mol 电子,MnO2 的理论产量为
(3)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______。
(4)工业上电解硫酸锌溶液可实现电解法炼锌(控制条件,使 H+难放电、阳极电极不
溶解)。写出相关的电解化学方程式: 。
将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐
蚀能力。镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的 极发生
反应而损耗,铁受到保护。
(5)V2O5 的催化循环机理可能为:V2O5 氧化 SO2 时,自身被还原为四价钒化合物;
四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 。