- 908.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2015《金版新学案》高中化学总复习讲义:专题一 第一单元 物质的组成、分类、转化与分散系
考点一 物质的组成
1.元素与物质的组成
(1)宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
(2)元素:具有相同核电荷数的一类原子的总称。
(3)元素与物质的关系
元素
(4)元素在物质中的存在形态
①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
2.同素异形体
3.混合物和纯净物
(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
(1)由同种元素组成的物质一定是纯净物吗?
(2)H2与H互为同素异形体吗?
提示: (1)不一定,如O2和O3混合在一起虽然只含氧元素,但属于混合物。
(2)不属于同素异形体,因为H不属于单质。
1.下列化学式能真实表示物质分子组成的是( )
A.SiO2 B.NaCl C.Fe D.CH3Cl
答案: D
2.判断下列说法是否正确?不正确的说明理由。
(1)元素在自然界中的存在形式有原子、分子或离子。
(2)同一种元素可能有多种不同原子,同一种原子也可能形成不同的离子。
(3)由同一种元素组成的物质一定是同一种物质。
(4)物质的化学性质一定是由分子保持的。
答案: (1)(2)均正确。
(3)错误,金刚石和石墨均由碳元素组成,是两种不同物质。
(4)错误,由分子组成的物质,分子是保持物质化学性质的粒子,否则,保持物质化学性质的粒子不是分子,如NaCl等。
3.下列物质属于纯净物的是( )
A.铝热剂 B.水玻璃
C.漂白粉 D.冰水混合物
答案: D
4.下列物质中肯定为纯净物的是 ( )
A.只由一种元素组成的物质
B.只由一种原子组成的物质
C.只由一种分子组成的物质
D.只由一种元素的阳离子与另一种元素的阴离子组成的物质
答案: C
常见的混合物
(1)分散系(如溶液、胶体、浊液等);
(2)高分子(如蛋白质、纤维素、聚合物、淀粉等);
(3)常见特殊名称的混合物:石油、石油的各种馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热剂等。考点二 物质的性质和变化
1.物质的性质
物理性质
化学性质
概念
物质不经化学变化就能表现出来的性质
物质在化学变化中才能表现出来的性质
实例
可由感官直接感知的:颜色、状态、光泽、晶形、挥发性、气味等
需用仪器测知的:密度、硬度、熔点、沸点、溶解性、导电性、传热性、延展性等
氧化性、还原性、酸性、碱性、热稳定性、可燃性等
的2.物理变化和化学变化的判断
(1)化学变化中一定存在着化学键的断裂与形成,但存在化学键断裂的变化不一定是化学变化,如HCl溶于水,熔融氯化钠的电离等是物理变化。
(2)化学变化中常伴随着发光、放热和颜色变化,但有发光、放热或颜色变化的变化不一定是化学变化,如焰色反应、NaOH溶于水放热、活性炭吸附作用使物质褪色等是物理变化。
(3)原子是化学变化中的最小微粒,即在化学反应中原子的原子核是不发生变化的。核裂变或核聚变会产生新原子,但这是物理学研究的范畴,不属于中学化学意义上的物理变化或化学变化。
(1)化学变化中一定存在化学键的断裂和形成,有化学键断裂或形成的变化是否一定是化学变化?
(2)核裂变、核聚变均有新物质生成,是否是化学变化?
提示: (1)有化学键断裂或形成的变化不一定是化学变化,如金属熔化、NaCl溶于水、NaCl晶体从溶液中析出、从浓盐酸中挥发出HCl气体等中虽有化学键断裂或形成但仍属于物理变化。
(2)不是。化学变化研究的前提是原子核不变,核变化虽有新物质生成,但由于原子核发生了变化,所以不是化学变化。
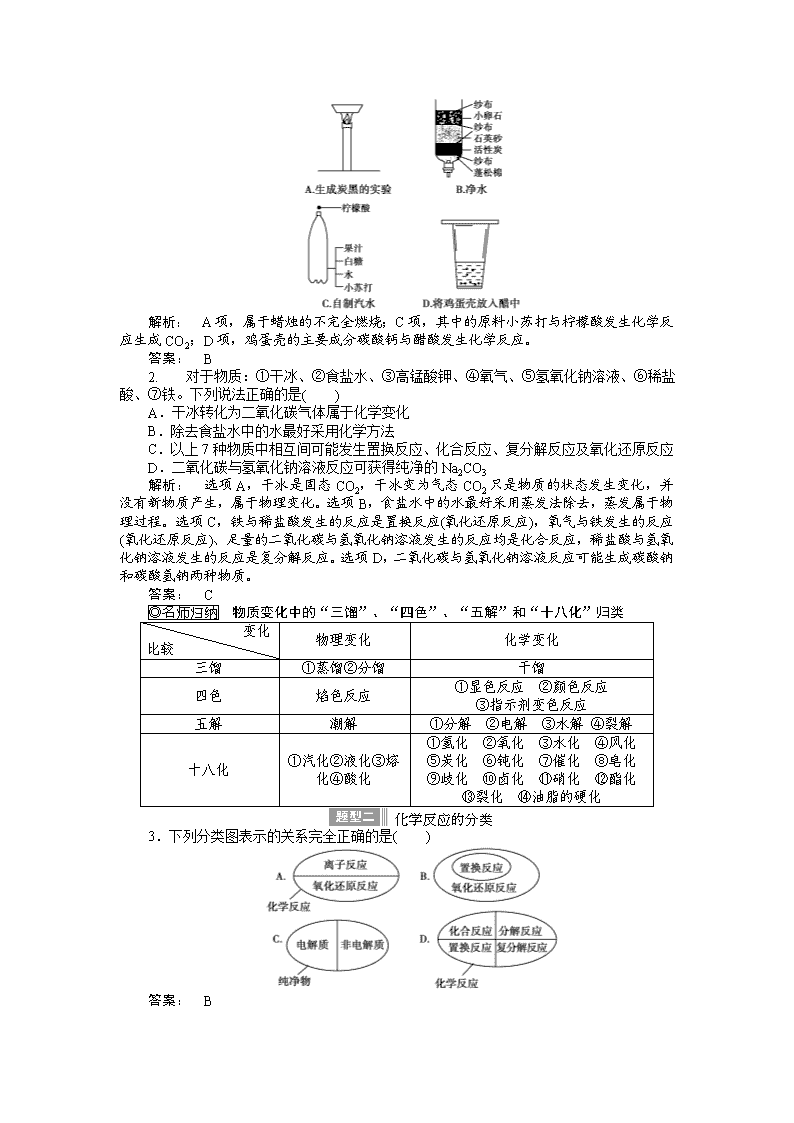
1.下图所示的家庭小实验中,主要发生物理变化的是( )
解析: A项,属于蜡烛的不完全燃烧;C项,其中的原料小苏打与柠檬酸发生化学反应生成CO2;D项,鸡蛋壳的主要成分碳酸钙与醋酸发生化学反应。
答案: B
2. 对于物质:①干冰、②食盐水、③高锰酸钾、④氧气、⑤氢氧化钠溶液、⑥稀盐酸、⑦铁。下列说法正确的是( )
A.干冰转化为二氧化碳气体属于化学变化
B.除去食盐水中的水最好采用化学方法
C.以上7种物质中相互间可能发生置换反应、化合反应、复分解反应及氧化还原反应
D.二氧化碳与氢氧化钠溶液反应可获得纯净的Na2CO3
解析: 选项A,干冰是固态CO2,干冰变为气态CO2只是物质的状态发生变化,并没有新物质产生,属于物理变化。选项B,食盐水中的水最好采用蒸发法除去,蒸发属于物理过程。选项C,铁与稀盐酸发生的反应是置换反应(氧化还原反应),氧气与铁发生的反应(氧化还原反应)、足量的二氧化碳与氢氧化钠溶液发生的反应均是化合反应,稀盐酸与氢氧化钠溶液发生的反应是复分解反应。选项D,二氧化碳与氢氧化钠溶液反应可能生成碳酸钠和碳酸氢钠两种物质。
答案: C
物质变化中的“三馏”、“四色”、“五解”和“十八化”归类
变化
比较
物理变化
化学变化
三馏
①蒸馏②分馏
干馏
四色
焰色反应
①显色反应 ②颜色反应
③指示剂变色反应
五解
潮解
①分解 ②电解 ③水解 ④裂解
十八化
①汽化②液化③熔化④酸化
①氢化 ②氧化 ③水化 ④风化 ⑤炭化 ⑥钝化 ⑦催化 ⑧皂化 ⑨歧化 ⑩卤化 ⑪硝化 ⑫酯化 ⑬裂化 ⑭油脂的硬化
3.下列分类图表示的关系完全正确的是( )
答案: B
4.现有下列五种气体:H2、O2、NO、NH3、NO2,以上气体的制备反应中,有一反应在原理上与其他反应都不能归为同一类型,请写出实验室制取该气体的化学方程式:________________________________________________________________________
________________________________________________________________________。
解析: H2、O2、NO、NO2这四种气体,通常由氧化还原反应制备。而NH3是由铵盐和碱反应制备的,属于复分解反应,不属于氧化还原反应。
答案: 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O考点三 物质的分类
1.分类方法
(1)交叉分类法
利用交叉分类法对下列物质分类,在物质与物质类别之间连线。
(2)树状分类法
请把下列物质的序号填写到下图的括号中。
①硫黄 ②HClO ③苛性钠 ④铁 ⑤小苏打 ⑥氧化钠
2.熟记常见无机化合物的分类
无机化合物
(1)CO、NO是非金属氧化物吗?CO、NO是酸性氧化物吗?
(2)Na2O2、Al2O3是金属氧化物吗?Na2O2、Al2O3是碱性氧化物吗?
(3)能在水溶液中电离出H+的化合物一定是酸吗?
提示: (1)CO、NO是非金属氧化物,但不是酸性氧化物。
(2)Na2O2、Al2O3是金属氧化物,但不是碱性氧化物。
(3)不一定,如NaHSO4属于酸式盐。
1.表中关于物质分类的正确组合是( )
类别
组合
酸性氧化物
碱性氧化物
酸
碱
盐
A
CO2
SiO2
H2SO4
Na2CO3
NaHCO3
B
CO
Na2O
HCl
NaOH
NaCl
C
SO2
Na2O2
CH3COOH
KOH
CaF2
D
SO3
CaO
HNO3
Ca(OH)2
CaCO3
解析: 可采用排除选项的方法,A中SiO2为酸性氧化物,Na2CO3为盐;B中CO为不成盐氧化物;C中Na2O2与酸反应,生成相应的盐、水和O2,不是碱性氧化物。
答案: D
2.下列有关物质的分类或归类中正确的是( )
A.化合物:HT、CaCl2、NaOH、盐酸
B.纯净物:水玻璃、胆矾晶体、液氯、硫酸
C.天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D.同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
解析: 本题主要考查物质的分类,意在考查考生对物质的分类的实际应用能力。HT是单质,盐酸是混合物,A项错误;水玻璃是硅酸钠的水溶液,属于混合物,B项错误;聚氯乙烯是合成高分子化合物,C项错误。
答案: D
3.判断下列说法是否正确,若不正确,请简述理由。
(1)非金属氧化物一定是酸性氧化物。
(2)酸性氧化物不一定是非金属氧化物。
(3)金属氧化物一定是碱性氧化物。
(4)碱性氧化物一定是金属氧化物。
(5)Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物。
(6)能与酸反应生成盐和水的氧化物一定是碱性氧化物。
(7)能与碱反应生成盐和水的氧化物一定是酸性氧化物。
答案: (1)错误,如NO、CO是不成盐氧化物。(2)正确。
(3)错误,如Mn2O7是酸性氧化物。(4)正确。(5)错误,Na2O2与H2O反应除生成NaOH外,还生成O2,不符合碱性氧化物的定义。(6)、(7)错误,如Al2O3。
氧化物的分类
4.(2013·济宁模拟)下列分类正确的是( )
A.Na2O、MgO、Al2O3均属于碱性氧化物
B.石灰石、生石灰、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示
解析: Al2O3属于两性氧化物,A错;石灰石、生石灰、熟石灰分别属于盐、碱性氧化物和碱,B错;反应3Fe(OH)2+10HNO3===3Fe(NO3)3+NO↑+8H2O属于氧化还原反应,而不属于复分解反应,C错;胶体属于分散系,而分散系属于混合物,D正确。
答案: D
5.化学概念在逻辑上存在如下关系:
对下列概念的说法正确的是( )
A.化合物与电解质属于重叠关系
B.化合物与碱性氧化物属于交叉关系
C.溶液与胶体属于并列关系
D.离子化合物和电解质属于交叉关系
解析: 化合物与电解质属于包含关系,A错;化合物与碱性氧化物属于包含关系,B错;离子化合物与电解质属于包含关系。
答案: C
6.能实现下列物质间直接转化的元素是( )
单质氧化物酸或碱盐
A.硅 B.硫
C.铜 D.铁
解析: SiO2与水不能反应,A错误;铜和铁对应的氧化铜、氧化铁不能直接和水反应,C、D错误;SSO2H2SO3Na2SO3,B正确。
答案: B
7.盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是( )
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥
C.②⑤⑥ D.全部
解析: 金属单质与酸反应生成对应的盐和H2;碱性氧化物与酸反应生成盐和水;碱与酸(或酸性氧化物)反应生成盐;非金属单质与金属化合可得到盐;酸性氧化物或酸与碱(或碱性氧化物)反应生成盐。
答案: D
单质、氧化物、酸、碱和盐的转化关系
单质、氧化物、酸、碱、盐是中学阶段学习的五类重要物质,对它们之间的相互转化关系应熟练掌握并能灵活运用。其转化关系如下图所示:
常见的直线型转化关系:
①金属碱性氧化物碱盐
满足上述关系的有K、Na、Ca、Ba等。
②非金属酸性氧化物酸盐
满足上述关系的有C、S、P等。
③ABC酸(或碱)
满足上述关系的有NH3、N2、H2S、S、C、Na等。考点四 分散系 胶体
1.分散系的分类
2.胶体的性质
(1)丁达尔效应
当可见光束通过胶体时,在胶体中出现一条光亮的“通路”。产生丁达尔效应的原因是胶体粒子对光线有散射作用。
(2)电泳
胶体粒子可以通过吸附而带有电荷,在电场的作用下,胶体粒子在分散系里作定向移动。
(3)聚沉
胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出的过程。
使胶体聚沉的方法
3.Fe(OH)3胶体的制备
(1)过程:向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热,即制得Fe(OH)3胶体。
(2)化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(1)在江河入海口为什么会形成三角洲?
(2)往Fe(OH)3胶体中逐滴加入稀硫酸过量,实验过程中可能观察到哪些现象?
(3)水泥厂、冶金厂常用的静电除尘是利用了胶体的哪些性质?
(4)医疗上进行血液透析的原理是什么?
提示: (1)胶体遇盐溶液(海水)时发生聚沉而形成三角洲。
(2)先出现红褐色沉淀,后随H2SO4的加入沉淀又完全溶解。
(3)烟尘胶体粒子带有电荷,能发生胶体粒子的电泳现象而达到静电除尘的目的。
(4)利用的是蛋白质、血细胞的微粒直径大于毒性物质的微粒直径、即胶体颗粒不能透过半透膜的原理。
1.下列液体中,不会出现丁达尔效应的分散系是( )
①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液
⑤Fe(OH)3溶胶 ⑥肥皂水
A.①③ B.②⑥
C.② D.④
解析: ②中水属于纯净物,不属于分散系;④中物质属于溶液,剩余物质均属于胶体。
答案: D
蛋白质溶液、淀粉溶液、肥皂水均属于胶体。
2.下列实验与物质微粒大小无直接关系的是( )
答案: C
3.某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
A.利用过滤的方法,可将Z中固体与液体分离
B.X、Z烧杯中分散质相同
C.Y中反应的离子方程式为3CaCO3+2Fe3++3H2O===2Fe(OH)3(胶体)+3CO2↑+3Ca2+
D.Z中分散系能产生丁达尔效应
答案: B
4.下列事实与胶体性质无关的是( )
A.由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
C.明矾可用作净水剂
D.臭氧、Cl2均可用于水的消毒净化
解析: 臭氧、Cl2用于水的消毒净化是因为臭氧、Cl2和H2O反应生成的HClO具有强氧化性,与胶体的性质无关。
答案: D
胶体与溶液、浊液的比较
分散系
溶液
胶体
浊液
分散质粒子
单个小分子或离子
高分子或多分子集合体
巨大数目的分子集合体
分散质粒子直径
小于1 nm
1~100 nm
大于100 nm
性
质
外观
均一、透明
均一
不均一、不透明
稳定性
稳定
较稳定
不稳定
能否透过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
鉴别
无丁达尔效应
有丁达尔效应
静置分层或沉淀
1.(2013·天津理综·1)运用有关概念判断下列叙述正确的是( )
A.1 mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C.OH和CH2OH互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
解析: 燃烧热是指101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,A选项没有说明生成物的状态,故错误;有化合价变化的反应(或有电子转移的反应)为氧化还原反应,B项正确;苯酚和苯甲醇是两类不同的物质,不是同系物,C项错误;虽然硫酸钡的水溶液不易导电,但溶解于水中的硫酸钡能完全电离,所以硫酸钡为强电解质,D项错误。
答案: B
2.(2012·新课标全国卷·8)下列说法正确的是( )
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转变为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
解析: A项中医用酒精的浓度为75%,错误;B项中单质硅用于太阳能电池,正确;C项中油脂是小分子化合物,不是高分子化合物,错误;D项中合成纤维是有机材料,不是无机非金属材料,错误。
答案: B
3.(2012·山东高考题重组)下列说法正确的是( )
A.化合反应均为氧化还原反应(7A)
B.金属氧化物均为碱性氧化物(7B)
C.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体(8B)
D.石油是混合物,其分馏产品汽油为纯净物(7D)
解析: 有单质参加的化合反应为氧化还原反应,否则不一定为氧化还原反应,如CaO+H2O===Ca(OH)2等;大多数金属氧化物为碱性氧化物,但也有的是酸性氧化物,如Mn2O7等,也有的是两性氧化物,如Al2O3等;石油是混合物,其分馏产品汽油仍为混合物。
答案: C
4.(2013·四川理综·2)下列物质分类正确的是( )
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
解析: 酸性氧化物是指能和碱反应生成盐和水的氧化物,CO不属于酸性氧化物,A项错误;氯化铁溶液不是胶体,B项错误;四氯化碳为非电解质,C项错误;福尔马林是35%~40%的甲醛水溶液,属于混合物,水玻璃是硅酸钠的水溶液,属于混合物,氨水是氨气溶于水形成的混合物,D项正确。
答案: D
5.判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+(2011·北京理综,9C)( )
(2)沸水中滴加适量饱和氯化铁溶液,形成带电的胶体,导电能力增强(2012·重庆理综,10D)( )
(3)“血液透析”利用了胶体的性质(2012·四川理综,6C)( )
(4)“钡餐”中使用的硫酸钡是弱电解质(2009·广东,5③)( )
(5)葡萄糖注射液不能产生丁达尔现象,不属于胶体(2011·山东理综,9D)( )
(6)依据丁达尔现象可将分散系分为溶液、胶体与浊液(2010·福建理综,8C)( )
答案: (1)√ (2)× (3)√ (4)× (5)√ (6)×
阅卷现场(一)__考查胶体时常见错例剖析
Fe3O4又称磁性氧化铁,请根据要求完成下列问题。
(1)Fe3O4固体(黑色)可以写成Fe2O3·FeO,属于________(填“混合物”或“纯净物”)。将其加入适量盐酸,所发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)向(1)所得溶液中通入过量氯气后,用此溶液进行以下实验:
取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________,
此反应属于________________________________________________________________________。
(3)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸直至溶液呈________色,即可制得Fe(OH)3胶体。
(4)取另一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到__________烧杯中的液体产生丁达尔效应,这个实验可以用来区别________________________________________________________________________
______________。
[阅卷记录]
问题
常见错误
第(1)问
①Fe3O4与盐酸反应的化学方程式中产物容易漏写FeCl2;
②错误认为Fe3O4属于“混合物”
第(2)问
书写化学方程式时容易漏标沉淀符号“↓”
第(4)问
答成“甲”
[错因剖析]
(1)Fe3O4中铁元素有+3价、+2价两种价态,与盐酸反应时应该同时有FeCl3和FeCl2生成。Fe3O4虽然写成Fe2O3·FeO,但它是纯净物,若对纯净物和混合物的概念理解不透,容易错答。
(2)书写化学方程式时注意反应条件、生成物状态要齐备,易漏沉淀符号“↓”会造成错误。
(4)丁达尔效应是胶体的特性,此性质常用来鉴别溶液和胶体,若记忆不清会造成错答。
正确解答: (1)纯净物 Fe3O4+8HCl===2FeCl3+FeCl2+4H2O
(2)FeCl3+3NaOH===Fe(OH)3↓+3NaCl 复分解反应
(3)红褐 (4)乙 胶体和溶液