- 150.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题 沉淀溶解平衡
【模拟试题】(答题时间:60分钟)
1. 下列对沉淀溶解平衡的描述正确的是( )
A. 反应开始时,溶液中各离子浓度相等
B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
2. 下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少许稀硫酸时,都能产生白色沉淀的是( )
A.
B.
C.
D.
3. 大理石可以用作墙面、地面和厨房桌面,其主要成分是碳酸钙,食醋不慎滴在大理石桌面上,会使其失去光泽,变得粗糙,下列能正确解释此现象的是( )
A. 食醋中的水使碳酸钙溶解
B. 食醋中的醋酸将碳酸钙氧化
C. 食醋中的醋酸与碳酸钙反应并放出大量的二氧化碳气体
D. 食醋中的醋酸与碳酸钙发生了复分解反应
4. 有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进行实验,(1)逐滴加入盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液;(2)加热试管中的白色粉末,试管口有水滴凝结;(3)逐滴加入硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白色不溶物。
下列混合物中符合以上实验现象的是( )
A. B.
C. D.
5. 对于表达式,下列描述正确的是( )
A. 说明难电离
B. 说明不难溶解
C. 这是电离方程式
D. 这是沉淀溶解平衡表示式
6. 把氢氧化钙放入蒸馏水中,一定时间后达到下列溶解平衡:
+,加入下列物质,可使固体减少的是( )
A. B. NaOH C. D. NaCl
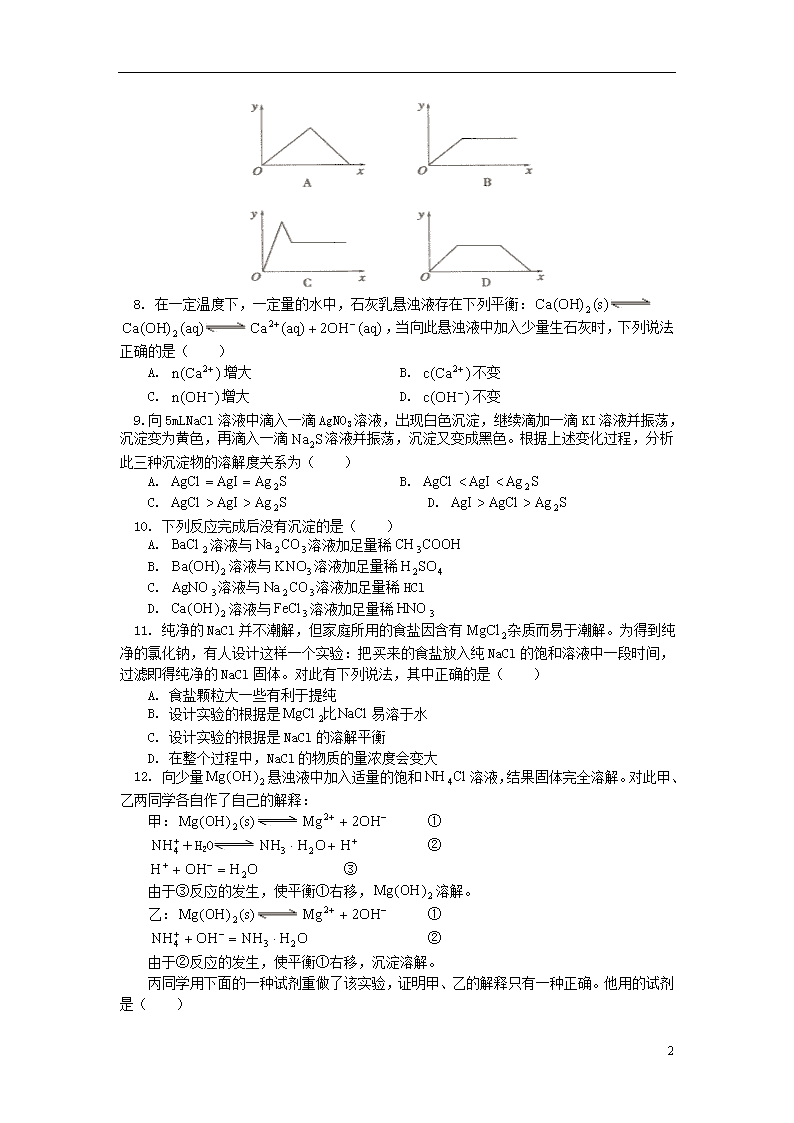
7. 在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(x)与溶液中沉淀的物质的量(y)的关系示意图正确的是( )
4
8. 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:
,当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
A. 增大 B. 不变
C. 增大 D. 不变
9. 向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
A. B.
C. D.
10. 下列反应完成后没有沉淀的是( )
A. 溶液与溶液加足量稀
B. 溶液与溶液加足量稀
C. 溶液与溶液加足量稀HCl
D. 溶液与溶液加足量稀
11. 纯净的NaCl并不潮解,但家庭所用的食盐因含有杂质而易于潮解。为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。对此有下列说法,其中正确的是( )
A. 食盐颗粒大一些有利于提纯
B. 设计实验的根据是易溶于水
C. 设计实验的根据是NaCl的溶解平衡
D. 在整个过程中,NaCl的物质的量浓度会变大
12. 向少量悬浊液中加入适量的饱和溶液,结果固体完全溶解。对此甲、乙两同学各自作了自己的解释:
甲: ①
+H2O ②
③
由于③反应的发生,使平衡①右移,溶解。
乙: ①
②
由于②反应的发生,使平衡①右移,沉淀溶解。
丙同学用下面的一种试剂重做了该实验,证明甲、乙的解释只有一种正确。他用的试剂是( )
4
A. B. C. D. 氨水
13. 向含有AgI的饱和溶液中:
(1)加入固体,则__________(填“变大”、“变小”或“不变”,下同。)
(2)若改加更多的AgI,则将_____________________。
(3)若改加AgBr固体,则_______________,而__________________。
14. 试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)难溶于稀硫酸,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤沉淀,用水洗涤造成的损失量大于用稀硫酸洗涤的损失量。
15. 用化学反应速率与化学平衡及平衡移动的原理可以分析诸类平衡,如:(电离平衡)、(溶解平衡)、(络合平衡)等。难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系。例如AgCl在水中存在平衡:AgCl。在一定温度下,饱和溶液中的物质的量浓度和的物质的量浓度的乘积为一常数,可用表示。已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:(aq)+;
。在火力发电厂燃烧煤的废气中往往含有等。为了除去有害气体并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
思考题:
(1)写出上述两个反应的化学方程式。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由。
4
【试题答案】
1. B 2. C 3. D 4. D 5. BD 6. C
7. C 8. BD 9. C 10. AD 11. C 12. B
13. (1)变小 (2)不变 (3)变小 变大
14. (1),加入稀盐酸后,,破坏了FeS的溶解平衡,使上述平衡向正方向移动,故FeS溶解。
(2),在稀硫酸中生成的微溶,附着在的表面,很难破坏的溶解平衡,故难溶于稀。而在醋酸中,=,破坏了的溶解平衡,故能溶于醋酸。
(3),用水洗涤使的溶解平衡向正方向移动,造成的损失;而用洗涤,的存在抑制了的溶解,故损失量少。
15. ①或
=
或
②微溶于水,石灰水中的浓度小,吸收的量较少,且吸收速率较慢。
4
相关文档
- 2020版高中数学 第2章 算法初步测2021-05-138页
- 山东春季高考海曲高中数学模拟试题2021-05-136页
- 高考背诵篇目 高中篇初中篇2021-05-1318页
- 上海高中高考化学重要知识点总结完2021-05-1354页
- 高中数学高考总复习平面向量的数量2021-05-1313页
- 2020版高中数学 第二章 算法初步 22021-05-136页
- 高考英语高中英语语法之名词性从句2021-05-1312页
- 高考数学第九章平面解析几何第9课2021-05-139页
- 高中数学三年高考20162018数学理分2021-05-135页
- 高考数学平面向量与复数时复数更多2021-05-137页