- 99.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
10 吉林黑龙江宁夏
一、填空题
.下列各项表达中正确的是
A.Na2O2的电子式为
B.106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.Cl-的结构示意图为
答案:C
.分子式为C3H6Cl2的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
答案:B
.下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
答案:D
.把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol/L B.10( 2a-b)mol/L C.10(b-a)mol/L D.10(b-2a)mol/L
答案:C
.己知:HCN(aq)与NaOH(aq)反应的DH=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的 △H=-55.6kJ/mol。则HCN在水溶液中电离的△H等于
A.-67.7 kJ/mol B.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7kJ/mol
答案:C
.根据右图,可判断出下列离子方程式中错误的是
A.2Ag(s)+Cd2+(aq)==2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq)
D. 2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq)
答案:A
.下表中评价合理的是
化学反应及其离子方程式
评价
选项
A
Fe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2+8H2O
正确
B
向碳酸镁中加入稀盐酸:CO32-+2H+=CO2+H2O
错误,碳酸镁不应写成离子形式
C
向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4
正确
D
FeBr2溶液与等物质的量的Cl2反应:
2Fe2++2Br—+2Cl2=2Fe3++4Cl—+Br2
错误,Fe2+与Br—的化学计量数之比应为1:2
答案:B
.物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。
请回答下列问题:
(1)写出下列物质的化学式:B 、E 、G ;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 ;
(3)反应②的化学方程式是 。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则B的平衡浓度 (填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”)。
答案:(1)B.SO2 E.H2SO4 G.Cu2O
(2)粗铜 精铜 CuSO4溶液
(3)Cu+2H2SO4(浓) DCuSO4+SO2+2H2O
(4)k=23.8mol/L 减小 降低 减小
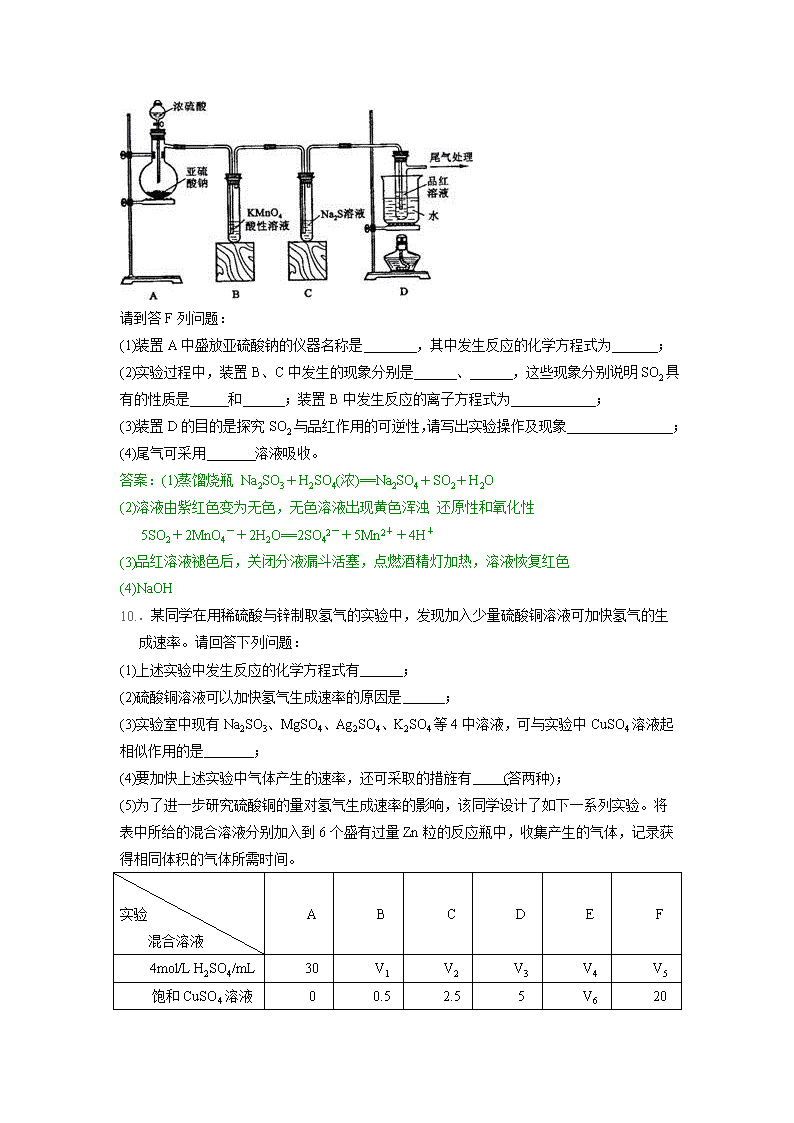
. 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
答案:(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)==Na2SO4+SO2 +H2O
(2)溶液由紫红色变为无色,无色溶液出现黄色浑浊 还原性和氧化性
5SO2+2MnO4-+2H2O==2SO42-+5Mn2++4H+
(3)品红溶液褪色后,关闭分液漏斗活塞,点燃酒精灯加热,溶液恢复红色
(4)NaOH
.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4中溶液,可与实验中CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有 (答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
A
B
C
D
E
F
4mol/L H2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4
0
0.5
2.5
5
V6
20
溶液/mL
H2O/mL
V7
V8
V9
V10
10
0
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
答案:(1)Zn+CuSO4==ZnSO4+Cu Zn+H2SO4==ZnSO4+H2
(2)CuSO4与Zn反应产生的铜与Zn形成微电池,加快了氢气产生的速度
(3)Ag2SO4
(4)升高反应温度,适当增加硫酸的浓度,增加锌粒的表面积(答两个)
(5)①V1=30 V2=60 V3=17.5
②灰黑色,暗红色
③当加入一定量的CuSO4后,生成的单质铜会沉积在Zn的表面降低了Zn与溶液接触的表面
.水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有 、
(2)天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是
(3)水的净化与软化的区别是
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.2´10-3mol/L,c(Mg2+)=6´10-4mol/L,则此水的硬度为
(5)若(4)中的天然水还含有c(HCO3-)=8´10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 g ,后加入Na2CO3 g
答案:(1)氧气 二氧化碳(或氮气)
(2)明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任意两种) 铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的。
(3)水的净化是用混凝剂(如明矾)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子
(4)10°
(5)740 1484
.主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高。请回答下列问题:
(1)W原子L层电子排布式为 W3空间构形是
(2)X单质与水反应的主要化学方程式
(3)化合物M的化学式 其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有
,O-C-O的键角约
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z= 。
(5)含有元素Z的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是
答案:(1)2S22P4 V形
(2)2F2+2H2O==4HF+O2
(3)MgO 晶格能大 SP3和SP2 120°
(4)3:1:1
(5)紫 激发态的电子从能量高的轨道跃迁到能量低的轨道时,以一定的波长(可见光区域)光的形式释放能量
.PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线:
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应:
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)A的化学名称是 ;
(2)B的结构简式为——;
(3)C与D反应生成E的化学方程式为 ;
(4)D有多种同分异构体,其中能发生银镜反应的是 (写出结构简式);
(5)B的同分异构体中含有苯环的还有 种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是 (写出结构简式)。
答案:(1)丙烯 (2) (3)
(4)CH3CH2CHO (5)7