- 741.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013高考化学常见难题大盘点:无机推断题
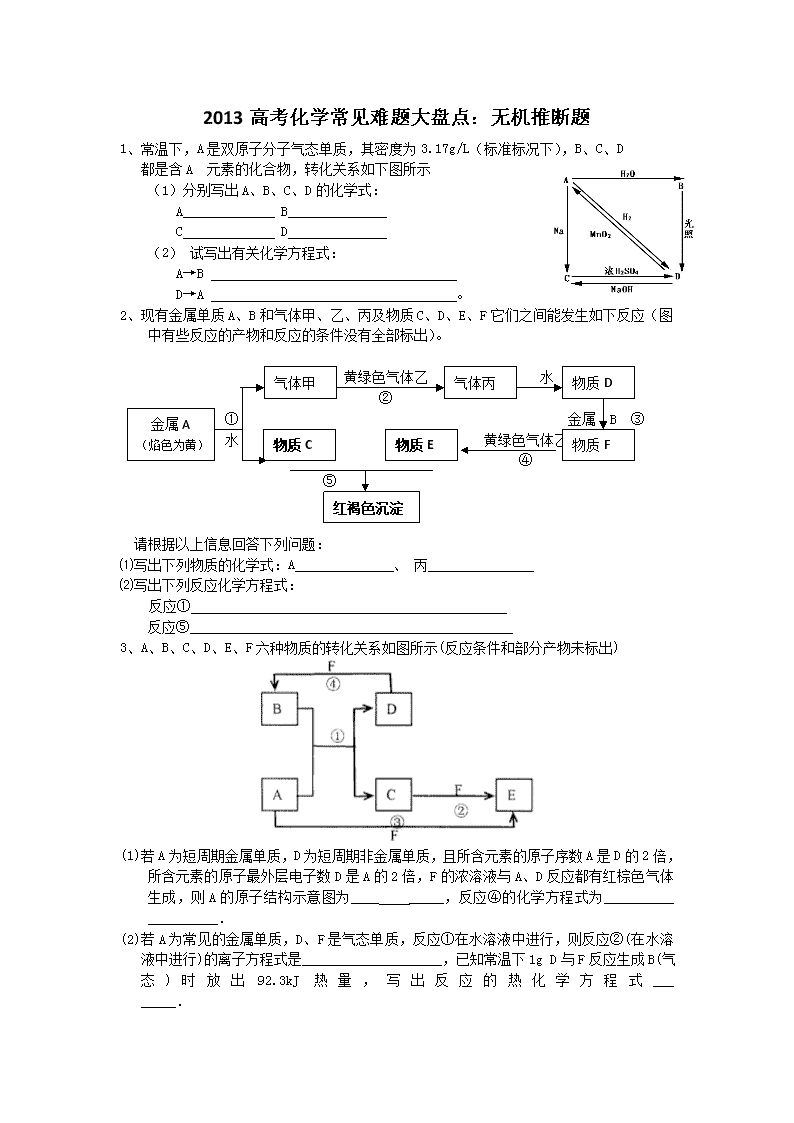
1、常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D
都是含A 元素的化合物,转化关系如下图所示
(1)分别写出A、B、C、D的化学式:
A B
C D
(2) 试写出有关化学方程式:
A→B
D→A 。
2、现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
物质D
气体丙
气体甲
黄绿色气体乙 水
②
金属A
(焰色为黄)
① 金属 B ③
物质F
物质E
物质C
水 黄绿色气体乙
④
⑤
红褐色沉淀
请根据以上信息回答下列问题:
⑴写出下列物质的化学式:A 、 丙
⑵写出下列反应化学方程式:
反应①
反应⑤
3、A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为____ _____,反应④的化学方程式为__________ __________.
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式___ _____.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_________ ___________,B固体属于__________晶体.
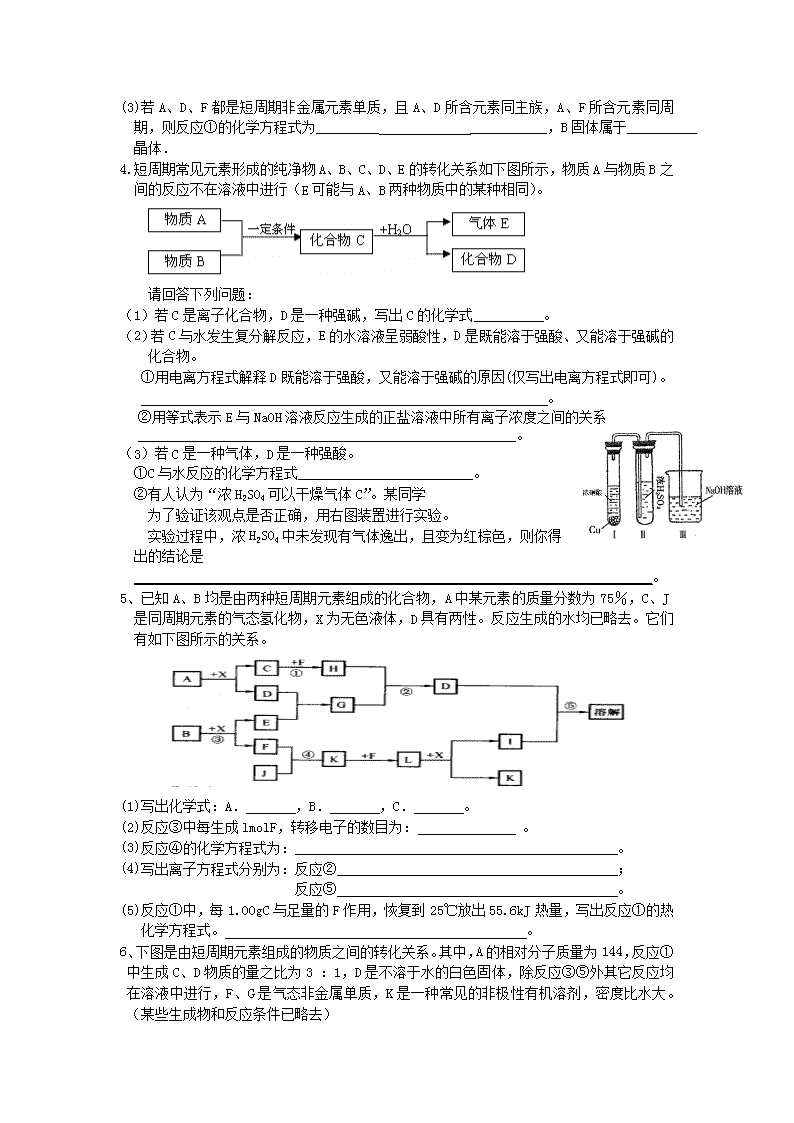
4.短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式 。
(2)若C与水发生复分解反应,E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。
。
②用等式表示E与NaOH溶液反应生成的正盐溶液中所有离子浓度之间的关系
______________________________________________________。
(3)若C是一种气体,D是一种强酸。
①C与水反应的化学方程式_________________________。
②有人认为“浓H2SO4可以干燥气体C”。某同学
为了验证该观点是否正确,用右图装置进行实验。
实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是__________________________________________________________________________。
5、已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性。反应生成的水均已略去。它们有如下图所示的关系。
(1)写出化学式:A. ,B. ,C. 。
(2)反应③中每生成lmolF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:反应② ;
反应⑤ 。
(5)反应①中,每1.00g C与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式。 。
6、下图是由短周期元素组成的物质之间的转化关系。其中,A的相对分子质量为144,反应①中生成C、D物质的量之比为3 :1,D是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,F、G是气态非金属单质,K是一种常见的非极性有机溶剂,密度比水大。(某些生成物和反应条件已略去)
A
C
D
B溶液
F
K
E
F
G
H
J
D
I
H2O
电解
H
①
②
③
⑤
④
⑥
⑦
(1)A的化学式是 ;
(2)E中金属阳离子的检验方法 ;
(3)写出反应②的化学方程式 ;
(4)写出反应⑦的离子方程式:⑦ ;
(5)用离子方程式表示H溶液显碱性的原因 。
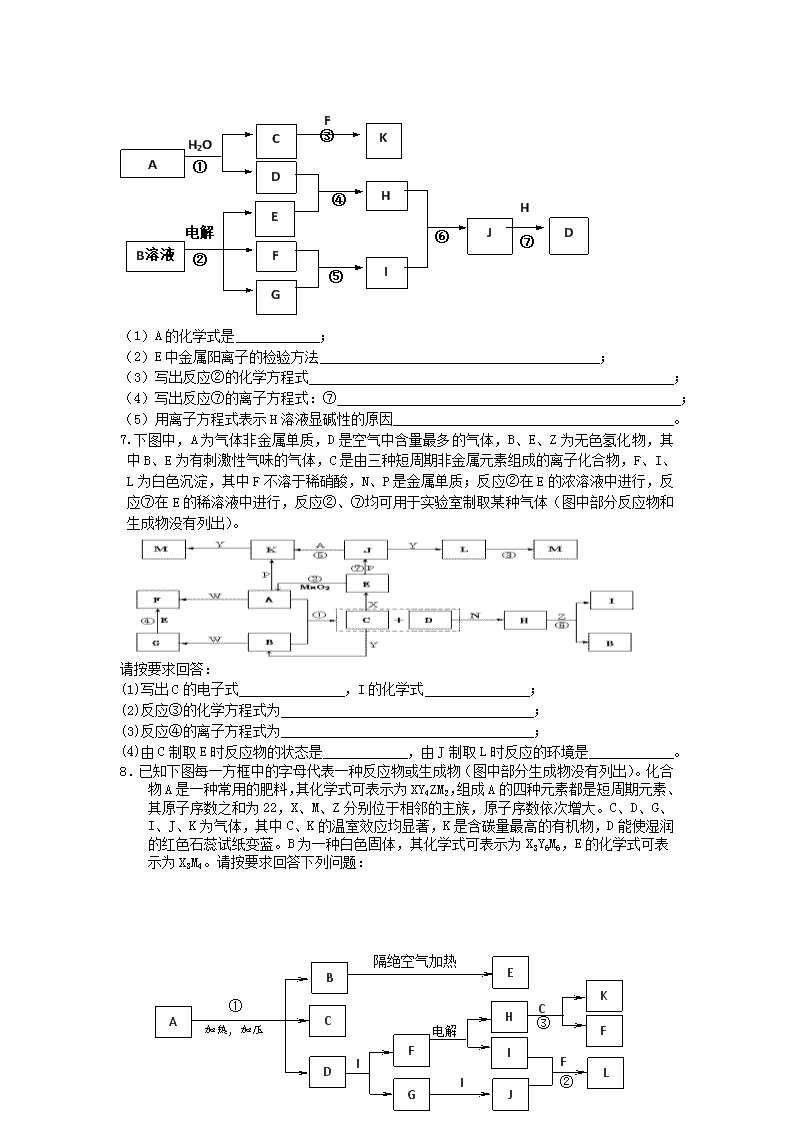
7.下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
请按要求回答:
(1)写出C的电子式 ,I的化学式 ;
(2)反应③的化学方程式为 ;
(3)反应④的离子方程式为 ;
(4)由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
8.已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出)。化合物A是一种常用的肥料,其化学式可表示为XY4ZM2,组成A的四种元素都是短周期元素、其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大。C、D、G、I、J、K为气体,其中C、K的温室效应均显著,K是含碳量最高的有机物,D能使湿润的红色石蕊试纸变蓝。B为一种白色固体,其化学式可表示为X3Y6M6,E的化学式可表示为X3M4。请按要求回答下列问题:
②
A
B
C
D
F
G
I
I
J
E
①
加热,加压
电解O2
H
I
C
K
F
隔绝空气加热
F
L
③
(1)反应①、②、③的化学方程式分别为 、 、 。
(2)B中M的质量分数为 。
(3)化合物E是一种新型无机材料,它的一种结构(β- X3M4)具有可与金刚石相媲美的硬度。请推测该材料可能用途之一是 。
9.A是一种重要的矿石,B-I均是中学化学常见物质,其中D、H为气体。J是有两种元素形成的化合物,它是一种良好的耐热冲击材料,抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料,它还是电绝缘体。它们在一定条件下有如下转化关系(某些反应产物和反应条件已略去),其中反应①~④是某工业流程的重要组成部分:
A
B溶液
C溶液
F溶液
E
G
操作Ⅰ
D
NH4HCO3
F溶液
H
J
操作Ⅱ
盐酸
通过干燥剂
灼烧
②
④
①
③
⑥
电解
I
⑤
试回答下列问题:
(1)写出反应②和⑤的离子方程式:
② ,
⑤ ;
(2)操作Ⅰ和操作Ⅱ的实验名称分别是 和 ;
(3)H气体在后续反应中必须是干燥的,干燥H气体时所选择的干燥剂可以是 ;
(4)J的化学式为 ,其晶体中存在的化学键类型有共价键和 ;
(5)有人说在反应⑤中选择(NH4)2CO3比NH4HCO3更好,其理由是
。
10.已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
请回答下列问题:
F
X溶液
滤液A
固体C
盐酸
D
溶液B
沉淀G
H
△
固体E
N
蓝色
沉淀
Y
F
②
③
M
①
④
(1)X的化学式为 ;F的电子式为 。
(2)反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
(3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。(假设体积不变)
11、有下列物质之间的相互转化
②
刺激性
气 体
O2、△
①
催化剂
NaOH
金属
红棕色气体
NaOH
无色液体
O2
A
B
C
D
E
F
E
Na2FO2
C
A
NaOH
Na2F2O4
A
已知E是具有还原性的含氧酸钠盐,回答下列问题(方程式中的物质用对应的元素符号或化学式表示)
⑴写出A和O2反应生成B和C的方程式: 。
⑵Na2FO2和Na2F2O4均为易溶于水的盐。Na2FO2溶于过量的新制氯水后形成黄色溶液,向该溶液中滴入KSCN溶液出现血红色。分别写出反应②以及Na2FO2溶于过量氯水的离子方程式:
、
。
⑶事实上,金属F放置于一定浓度NaOH和E混合溶液中一段时间,发生反应①、②,生成的Na2FO2和Na2F2O4能发生可逆反应,在F表面生成一层致密的氧化物保护层。试写出Na2FO2和Na2F2O4相互反应生成保护层的化学反应方程式为: 。
⑷为防止金属F的腐蚀,将F制品放置于一定浓度NaOH和E混合溶液中时,NaOH的浓度不宜 (填“太小”或“太大”)。
12. A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
⑴H的化学式为_____________,D的电子式为_________________________;
⑵B和N的离子反应方程式为_______________________________________________;
⑶D与G反应的离子方程式为_______________________________________________;
⑷G与M反应的化学方程式为_______________________________________________;
⑸I可用于净化水,其原因是
Y
A
氯气
D溶液
C
X
D无水晶体
E
F
G
H
A
B溶液
G
原电池
反 应
+氧气⑥
+Y高温⑦
①
②
③
电解
熔融
操作a
+氧气
+氧气
+C
⑤
△
④
浓溶液
13.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 _____
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
14已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。A的水溶液
B
C
MnO2
丁
甲
D
G
F
E
丙
乙
B
②
③
①
(I)A的结构式 , E与F的反应是 (填反应名称),在工业生产中此反应有什么用途? 、 。
(II)若反应①除生成甲外,还生成丙,回答(1)、(2)小题:
(1)写出过量D与甲稀溶液反应的离子方程式:
(2)以D、F为电极,NaOH溶液为电解质溶液可以组成原电池,原电池正极的电极反应为:
(III)若A与丙可以化合生成甲;甲与D加热条件下可以生成三种化合物乙、丙、B,乙、丙、B常温下又可以反应生成甲和另一化合物X。回答(2)、(3)小题:
(3)写出下列方程式 ②:
③:
(4)将含有1.2molX的水溶液调至中性,通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
15、固体A
溶液C
液体K
气体D
溶液B
过量F
(I)
气体F
H
液体K
溶液E
溶液G
固体B
E溶液
溶液L
Br2水 (II)
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
试回答:
⑴A的电子式为 ;乙元素的原子结构示意图为 。
⑵工业生产中,由F制取H的适宜反应条件为 。
⑶溶液B的pH值小于7,其原因是 。
⑷反应(I)的化学方程式为 。
⑸反应(II)的离子方程式为 。
16.各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在击期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,①常用于制作印刷电路板。
请回答下列问题:
(1)写出A的化学式 ,C的电子式 。
(2)比较Y与Z的原子半径大小 > (填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示) ,举出该反应的一个应用实例 。
(4)已知I溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式 。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
答案
1. (1)A Cl2 B HClO C NaCl D HCl
(2)A→B Cl2 +H2O HClO+ HCl
D→A MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
2、(1)Na HCl (2)2Na + 2H2O = 2NaOH + H2↑ FeCl3 + 3NaOH ==Fe(OH)3↓+ 3NaCl
3.(10分)⑴ 略 (1分) C+4HNO3(浓) CO2↑+4NO2↑+2H2O (2分)
⑵2Fe2++Cl2 2Fe3++2Cl-(2分)
H2(g )+Cl2 (g)2HCl(g);△H=-184.6kJ·mol-1 (2分)
⑶2C+SiO2 2CO↑+Si (2分) 原子(1分)
4. (1)Na2O2 (2分)
(2)① H++H2O+AlO2- Al(OH)3 Al3++3OH- (2分)
② c(Na+)+c(H+) = 2c(S2-)+c(HS-)+c(OH-) (2分)
(3)①3NO2+H2O = 2HNO3+NO (2分)
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2 (2分)
5、(1)Al4C3;Na2O2;CH4 (2)1.204×1024
(3)4NH3+5O2 4NO+6H2O
(4)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
(或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-);
Al(OH)3+3H+=Al3++3H2O
(5)CH4(g)+2O2(g)CO2(g)+2H2O(l);△H=-889.6kJ·mol-1
6、(1)Al4C3 (2) 取试样,进行焰色反应,若火焰显黄色,说明有Na+存在。
(3) 2NaCl+2H2O=== Cl2↑+ Cl2↑+2NaOH (4) Al3++3AlO2-+6 H2O==4Al(OH)3↓
(5)AlO2-+2 H2OAl(OH)3+ OH-
7.(8分)(1) Mg(OH)2 (每空1分)
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
(3)Ag(NH3)2++2H++Cl-=2NH4++AgCl↓(2分)
(4)C为固体 无氧(每空1分)
8.(1)6(NH2)2CO → C3H6N6 + 6NH3 + 3CO2、4NO2 + O2+2H2O = 4HNO3、 CO2+4H2→CH4 +2H2O
(2)66.7% (3)做耐磨材料等。
9.(1)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
NH4++HCO3-+2OH-NH3↑+CO32-+2H2O
(2)过滤、加热 (3)碱石灰 (4)AlN,配位键
(5)使用(NH4)2CO3时,使用等量的NaOH溶液生成的NH3多
10、(10分)(1),(2分/个,共4分)
(2)① 3Fe2+ + NO3-+ 4H+ == 3Fe3+ + NO↑+ 2H2O(2分)
② (2分)
(3)0.2 mol/L(2分)
11、 (10分)(1)4NH3 + 5O2 4NO + 6H2O
(2)6FeO22— + NO2— + 5H2O = 3Fe2O42— + NH3 + 7OH—
2FeO22— + Cl2 + 8H+ = 2 Fe3+ + 2Cl— + 4H2O
(3)Na2FeO2 + Na2Fe2O4 +2H2O Fe3O4 + 4NaOH
(4)太大;(每空2分)
12.(共12分)(每空2分)⑴H化学式:Fe3O4 D的电子式:
⑵Cl2 + 2OH- = Cl- + ClO- + H2O ⑶2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
⑷3Fe + 4H2O(g)Fe3O4 + H2↑
⑸FeCl3水解生成Fe(OH)3胶体, Fe(OH)3胶体吸附水中悬浮杂质而净水
催化剂
Δ
13.(8分)(1)2Mg+CO2====2MgO+C; (2分) (2)将D溶液在HCl气流中蒸干;(2分)
△
(3)②4NH3+5O2====4NO+6H2O; (2分) (4)⑤C+4HNO3====CO2+4NO2↑+2H2O (2分)
14. (16分)
(I)H-O-O-H(2分),铝热反应(2分),焊接铁轨、冶炼金属(2分);
(II)(1)3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O(2分)
(2)6H2O +6e - =3H2↑+6OH - (2分)
(III)(3)②:2SO2+O22SO3(2分)
③:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O(2分)
(4)32g(2分)
15、(14分)
(1) (4分)
(2)常压、催化剂、500℃(2分)
(3)NaHSO3 溶液中。HSO3—的电离程度大于其水解程度。(2分)
(4) NaOH+SO2=NaHSO3 (3分)
(5)SO2+Br2+2H2O=4H+ + SO42--+ 2Br- - -(3分)
16 略
17略
18. (1) HF、H2O、NH3、NO( 每空1分)
(2) 2F2 + 2 H2O ==4HF+ O2 4NH3+ 5O2==4NO +6H2O 4NH3+ NO==5N2 +6H2O
19 略
相关文档
- 高考议论文结构类作文示例2021-05-138页
- 历年高考语文作文题目汇总2008-2012021-05-1336页
- 高考地理一轮复习限时规范训练36世2021-05-137页
- 高考地理一轮全程复习方略高效演练2021-05-133页
- 2020版高考历史大一轮复习 第十四2021-05-1320页
- 高考苏教版实验化学必记知识点总结2021-05-134页
- 2020高考历史二轮复习 能力升级练 2021-05-136页
- 2020年高考物理模拟新题精选分类解2021-05-1313页
- 2019届高考数学一轮复习 第13讲 变2021-05-135页
- 2020版高考政治一轮复习(A版)专题九 2021-05-135页