- 604.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
第 31 题 化学实验综合探究
1.硼与铝为同族元素。据报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录,硼、
镁及其化合物在工农业生产中应用广泛;硼酸(H3BO3)是极弱的一元弱酸。硼镁矿主要成分为
Mg2B2O5·H2O,用硼镁矿、碳铵法实验室制备硼酸的主要流程如下:
请回答:
(1)步骤①中实验室需要把硼镁矿放在______________仪器中焙烧(填实验仪器)。
(2)步骤③中采用减压过滤,该小组同学所用的装置如上图所示,若实验过程中发生倒吸现象,
应采取最简单的实验操作是______________________________________________________;
NH4H2BO3 溶液经蒸发浓缩、冷却结晶、抽滤、洗涤、干燥获得硼酸晶体,下列实验条件容易使
得到的硼酸晶体有较大颗粒的是________________。
A.较高温度下快速蒸发
B.用冰水冷却 NH4H2BO3 溶液
C.采用较稀的 NH4H2BO3 溶液
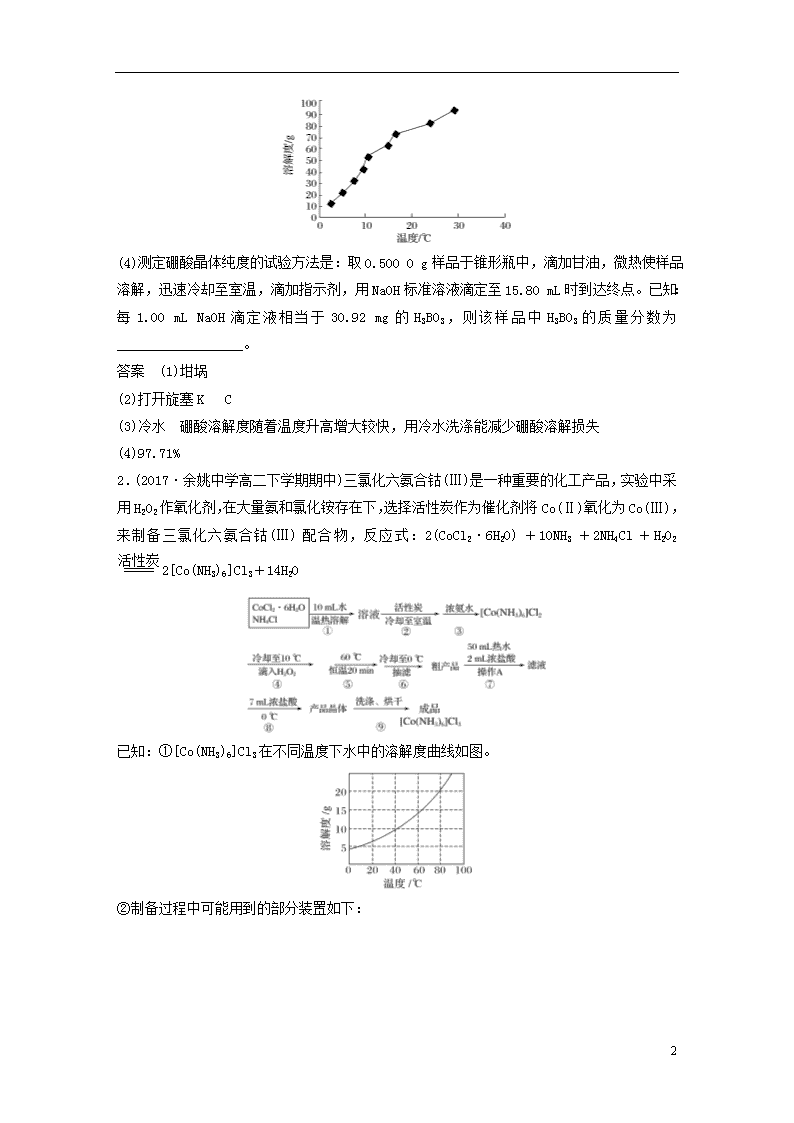
(3)硼酸溶解度如下图所示,从操作③中获得 H3BO3 晶体需要洗涤、干燥,洗涤过程中需要用
________(填“冷水”或“热水”),你的理由是_______________________________________
________________________________________________________________________;
(4)测定硼酸晶体纯度的试验方法是:取 0.500 0 g 样品于锥形瓶中,滴加甘油,微热使样品
溶解,迅速冷却至室温,滴加指示剂,用 NaOH 标准溶液滴定至 15.80 mL 时到达终点。已知:
每 1.00 mL NaOH 滴 定 液 相 当 于 30.92 mg 的 H3BO3 , 则 该 样 品 中 H3BO3 的 质 量 分 数 为
__________________。
答案 (1)坩埚
2
(2)打开旋塞 K C
(3)冷水 硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失
(4)97.71%
2.(2017·余姚中学高二下学期期中)三氯化六氨合钴(Ⅲ)是一种重要的化工产品,实验中采
用 H2O2 作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将 Co(Ⅱ)氧化为 Co(Ⅲ),
来 制 备 三 氯 化 六 氨 合 钴 (Ⅲ) 配 合 物 , 反 应 式 : 2(CoCl2·6H2O) + 10NH3 + 2NH4Cl +
H2O2 =====活性炭2[Co(NH3)6]Cl3+14H2O
已知:①[Co(NH3)6]Cl3 在不同温度下水中的溶解度曲线如图。
②制备过程中可能用到的部分装置如下:
(1)原料 NH4Cl 的主要作用是___________________________________________________;
步骤④中要冷却至 10 ℃再加入 H2O2 溶液,这样操作的目的:_______________________。
(2)步骤⑤中保持 60 ℃的加热方法是______________________________________________,
恒温 20 min 的目的是_______________________________________________________。
(3)步骤⑥是减压抽滤(见上图装置Ⅱ),当抽滤完毕或中途停止抽滤时,防自来水倒吸入抽滤
瓶最佳的正确操作是_________________________________________________________。
(4)操作 A 的名称为________。若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是
______________。
(5)步骤⑨进行洗涤时要用到两种试剂,应该依次用________(填字母)洗涤。
A.饱和氯化钠溶液
3
B.无水乙醇
C.浓盐酸
答案 (1)NH4Cl 溶于水电离出 NH +
4 会抑制 NH3·H2O 的电离 防止温度过高 H2O2 分解 (2)
水浴加热 保证反应完全 (3)慢慢打开活塞 d,然后关闭水龙头
(4)趁热过滤 往漏斗中加入少量热水 (5)CB
解析 (1)NH4Cl 溶于水电离出 NH +
4 会抑制 NH3·H2O 的电离,利于加入浓氨水后生成
[Co(NH3)6]Cl3;步骤④中要冷却至 10 ℃再缓慢地边搅拌边加入 H2O2 溶液,可以防止温度过高
导致 H2O2 分解,同时降低反应速率,防止反应过于剧烈。(2)根据 Co(NH3)6Cl3 在不同温度下水
中的溶解度曲线可知,步骤⑤中保持 60 ℃,可以加快反应速率,又不至于双氧水分解,保
持 60 ℃可以通过水浴加热控制温度,恒温 20 min 可以保证反应完全进行。(3)在减压抽滤
操作中,当抽滤完毕或中途停止抽滤时,防自来水倒吸入抽滤瓶最佳的正确操作是慢慢打开
活塞 d,然后关闭水龙头。(4)根据流程图,粗产品中加入 50 mL 热水和 2 mL 浓盐酸,洗涤
后,需要趁热过滤,得到滤液;若操作过程中,发现漏斗尖嘴处有少量晶体析出,往漏斗中
加入少量热水,使之溶解后继续过滤。(5)根据流程图,步骤⑦和⑧的提示,步骤⑨进行洗涤
时可以先用浓盐酸洗涤,因为[Co(NH3)6]Cl3 易溶于水,然后再用无水乙醇洗涤。
3.(2018·诸暨市牌头中学高二下学期期中)实验室用镁还原硝基苯制取反式偶氮苯的化学方
程式为:
+4Mg+8CH3OH―→
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2 在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
③反式(顺式)偶氮苯为橙红色晶体,溶于乙醇、乙醚和醋酸,不溶于水。遇明火、高热可燃,
受高热分解放出有毒的气体。
主要实验装置和步骤如下:
(Ⅰ)合成:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,加入少量镁粉,立即发生反
应;等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流
30 min。
(Ⅱ)分离与提纯:
①将所得液体趁热倒入盛有冰水的烧杯,并不断搅拌,用冰醋酸小心中和至 pH 为 4~5,析
出橙红色固体,过滤,用少量冰水洗涤。
②用 95%的乙醇重结晶。
回答下列问题:
(1)如图加热回流装置中,仪器 a 的名称是__________,进水口为________(填“1”或“2”)
4
(2)若将镁粉一次性加入已装硝基苯、甲醇混合液的三颈烧瓶中,可能导致________(填字母)。
A.反应太剧烈 B.液体太多搅不动
C.反应变缓慢 D.副产物增多
(3)分离与提纯:
①析出橙红色固体,过滤,用少量冰水洗涤中用冰水洗涤的原因是________________________
________________________________________________________________________。
②为了得到较大颗粒的晶体,加入冰醋酸时需要_______________________________________
_________________________________(填“缓慢加入”或“快速加入”)。
③烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上
的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________(填字母)。
A.冰水 B.饱和 NaCl 溶液
C.95%乙醇水溶液 D.滤液
④抽滤完毕,应先断开____________________________________________________________,
以防倒吸。
⑤重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过
程中的________操作除去了不溶性杂质。
(4)取 0.1 g 偶氮苯,溶于 5 mL 左右的苯中,将溶液分成两等份,分别装于两个试管中,其
中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中
的溶液点在距离滤纸条末端 1 cm 处,再将滤纸条末端浸入装有 1∶3 的苯环己烷溶液的容器
中,实验操作及现象如下图所示:
5
①实验中分离物质所采用的方法是________法。
②薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮
苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性
____________________(填“强”或“弱”)。
答案 (1)冷凝管 2 (2)AD (3)①减少偶氮苯的溶解 ②缓慢加入 ③D ④抽气泵和安
全瓶 ⑤趁热过滤 (4)①层析(色层、色谱) ②弱
解析 (1)根据仪器 a 的构造特点,仪器 a 的名称为冷凝管。冷凝管中水流方向“下进上出”,
进水口为 2。
(2)根据实验和已知③“反式(顺式)偶氮苯遇明火、高热可燃,受高热分解放出有毒的气体”。
若将镁粉一次性加入已装硝基苯、甲醇混合液的三颈烧瓶中,可导致反应太剧烈,副产物增多。
(3)①根据已知③“反式(顺式)偶氮苯为橙红色晶体,溶于乙醇、乙醚和醋酸,不溶于水”,
析出橙红色固体,过滤,用少量冰水洗涤的目的是:减少偶氮苯的溶解。
②结晶速率越慢得到的晶体颗粒越大,为了得到较大颗粒的晶体,加入冰醋酸时需要缓慢加入。
③烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上
的晶体冲洗下来后转入布氏漏斗,目的是减少晶体的损失;所以选择冲洗的液体既不会使晶
体溶解,同时也不会引入杂质,最合适的液体是滤液。
④抽滤完毕,应先断开抽气泵和安全瓶之间的橡皮管。
⑤重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”,其中“趁热过
滤”除去了不溶性杂质,“冷却结晶、抽滤”除去了可溶性杂质。
(4)①根据所做实验,实验中分离物质所采用的方法是层析(色层、色谱)法。
②根据已知②“反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯”,紫外线照射后的
样品中含反式偶氮苯和顺式偶氮苯;根据实验开始时和展开后的斑点,反式偶氮苯扩散得更
快,在薄层色谱分析中,极性弱的物质,在溶剂中扩散更快,所以反式偶氮苯比顺式偶氮苯
分子的极性弱。
4.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂
等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式:
2NH3(g)+CO2(g) NH2COONH4(s)
ΔH=-Q kJ·mol-1(Q>0)
6
制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生
成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
(1)发生器用冰水冷却的原因是________________________________________________
______________________________________________________________________(答两点)。
(2)液体石蜡鼓泡瓶的作用是______________________________________________________
________________________________________________________________________。
(3)从反应后的混合物中分离出产品的实验方法是________(填操作名称)。为了得到干燥产
品,应采取的方法是________(填序号)。
a.常压加热烘干
b.高压加热烘干
c.真空 40 ℃以下烘干
(4)尾气处理装置如图所示。浓硫酸的作用:__________________________________________
________________________________________________________________________。
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品 0.782 0 g,用足量石灰水充分处理后,
使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为 1.000 g。则样品中氨基甲酸
铵的物质的量分数为________。
答案 (1)降低温度提高反应物转化率;防止因反应放热造成产物分解;防止 NH3 和 CO2 逸出,
增大 NH3 和 CO2 的溶解度(答出任意两点即可)
(2) 通过观察气泡,调节 NH3 与 CO2 通入比例为 2∶1
(3)过滤 c
(4)吸收多余氨气、防止空气中的水蒸气进入反应器使氨基甲酸铵水解
(5)80.00%
解析 (1)生成 NH2COONH4(s)的反应放热,降低温度平衡向正反应方向进行,有利于生成氨基
甲酸铵。且氨基甲酸铵受热易分解,所以反应过程中需要用冰水冷却。(2)因为气体参与的反
应不易控制反应速率和用量,所以液体石蜡鼓泡瓶的作用是控制气体流速和原料气体的配比,
7
即通过观察气泡,调节 NH3 与 CO2 通入比例。
(3)由制备氨基甲酸铵的装置图可知,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生
成的氨基甲酸铵晶体小,其晶体悬浮在四氯化碳中,分离产品的实验方法是过滤。氨基甲酸
铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空 40 ℃以下烘干,所以答
案选 c。(4)氨气是碱性气体,浓硫酸是强酸,且具有吸水性,所以浓硫酸的作用是吸收多余
的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解。
(5)过滤、洗涤、干燥,测得质量为 1.000 g,该物质是碳酸钙,其物质的量为 1.000 g÷100 g·mol
-1 =0.010 mol。设样品中氨基甲酸铵的物质的量为 x,碳酸氢铵的物质的量为 y,依据碳原
子守恒得到:x+y=0.010 mol,又因为 78 g·mol-1·x+79 g·mol-1·y=0.782 0 g,解
得 x=0.008 mol、y=0.002 mol,则样品中氨基甲酸铵的物质的量分数=0.008 mol
0.010 mol
×100%
=80.00%。
相关文档
- 红对勾高中物理人教版选修32练习462021-05-139页
- 高中区域地理分区东南亚涵盖高考所2021-05-134页
- 上海高中高考数学知识点总结大全2021-05-1317页
- 高考地理 第19讲 城市化(含解析)【更2021-05-136页
- 高中生物课堂笔记生物必修3来源:学2021-05-1327页
- 高中物理论文:基于两道物理高考题的2021-05-139页
- 高中选修物质与结构高考试题汇总至2021-05-1322页
- 金太阳 1 00所名校高中生物高考模2021-05-137页
- 2020版高中数学 第2章 算法初步测2021-05-138页
- 山东春季高考海曲高中数学模拟试题2021-05-136页