- 1.41 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
氯、硫、氮、碳、硅等非金属及其重要化合物的化学性质
【本讲教育信息】
一. 教学内容:
高考第二轮复习《专题7》
二. 教学目的:
1. 了解氯、氮、硫、硅等非金属及其重要化合物的主要物理性质。
2. 了解氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及与水、碱的反应,知道氯水的消毒和漂白原理。了解硫的可燃性和氮气的稳定性。知道硅元素在自然界以及硅酸盐的形式存在,知道晶体硅是良好的半导体材料。能说出氯、氮、硫、硅等非金属单质的主要用途。
3. 了解二氧化硫与氧气、与水的反应,认识亚硫酸的不稳定性,认识二氧化硫的漂白作用与次氯酸漂白作用的区别,了解二氧化氮与水的反应,了解二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应。
4. 了解氨气与水、与酸的反应,了解氨水的成分以及氨水的不稳定性。了解铵盐易溶于水、受热易分解、与碱反应等性质。
5. 了解次氯酸、浓硫酸、硝酸的强氧化性,了解浓硫酸、硝酸分别与、C的反应。了解常温下铁、铝在浓硫酸、浓硝酸中的钝化现象。认识工业上生产硫酸、硝酸的反应原理。
6. 了解陶瓷、玻璃、水泥等硅酸盐产品的用途。
7. 认识非金属及其重要化合物在生产中的应用和对生态环境的影响。了解氮循环对生态平衡的重要作用。了解氮氧化物、二氧化硫等污染物的来源、性质和危害,体会化学对环境保护的重要意义,逐步形成可持续发展的思想。
三. 重点和难点:
1. 氯、硫、氮、碳、硅等非金属及其重要化合物的主要物理性质和化学性质。
2. 氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及与水、碱的反应,氯水的消毒和漂白原理。
硫的可燃性和氮气的稳定性。硅元素在自然界以及硅酸盐的形式存在,晶体硅是良好的半导体材料。氯、氮、硫、硅等非金属单质的主要用途。
3. 二氧化硫与氧气、与水的反应,亚硫酸的不稳定性,二氧化硫的漂白作用与次氯酸漂白作用的区别,二氧化氮与水的反应,二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应。
4. 氨气与水、与酸的反应,氨水的成分以及氨水的不稳定性。铵盐易溶于水、受热易分解、与碱反应等性质。
5. 次氯酸、浓硫酸、硝酸的强氧化性,浓硫酸、硝酸分别与、的反应。常温下铁、铝在浓硫酸、浓硝酸中的钝化现象。工业上生产硫酸、硝酸的反应原理。
6. 陶瓷、玻璃、水泥等硅酸盐产品的用途。
非金属及其重要化合物在生产中的应用和对生态环境的影响。氮循环对生态平衡的重要作用。氮氧化物、二氧化硫等污染物的来源、性质和危害,化学对环境保护的重要意义。
四. 考点分析
本专题内容在高考中的主要考查点是:
1. 氯、硫、氮、碳、硅等非金属及其重要化合物的主要物理性质和化学性质。
2.
6
氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及与水、碱的反应,氯水的消毒和漂白原理。
硫的可燃性和氮气的稳定性。硅元素在自然界以及硅酸盐的形式存在,晶体硅是良好的半导体材料。氯、氮、硫、硅等非金属单质的主要用途。
3. 二氧化硫与氧气、与水的反应,亚硫酸的不稳定性,二氧化硫的漂白作用与次氯酸漂白作用的区别,二氧化氮与水的反应,二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应。
4. 氨气与水、与酸的反应,氨水的成分以及氨水的不稳定性。铵盐易溶于水、受热易分解、与碱反应等性质。
5. 次氯酸、深硫酸、硝酸的强氧化性,浓硫酸、硝酸分别与Cu、C的反应。常温下铁、铝在浓硫酸、浓硝酸中的钝化现象。工业上生产硫酸、硝酸的反应原理。
五. 知识网络
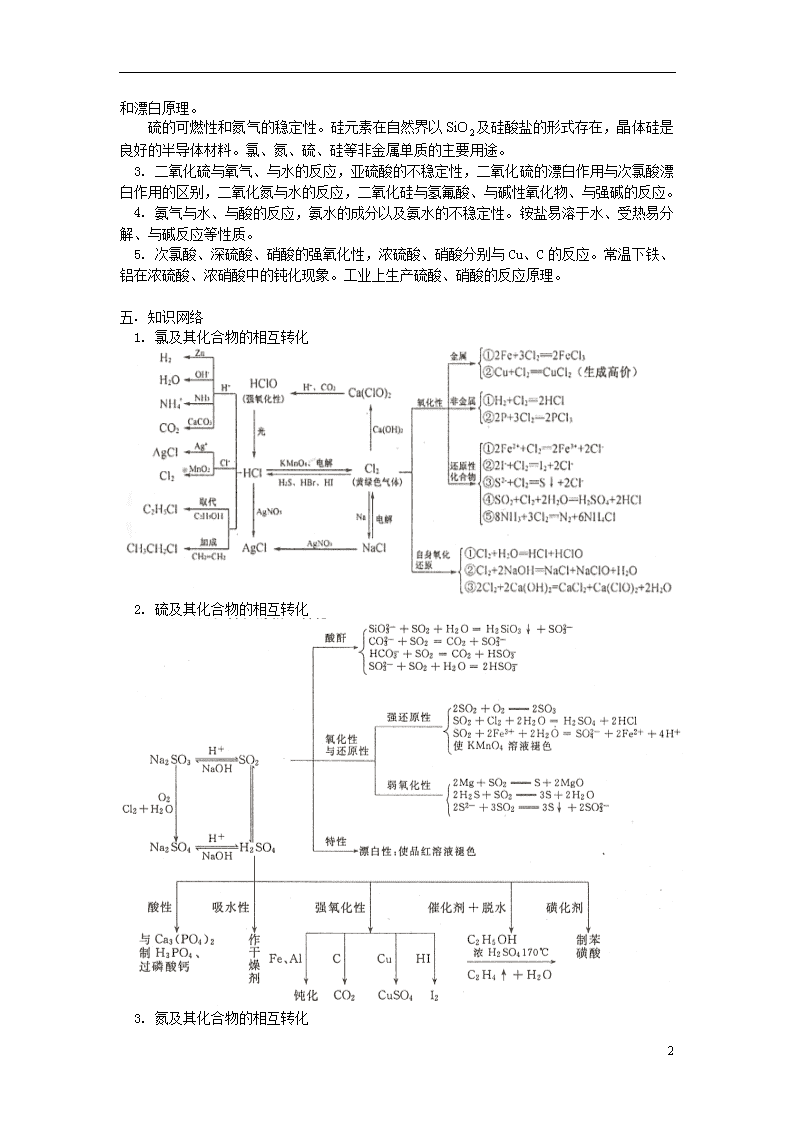
1. 氯及其化合物的相互转化
2. 硫及其化合物的相互转化
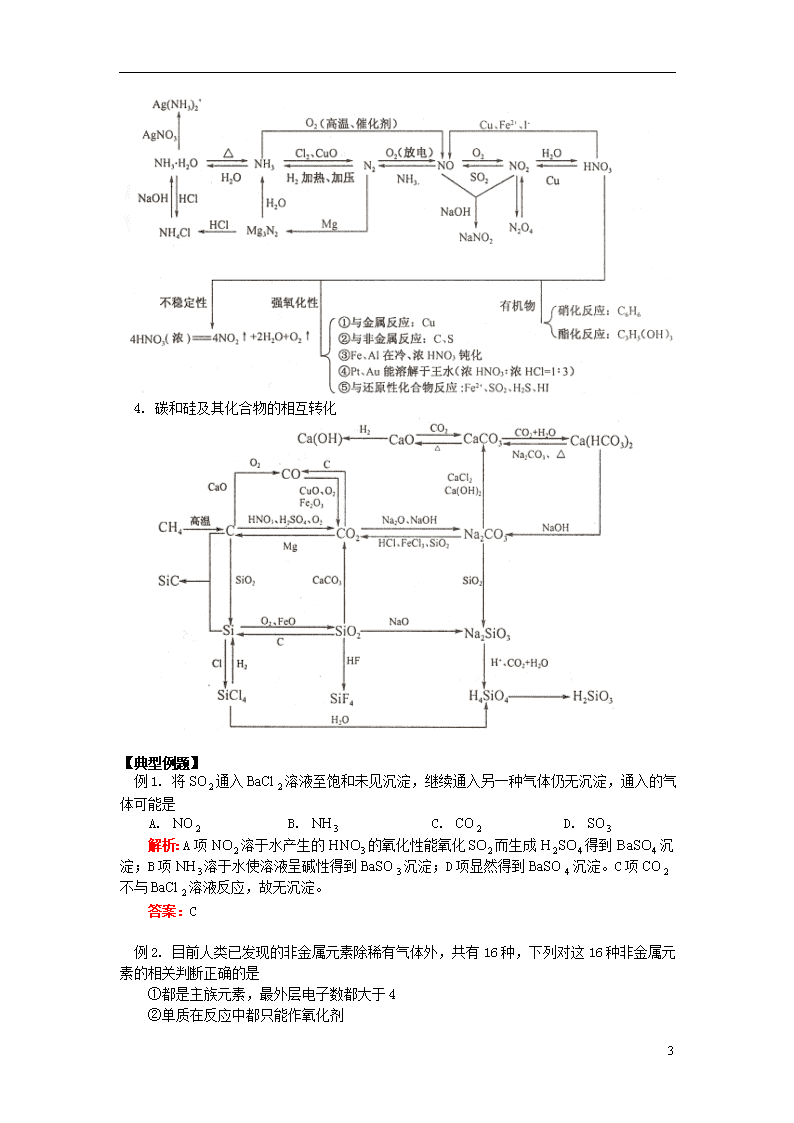
3. 氮及其化合物的相互转化
6
4. 碳和硅及其化合物的相互转化
【典型例题】
例1. 将通入溶液至饱和未见沉淀,继续通入另一种气体仍无沉淀,通入的气体可能是
A. B. C. D.
解析:A项溶于水产生的的氧化性能氧化而生成得到沉淀;B项溶于水使溶液呈碱性得到沉淀;D项显然得到沉淀。C项不与溶液反应,故无沉淀。
答案:C
例2. 目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断正确的是
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
6
③氢化物常温下都是气态,所以又都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
A. 只有①②正确 B. 只有①③正确 C. 只有③④正确 D. ①②③④均不正确
解析:①都是主族元素,但最外层电子数不都大于4,如H元素的最外层电子数为1。②单质不一定在反应中都只能作氧化剂,如氢气可以做还原剂。③氢化物常温下不一定都是气态,如氧元素氢化物水常温下为液态。④氧化物常温下不一定都可以与水反应生成酸,如和水不反应。所以选D项。
答案:D
例3. 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
、、、四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:________________________。
(2)反应中硝酸体现了________________________、________________________性质。
(3)反应中若产生气体,则转移电子的物质的量是________________________mol。
(4)若甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________。
解析:、、、四种物质中只有有还原性,根据电子得失守恒和元素原子个数守恒可配平如下:
,。被还原为NO的表现氧化性,生成的表现酸性。由半反应:,若产生气体,则转移电子的物质的量是。被还原硝酸的物质的量增加,说明硝酸还原产物的价态较高。可能产物中有部分二氧化氮生成,使用了较浓的硝酸。
答案:(1)
(2)酸性 氧化性
(3)0.6
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成。
例4. “喷泉”是一种常见的自然现象,其产生原因是存在压强差。
6
(1)做氨的喷泉实验时,若要在图(a)装置中收集一瓶氨气,氨气应由_____________口进入,原因是__________________________,为了证明烧瓶充满氨气,可用_____________检验,观察到的现象是_____________,或用_____________检验,观察到的现象是__________________________。
(2)某学生做喷泉实验时,用向下排空气法在体积为的烧瓶中收集氨气,最后所得气体对氢气的相对密度为,将此充满气体的烧瓶倒置于水中,瓶内水面升到一定高度停止,则在同温同压下瓶内剩余气体的体积为_____________mL。
(3)图(b)为中学化学中所用的喷泉实验装置,在烧瓶中充满干燥的气体,胶头滴管及烧杯中分别盛有液体,下列组合中不可能形成喷泉的是_____________(填序号)。
①和 ②和
③和 ④和溶液
(4)某学生积极思考产生喷泉的其他方法,并设计了图(c)所示的装置,在图(c)所示的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是_____________(填序号)。
①和稀 ②和溶液
③和稀 ④和稀盐酸
(5)在图(c)锥形瓶外放一水槽,瓶内加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉,水槽中可以加入的物质可以是_____________(填序号)。
①浓 ②食盐 ③硝酸钾 ④硫酸铜
(6)比较图(b)和图(c)两套装置,以产生喷泉的原理来分析,图(b)是_____________上部烧瓶内压强;图(c)_____________下部锥形瓶内气体压强(填“增大”或“减小”)。城市中常见的人造喷泉及火山喷发的原理与上述_____________(填“图(b)”或“图(c)”)装置的原理相似。
解析:气体的收集方法取决于气体的物理性质,极易溶于水,且密度比空气小(17<29),因此,只能用向下排空气法收集,采用图(a)的装置收集时,要分清楚空气是从哪个导管中排出的。
(2)根据所得气体对氢气的相对密度为10.5可知,烧瓶内气体的相对分子质量为21,说明氨气没有收集满,我们把烧瓶内气体看作是空气和氨气两部分,根据空气的平均相对分子质量29和氨气的相对分子质量17,采用“十字交叉”法可求出烧瓶中与空气的体积比。
(3)图(b)装置形成“喷泉”是因为烧瓶内气体极易溶解于烧杯和滴管中的液体,使烧瓶内的压强突然减少而产生压强差形成“喷泉”。
(4)图(c)装置恰恰相反,下部锥形瓶中的物质相互反应产生气体,使锥形瓶内气体压强增大而产生压强差,将液体从锥形瓶中压入到上瓶形成“喷泉”。与反应生成微溶解于水,会使反应生成的气体量较少。
(5)酒精是易挥发物质,升高温度时酒精的挥发将加快,浓溶解于水中可放出大量的热。
答案:(1)A 因为密度比空气小,只能用向下排气法收集气体 浓 有白烟产生 湿润的酚酞试纸 变蓝
(2) (3)② (4)④ (5)①
(6)减小 增大 图(c)
例5. 下图是一种试验某气体化学性质的实验装置,图中B为开关,如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去,则D瓶中盛有的溶液是
6
A. 浓硫酸 B. 饱和氯化钠溶液
C. 浓氢氧化钠溶液 D. 氢氧化钙悬浊液
解析:红色布条颜色褪去,即布条被漂白,氯气起漂白作用的原理是氯气与水反应生成次氯酸,次氯酸将有色物质氧化为无色物质,氯气通过D瓶中的液体后C处的红色布条仍能褪色,这说明D瓶中的液体既不能干燥氯气,又不能吸收氯气,反而是使干燥的氯气变得湿润了,在题中提供的四项溶液中,浓硫酸能干燥氯气,浓氢氧化钠溶液和氢氧化钙悬浊液都能跟氯气发生化学反应,氯气在饱和氯化钠溶液中溶解度很小,但能从中获得水分,故答案为B。
答案:B。
例6. 三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有。
方案甲:试液白色沉淀沉淀不溶解
方案乙:试液无沉淀白色沉淀
方案丙:试液无沉淀白色沉淀
试评价上述各种方案是否严密,并分别说明理由。
解析:检验要防止的干扰,当加入、稀硝酸发现有白色沉淀时并不能证明一定有,因为也是不溶于稀硝酸的白色沉淀。
还要防止的干扰,和稀硝酸的试剂组合可排除的干扰,但不能排除的干扰,因为可以将氧化成,最好是先用盐酸看有无沉淀,有则滤去,无则证明没有,加入盐酸时,如有,则被转化成放出,再加入即证明是否存在。
答案:方案甲:不严密,因为含有而不含的无色透明溶液也会出现此现象。
方案乙:严密,因为只有含的无色透明溶液才会出现此现象。
方案丙:不严密,因为含有而不含的溶液也会出现此现象。
6
相关文档
- 红对勾高中物理人教版选修32练习462021-05-139页
- 高中区域地理分区东南亚涵盖高考所2021-05-134页
- 上海高中高考数学知识点总结大全2021-05-1317页
- 高考地理 第19讲 城市化(含解析)【更2021-05-136页
- 高中生物课堂笔记生物必修3来源:学2021-05-1327页
- 高中物理论文:基于两道物理高考题的2021-05-139页
- 高中选修物质与结构高考试题汇总至2021-05-1322页
- 金太阳 1 00所名校高中生物高考模2021-05-137页
- 2020版高中数学 第2章 算法初步测2021-05-138页
- 山东春季高考海曲高中数学模拟试题2021-05-136页