- 790.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014年北京市高考化学试卷
一、选择题:共7小题,每小题6分,共120分.在每小题给出的四个选项中,选出最符合题目要求的一项.
6.(6分)(2014•北京)下列试剂中,标签上应标注和的是( )
A.
C2H5OH
B.
HNO3
C.
NaOH
D.
HCl
7.(6分)(2014•北京)下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )
A.
K
B.
Na
C.
Fe
D.
Al
8.(6分)(2014•北京)下列电池工作时,O2在正极放电的是( )
A.
锌锰电池
B.
氢燃料电池
C.
铅蓄电池
D.
镍镉电池
9.(6分)(2014•北京)下列解释事实的方程式不正确的是( )
A.
测0.1mol/L氨水的pH为11:NH3•H2O⇌NH4++OH﹣
B.
将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑
C.
用CuCl2溶液做导电实验,灯泡发光:CuCl2Cu2++2Cl﹣
D.
Al片溶于NaOH溶液中,产生气体:2Al+2OH﹣+2H2O═2AlO﹣+3H2↑
10.(6分)(2014•北京)下列说法正确的是( )
A.
室温下,在水中的溶解度:丙三醇>苯酚>1﹣氯丁烷
B.
用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.
用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.
油脂在酸性或碱性条件下均可发生水解反应,且产物相同
11.(6分)(2014•北京)用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
①中实验
②中现象
A
铁粉与水蒸气加热
肥皂水冒泡
B
加热NH4Cl和Ca(OH)2混合物
酚酞溶液变红
C
NaHCO3固体受热分解
澄清石灰水变浑浊
D
石蜡油在碎瓷片上受热分解
Br2的CCl4溶液褪色
A.
A
B.
B
C.
C
D.
D
12.(6分)(2014•北京)一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.
0~6min的平均反应速率:v(H2O2)≈3.3×10﹣2mol/(L•min)
B.
6~10min的平均反应速率:v(H202)<3.3×10﹣2mol/(L•min)
C.
反应至6min时,c(H2O2)=0.30mol/L
D.
反应至6min时,H2O2分解了50%
二、非选择题:共4小题,共180分
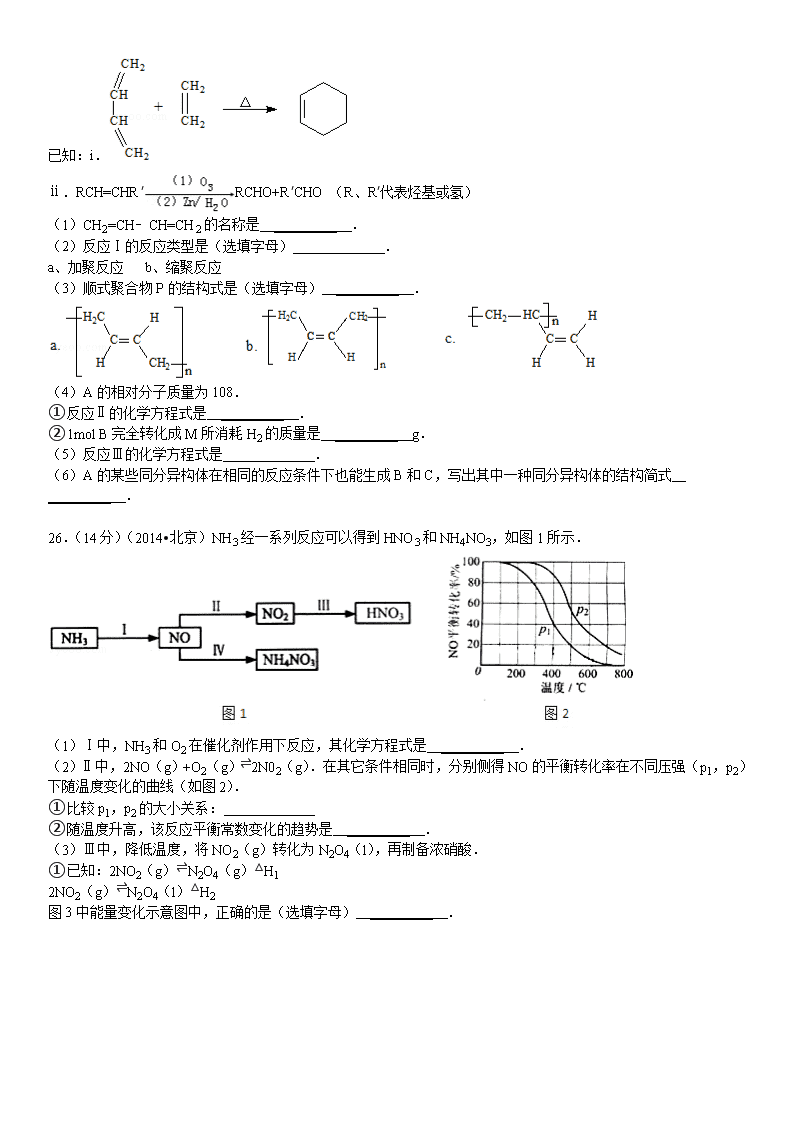
25.(17分)(2014•北京)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
已知:i.
ⅱ.RCH=CHR′RCHO+R′CHO (R、R′代表烃基或氢)
(1)CH2=CH﹣CH=CH2的名称是 _________ .
(2)反应Ⅰ的反应类型是(选填字母) _________ .
a、加聚反应 b、缩聚反应
(3)顺式聚合物P的结构式是(选填字母) _________ .
(4)A的相对分子质量为108.
①反应Ⅱ的化学方程式是 _________ .
②1mol B完全转化成M所消耗H2的质量是 _________ g.
(5)反应Ⅲ的化学方程式是 _________ .
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式 _________ .
26.(14分)(2014•北京)NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是 _________ .
(2)Ⅱ中,2NO(g)+O2(g)⇌2N02(g).在其它条件相同时,分别侧得NO的平衡转化率在不同压强(p1,p2)下随温度变化的曲线(如图2).
①比较p1,p2的大小关系: _________
②随温度升高,该反应平衡常数变化的趋势是 _________ .
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸.
①已知:2NO2(g)⇌N2O4(g)△H1
2NO2(g)⇌N2O4(l)△H2
图3中能量变化示意图中,正确的是(选填字母) _________ .
②N2O4与O2、H2O化合的化学方程式是 _________ .
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图4所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是 _________ ,说明理由: _________ .
27.(12分)(2014•北京)碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用图1装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
①气体a的成分是 _________ .
②若钢样中碳以FeS形式存在,A中反应:3FeS+5O21 _________ +3 _________ .
(2)将气体a通入测硫酸装置中(如图2),采用滴定法测定硫的含量.
①H2O2氧化SO2的化学方程式: _________
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数: _________ .
(3)将气体a通入测碳装置中(如图3),采用重量法测定碳的含量.
①气体a通过B和C的目的是 _________
②计算钢样中碳的质量分数,应测量的数据是 _________ .
28.(15分)(2014•北京)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a,b,c代表电压值):
序号
电压/V
阳极现象
检验阳极产物
Ⅰ
x≥a
电极附近出现黄色,有气泡产生
有Fe3+、有Cl2
Ⅱ
a>x≥b
电极附近出现黄色,无气泡产生
有Fe3+,无Cl2
Ⅲ
b>x>0
无明显变化
无Fe3+,无Cl2
(1)用KSCN溶液检测处Fe3+的现象是 _________ .
(2)Ⅰ中Fe3+产生的原因可能是Cl﹣在阳极放电,生成的Cl2将Fe2+氧化,写出有关反应: _________ .
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有 _________ 性.
(4)Ⅱ中虽未检验处Cl2,但Cl﹣在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照试验,记录如下:
序号
电压/V
阳极现象
检验阳极产物
Ⅳ
a>x≥c
无明显变化
有Cl2
Ⅴ
c>x≥b
无明显变化
无Cl2
①NaCl溶液的浓度是 _________ mol/L.
②Ⅳ中检验Cl2的实验方法: _________
③与Ⅱ对比,得出的结论(写出两点): _________ .
2014年北京市高考化学试卷
参考答案与试题解析
一、选择题:共7小题,每小题6分,共120分.在每小题给出的四个选项中,选出最符合题目要求的一项.
6.(6分)(2014•北京)下列试剂中,标签上应标注和的是( )
A.
C2H5OH
B.
HNO3
C.
NaOH
D.
HCl
考点:
硝酸的化学性质.菁优网版权所有
专题:
氮族元素.
分析:
警示标记标注和说明该物质具有强的氧化性和腐蚀性,据此解答.
解答:
解:A.C2H5OH为易燃品,不具有强的氧化性和腐蚀性,故A错误;
B.硝酸具有强的氧化性和腐蚀性,应标注和,故B正确;
C.NaOH具有腐蚀性,但是不具有氧化性,故C错误;
D.盐酸具有腐蚀性,但是不具有强的氧化性,故D错误;
故选:B.
点评:
本题考查硝酸的性质及警示标记,题目难度不大,明确警示标记的含义,熟悉硝酸的性质,是解答本题的关键.
7.(6分)(2014•北京)下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )
A.
K
B.
Na
C.
Fe
D.
Al
考点:
铝的化学性质.菁优网版权所有
专题:
几种重要的金属及其化合物.
分析:
由表面自然形成的氧化层能保护内层金属不被空气氧化可知,只有氧化铝为致密的结构,可保护内层金属,以此来解答.
解答:
解:由表面自然形成的氧化层能保护内层金属不被空气氧化可知,只有氧化铝为致密的结构,可保护内层金属,而K、Na、Fe的氧化物均不是致密的结构,
故选D.
点评:
本题考查Al的化学性质,为高频考点,把握氧化铝为致密的氧化物结构可保护内层金属为解答的关键,注意金属及其氧化物的性质,题目难度不大.
8.(6分)(2014•北京)下列电池工作时,O2在正极放电的是( )
A.
锌锰电池
B.
氢燃料电池
C.
铅蓄电池
D.
镍镉电池
考点:
真题集萃.菁优网版权所有
专题:
电化学专题.
分析:
A.锌锰干电池中,负极上锌失电子发生氧化反应、正极上二氧化锰得电子发生还原反应;
B.氢燃料电池中,负极上氢气失电子发生氧化反应、正极上氧气得电子发生还原反应;
C.铅蓄电池中,负极上铅失电子发生氧化反应、正极上二氧化铅得电子发生还原反应;
D.镍镉电池中,负极上Cd失电子发生氧化反应,正极上NiOOH得电子发生还原反应.
解答:
解:A.锌锰干电池中电极反应式,负极:Zn﹣2e﹣═Zn2+、正极2MnO2+2NH4++2e﹣=Mn2O3+2NH3+H2O,所以不符合题意,故A错误;
B.酸性氢氧燃料电池电极反应式为2H2﹣4e﹣=4H+、O2+4H++4 e﹣=2H2O,碱性氢氧燃料电池电极反应式为2H2﹣4e﹣+4OH=4H2O、O2+2H2O+4 e﹣=4OH﹣,所以符合题意,故B正确;
C.放电时负极电极反应:Pb﹣2e﹣+SO42﹣=PbSO4 ,正极电极反应:PbO2+2e﹣+4H++2SO42﹣=PbSO4+2H2O,所以不符合题意,故C错误;
D.放电正极:2NiOOH+2H2O+2e﹣=2Ni(OH)2+2OH﹣、负极:Cd+2OH﹣﹣2e﹣=Cd(OH)2,所以不符合题意,故D错误;
故选B.
点评:
本题考查了原电池原理,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度中等.
9.(6分)(2014•北京)下列解释事实的方程式不正确的是( )
A.
测0.1mol/L氨水的pH为11:NH3•H2O⇌NH4++OH﹣
B.
将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑
C.
用CuCl2溶液做导电实验,灯泡发光:CuCl2Cu2++2Cl﹣
D.
Al片溶于NaOH溶液中,产生气体:2Al+2OH﹣+2H2O═2AlO﹣+3H2↑
考点:
化学方程式的书写;电离方程式的书写.菁优网版权所有
专题:
离子反应专题;几种重要的金属及其化合物.
分析:
A.一水合氨为弱电解质,溶液中部分电离出铵根离子和氢氧根离子;
B.钠化学性质比较活泼,钠与水反应生成氢氧化钠和氢气;
C.氯化铜为电解质,溶液中电离出铜离子和氯离子,所以溶液能够导电;
D.金属铝能够与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答:
解:A.测0.1 mol/L氨水的pH为11,溶液显示碱性,原因是一水合氨为弱碱,溶液中部分电离出铵根离子和氢氧根离子,其电离方程式为:NH3•H2O⇌NH4++OH﹣,故A正确;
B.将Na块放入水中,钠能够与水反应生成氢气,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,故B正确;
C.用CuCl2溶液做导电实验,灯泡发光,氯化铜为强电解质,溶液中完全电离出铜离子和氯离子,电离过程不需要通电,氯化铜的电离方程式为CuCl2=Cu2++2Cl﹣,故C错误;
D.铝溶于NaOH溶液中,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH﹣+2H2O═2AlO﹣+3H2↑,故D正确;
故选C.
点评:
本题考查了化学方程式、电离方程式的书写判断,题目难度中等,注意掌握化学方程式、电离方程式的书写原则,能够正确书写常见反应的化学方程式,明确强弱电解质的概念,并且能够正确书写电离方程式.
10.(6分)(2014•北京)下列说法正确的是( )
A.
室温下,在水中的溶解度:丙三醇>苯酚>1﹣氯丁烷
B.
用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.
用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.
油脂在酸性或碱性条件下均可发生水解反应,且产物相同
考点:
有机物的鉴别;相似相溶原理及其应用;油脂的性质、组成与结构.菁优网版权所有
专题:
有机物的化学性质及推断.
分析:
A.含﹣OH越多,溶解性越大,卤代烃不溶于水;
B.HCOOCH3中两种H,HCOOCH2CH3中有三种H;
C.CH3COOH与碳酸钠溶液反应,而CH3COOCH2CH3不能;
D.油脂在酸性条件下水解产物为高级脂肪酸和甘油,碱性条件下水解产物为高级脂肪酸盐和甘油.
解答:
解:A.含﹣OH越多,溶解性越大,卤代烃不溶于水,则室温下,在水中的溶解度:丙三醇>苯酚>1﹣氯丁烷,故A正确;
B.HCOOCH3中两种H,HCOOCH2CH3中有三种H,则用核磁共振氢谱能区分HCOOCH3和HCOOCH2CH3,故B错误;
C.CH3COOH与碳酸钠溶液反应,而CH3COOCH2CH3不能,则用Na2CO3溶液能区分CH3COOH和CH3COOCH2CH3,故C错误;
D.油脂在酸性条件下水解产物为高级脂肪酸和甘油,碱性条件下水解产物为高级脂肪酸盐和甘油,水解产物不相同,故D错误;
故选A.
点评:
本题考查有机物的鉴别,为高频考点,把握常见有机物的性质及鉴别方法为解答的关键,注意溶解性与﹣OH的关系、油脂不同条件下水解产物等,题目难度不大.
11.(6分)(2014•北京)用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
①中实验
②中现象
A
铁粉与水蒸气加热
肥皂水冒泡
B
加热NH4Cl和Ca(OH)2混合物
酚酞溶液变红
C
NaHCO3固体受热分解
澄清石灰水变浑浊
D
石蜡油在碎瓷片上受热分解
Br2的CCl4溶液褪色
A.
A
B.
B
C.
C
D.
D
考点:
真题集萃;氨的实验室制法;乙烯的化学性质;铁及其化合物的性质实验;探究碳酸钠与碳酸氢钠的性质.菁优网版权所有
专题:
实验题.
分析:
A.试管中空气也能使肥皂水冒泡;
B.氯化铵和氢氧化钙混合加热生成氨气,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使溶液呈红色;
C.二氧化碳能使澄清石灰水变浑浊;
D.不饱和烃能使溴的四氯化碳褪色.
解答:
解:A.加热过程中的热空气、铁和水蒸气反应生成的氢气都能使肥皂水冒泡,所以肥皂水冒泡该反应不一定发生,故A错误;
B.NH4Cl+CaCl2NH3↑+CaCl2+H2O、NH3+H2O⇌NH3.H2O⇌NH4++OH﹣,氨水溶液呈碱性,所以能使酚酞试液变红色,故B正确;
C.2NaHCO3Na2CO3+CO2↑+H2O,二氧化碳能使澄清石灰水变浑浊,如果②中澄清石灰水变浑浊,则①中一定发生反应,故C正确;
D.溴的四氯化碳褪色说明有不饱和烃生成,所以①中一定发生化学反应,故D正确;
故选A.
点评:
本题考查了物质的性质及实验基本操作及反应现象,明确实验原理是解本题关键,再结合物质的性质分析解答,题目难度不大.
12.(6分)(2014•北京)一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.
0~6min的平均反应速率:v(H2O2)≈3.3×10﹣2mol/(L•min)
B.
6~10min的平均反应速率:v(H202)<3.3×10﹣2mol/(L•min)
C.
反应至6min时,c(H2O2)=0.30mol/L
D.
反应至6min时,H2O2分解了50%
考点:
反应速率的定量表示方法.菁优网版权所有
专题:
化学反应速率专题.
分析:
根据化学反应速率之比等化学计量数之比进行计算,根据化学反应的定义进行计算,得出正确结论.
解答:
解:2H202=2H2O+O2
A.n(O2)=×10﹣3=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=≈3.3×10﹣2mol/(L•min),故A正确;
B.=3.73,=1.88,3.73>1.88,故单位时间内产生的氧气,0~6min大于6~10min,故6~10min的平均反应速率:v(H202)<3.3×10﹣2mol/(L•min),故B正确;
C.6min时,c(H2O2)=0.40﹣=0.20mol/L,故C错误;
D.6min时,H2O2分解的分解率为:=50%,故D正确,
故选C.
点评:
本题考查化学反应速率的相关计算,把握化学反应速率之比等化学计量数之比为解答的关键,难度不大.
二、非选择题:共4小题,共180分
25.(17分)(2014•北京)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
已知:i.
ⅱ.RCH=CHR′RCHO+R′CHO (R、R′代表烃基或氢)
(1)CH2=CH﹣CH=CH2的名称是 1,3﹣丁二烯 .
(2)反应Ⅰ的反应类型是(选填字母) a .
a、加聚反应 b、缩聚反应
(3)顺式聚合物P的结构式是(选填字母) b .
(4)A的相对分子质量为108.
①反应Ⅱ的化学方程式是 2CH2=CH﹣CH=CH2 .
②1mol B完全转化成M所消耗H2的质量是 6 g.
(5)反应Ⅲ的化学方程式是 .
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式 .
考点:
真题集萃;有机物的合成.菁优网版权所有
专题:
有机物的化学性质及推断.
分析:
根据转化关系知,1,3﹣丁二烯发生聚合反应I得到顺式聚合物P为聚顺1,3﹣丁二烯,则P的结构简式为,由信息i知,在加热条件下发生反应II生成A,A的结构简式为,A发生反应生成B和C,B和氢气发生加成反应生成M,则B的结构简式为,C和二氯苯酚发生反应生成N,C为醛,根据N中碳原子个数知,一个C分子和两个二氯苯酚分子发生反应生成N,N的结构简式为,则C的结构简式为HCHO,再结合题目分析解答.
解答:
解:根据转化关系知,1,3﹣丁二烯发生聚合反应I得到顺式聚合物P为聚顺1,3﹣丁二烯,则P的结构简式为,由信息i知,在加热条件下发生反应II生成A,A的结构简式为,A发生反应生成B和C,B和氢气发生加成反应生成M,则B的结构简式为
,C和二氯苯酚发生反应生成N,C为醛,根据N中碳原子个数知,一个C分子和两个二氯苯酚分子发生反应生成N,N的结构简式为,则C的结构简式为HCHO,
(1)CH2=CH﹣CH=CH2的名称是1,3﹣丁二烯,故答案为:1,3﹣丁二烯;
(2)通过以上分析知,反应Ⅰ的反应类型是加聚反应,故选a;
(3)通过以上分析知,顺式聚合物P的结构式是,故选b;
(4)①A的相对分子质量为108,1,3﹣丁二烯的相对分子质量是56,则A的结构简式为,则
反应Ⅱ的化学方程式是2CH2=CH﹣CH=CH2,
故答案为:2CH2=CH﹣CH=CH2;
②B的结构简式为,1mol B完全转化成M所消耗H2的物质的量是3mol,则氢气的质量是6g,故答案为:6;
(5)C是甲醛,甲醛和二氯苯酚反应生成N,所以反应Ⅲ是C和二氯苯酚反应生成的化学方程式是,
故答案为:;
(6)根据以上分析知,B是
、C是HCHO,A的某些同分异构体在相同的反应条件下也能生成B和C,符合条件A的同分异构体有,故答案为:.
点评:
本题考查了有机物的推断,根据1,3﹣丁二烯为突破口结合题给信息、M和N的结构简式确定发生的反应,注意理解题给信息中有机物的断键和成键物质及服饰,难点是同分异构体结构简式的判断,题目难度中等.
26.(14分)(2014•北京)NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是 4NH3+5O24NO+6H2O .
(2)Ⅱ中,2NO(g)+O2(g)⇌2N02(g).在其它条件相同时,分别侧得NO的平衡转化率在不同压强(p1,p2)下随温度变化的曲线(如图2).
①比较p1,p2的大小关系: p1<p2
②随温度升高,该反应平衡常数变化的趋势是 减小 .
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸.
①已知:2NO2(g)⇌N2O4(g)△H1
2NO2(g)⇌N2O4(l)△H2
图3中能量变化示意图中,正确的是(选填字母) A .
②N2O4与O2、H2O化合的化学方程式是 2N2O4+O2+2H2O=4HNO3 .
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图4所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是 NH3 ,说明理由: 根据反应8NO+7H2O3NH4NO3+2HNO3,电解生成的HNO3多 .
考点:
化学平衡常数的含义;反应热和焓变;化学平衡的影响因素;电解原理.菁优网版权所有
专题:
化学反应中的能量变化;化学平衡专题;电化学专题.
分析:
(1)氨气与氧气在催化剂加热的条件下生成NO与水;
(2)①已知2NO(g)+O2(g)⇌2N02(g)是正方向体积减小的反应,根据压强对平衡的影响分析;
②根据图象2判断该反应正方向是放热还是吸热,再判断K随温度的变化;
(3)①降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)⇌N2O4(l)为放热反应,同种物质液态时能量比气态时能量低;
②N2O4与O2、H2O化合生成硝酸,根据得失电子守恒和原子守恒写出反应的方程式;
(4)根据电解NO制备NH4NO3的反应方程式分析判断.
解答:
解:(1)氨气与氧气在催化剂加热的条件下生成NO与水,反应方程式为:4NH3+5O24NO+6H2O;
故答案为:4NH3+5O24NO+6H2O;
(2)①已知2NO(g)+O2(g)⇌2N02(g)是正方向体积减小的反应,增大压强平衡正移,则NO的转化率会增大,由图可知P2时NO的转化率大,则P2时压强大,
即P1<P2;
故答案为:P1<P2;
②由图象2可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,所以升高温度平衡常数K减小;
故答案为:减小;
(3)①降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)⇌N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,故A正确;
故答案为:A;
②N2O4与O2、H2O化合生成硝酸,其反应的化学方程式为:2N2O4+O2+2H2O=4HNO3;
故答案为:2N2O4+O2+2H2O=4HNO3;
(4)电解NO制备NH4NO3,其电解方程式为:8NO+7H2O3NH4NO3+2HNO3,电解生成的HNO3多,生成的NH3少,若要使电解产物全部转化为NH4NO3,需补充NH3;
故答案为:NH3;根据反应8NO+7H2O3NH4NO3+2HNO3,电解生成的HNO3多.
点评:
本题考查了化学方程式书写、影响平衡及平衡常数的因素、能量变化图的分析等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.
27.(12分)(2014•北京)碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用图1装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
①气体a的成分是 SO2、CO2、O2 .
②若钢样中碳以FeS形式存在,A中反应:3FeS+5O21 Fe3O4 +3 SO2 .
(2)将气体a通入测硫酸装置中(如图2),采用滴定法测定硫的含量.
①H2O2氧化SO2的化学方程式: H2O2+SO2=H2SO4
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数: .
(3)将气体a通入测碳装置中(如图3),采用重量法测定碳的含量.
①气体a通过B和C的目的是 排除二氧化硫对二氧化碳测定的干扰
②计算钢样中碳的质量分数,应测量的数据是 二氧化碳前后吸收瓶的质量 .
考点:
真题集萃;含硫物质的性质及综合应用;探究物质的组成或测量物质的含量.菁优网版权所有
专题:
实验探究和数据处理题.
分析:
(1)①该装置中C、S和氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,﹣2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数;
(3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰;
②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量.
解答:
解:(1)①该装置中C、S在A装置中被氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余,所以气体a的成分是SO2、CO2、O2,故答案为:SO2、CO2、O2;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,﹣2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁,所以反应方程式为3FeS+5O2Fe3O4+3SO2,
故答案为:Fe3O4;SO2;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水,反应方程式为 H2O2+SO2=H2SO4,故答案为:H2O2+SO2=H2SO4;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL
NaOH溶液相当于硫的质量为yzg,硫的质量分数为=,故答案为:;
(3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰,所以装置B和C的作用是除去二氧化硫,故答案为:排除二氧化硫对二氧化碳测定的干扰;
②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量,所以需要测定吸收二氧化碳前后吸收瓶的质量,故答案为:二氧化碳前后吸收瓶的质量.
点评:
本题考查了C、S含量的测定,涉及氧化还原反应、方程式的配平等知识点,明确实验原理是解本题关键,结合物质的性质来分析解答,题目难度中等.
28.(15分)(2014•北京)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a,b,c代表电压值):
序号
电压/V
阳极现象
检验阳极产物
Ⅰ
x≥a
电极附近出现黄色,有气泡产生
有Fe3+、有Cl2
Ⅱ
a>x≥b
电极附近出现黄色,无气泡产生
有Fe3+,无Cl2
Ⅲ
b>x>0
无明显变化
无Fe3+,无Cl2
(1)用KSCN溶液检测处Fe3+的现象是 溶液变红 .
(2)Ⅰ中Fe3+产生的原因可能是Cl﹣在阳极放电,生成的Cl2将Fe2+氧化,写出有关反应: 2Cl﹣﹣2e﹣=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl﹣ .
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有 还原 性.
(4)Ⅱ中虽未检验处Cl2,但Cl﹣在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照试验,记录如下:
序号
电压/V
阳极现象
检验阳极产物
Ⅳ
a>x≥c
无明显变化
有Cl2
Ⅴ
c>x≥b
无明显变化
无Cl2
①NaCl溶液的浓度是 0.2 mol/L.
②Ⅳ中检验Cl2的实验方法: 取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色
③与Ⅱ对比,得出的结论(写出两点): 通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl﹣放电 .
考点:
电解原理;二价Fe离子和三价Fe离子的检验.菁优网版权所有
专题:
电化学专题.
分析:
(1)依据铁离子的检验方法和试剂颜色变化分析;
(2)依据电解原理,氯离子在阳极失电子生成氯气,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色;
(3)Fe3+产生的原因还可能是Fe2+在阳极放电,依据氧化还原反应分析Fe2+具有还原性;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行分析判断;
②依据检验氯气的实验方法分析;
③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,生成铁离子的两种可能.
解答:
解:(1)检验铁离子的试剂是硫氰酸钾溶液,用KSCN溶液检测处Fe3+的现象是溶液变红色,故答案为:溶液变红;
(2)依据电解原理,氯离子在阳极失电子生成氯气,电极反应为:2Cl﹣﹣2e﹣=Cl2↑,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl﹣;
故答案为:2Cl﹣﹣2e﹣=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl﹣;
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析Fe2+具有还原性,故答案为:还原性;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2;
②依据检验氯气的实验方法分析,取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色证明生成氯气,否则无氯气生成,
故答案为:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色;
③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,说明生成铁离子的两种可能,
故答案为:通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl﹣放电.
点评:
本题考查了离子检验方法和现象分析,电解原理的分析应用,电解反应,电极产物的理解应用,掌握基础是关键,题目难度中等.