- 611.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
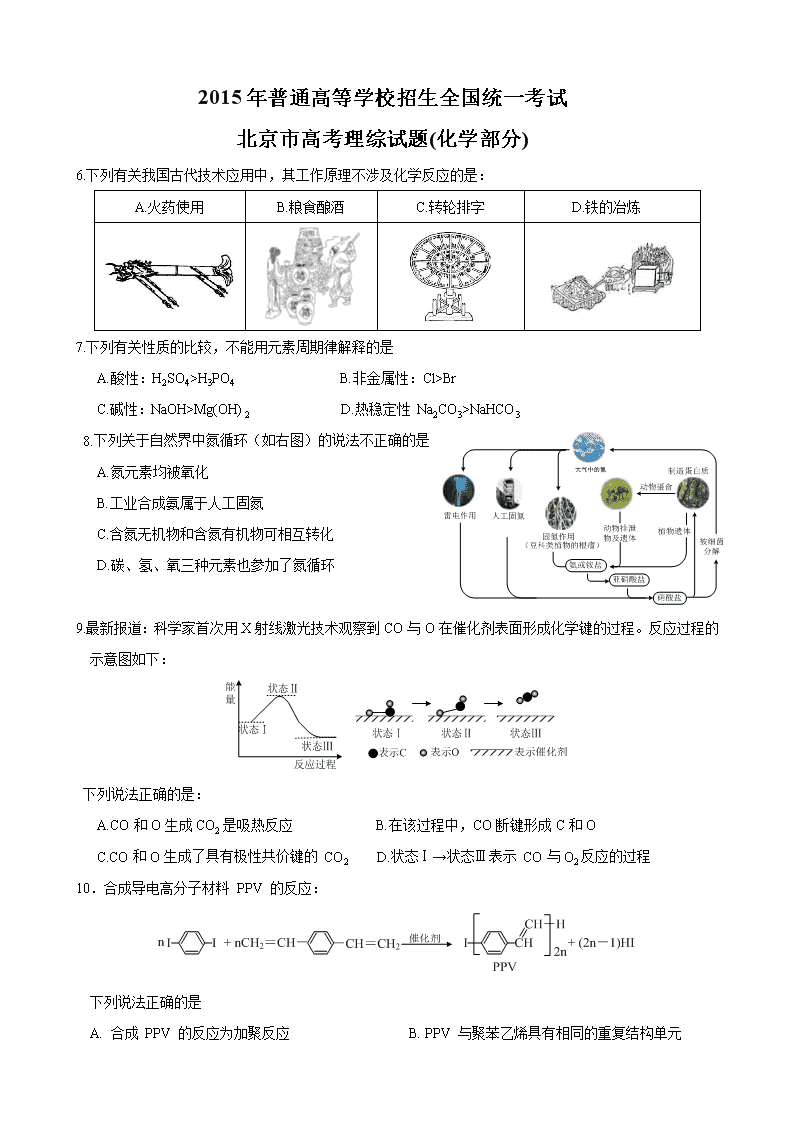
2015年普通高等学校招生全国统一考试
北京市高考理综试题(化学部分)
6.下列有关我国古代技术应用中,其工作原理不涉及化学反应的是:
A.火药使用
B.粮食酿酒
C.转轮排字
D.铁的冶炼
7.下列有关性质的比较,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2 D.热稳定性 Na2CO3>NaHCO3
8.下列关于自然界中氮循环(如右图)的说法不正确的是
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参加了氮循环
9.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的
示意图如下:
下列说法正确的是:
A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的 CO2 D.状态Ⅰ→状态Ⅲ表示 CO与O2反应的过程
10.合成导电高分子材料 PPV 的反应:
下列说法正确的是
A. 合成 PPV 的反应为加聚反应 B. PPV 与聚苯乙烯具有相同的重复结构单元
C. 和苯乙烯互为同系物
D. 通过质谱法测定 PPV 的平均相对分子质量,可得其聚合度
11.某消毒液的主要成分为 NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中,不合理的是(已
知:饱和 NaClO 溶液的 pH约为 11)
A.该消毒液可用 NaOH 溶液吸收Cl2制备: Cl2 + 2OH- == Cl-+ClO-+H2O
B.该消毒液的 pH 约为 12:ClO-+ H2O HClO + OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒 Cl2: 2H+ + Cl-+ClO- == Cl2↑+ H2O
D.该消毒液加白醋生成 HClO,可增强漂白作用: CH3COOH + ClO- == HClO + CH3COO-
12.在通风橱中进行下列实验
步骤
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
下列说法中不正确的是:
A.Ⅰ中气体由无色变为红棕色的化学方程式:2NO+O2=2NO2
B.Ⅱ中的现象说明 Fe 表面形成致密的氧化膜,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中的现象,说明稀 HNO3的氧化性强于浓 HNO3
D.针对Ⅲ中的现象,在 Fe、Cu 之间连接电流计,可判断 Fe 是否被氧化
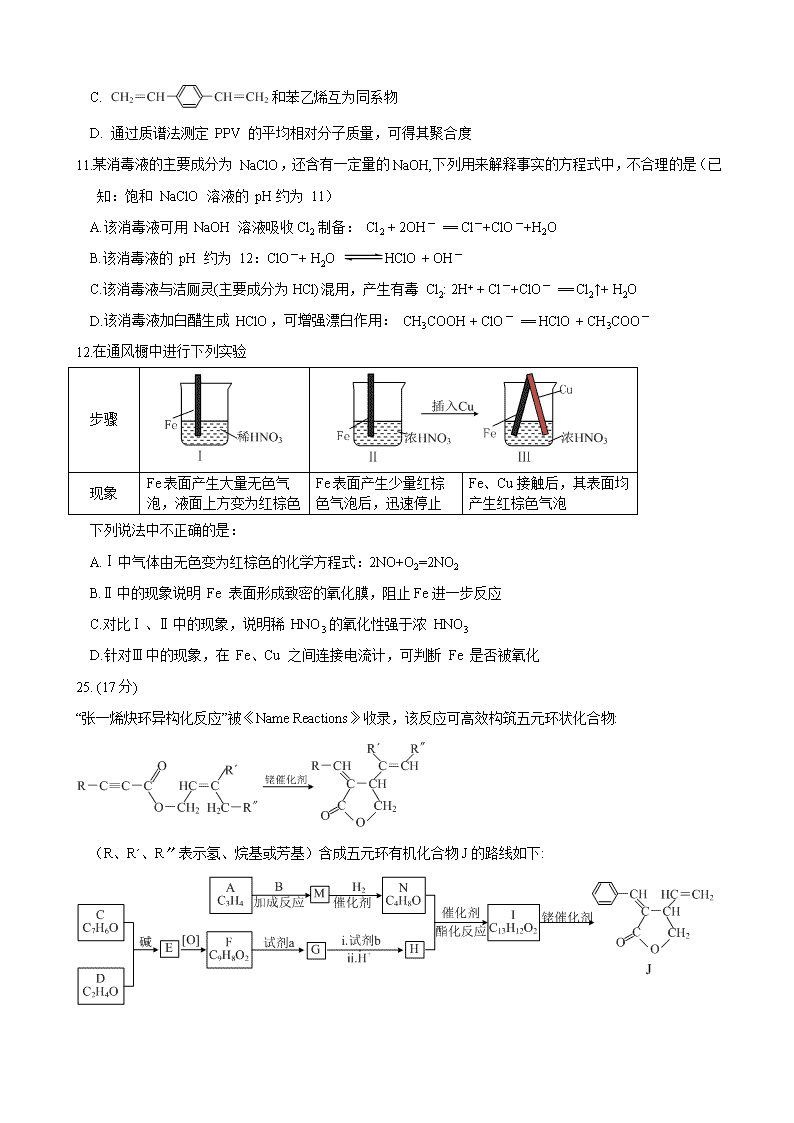
25. (17分)
“张一烯炔环异构化反应”被《Name Reactions》收录,该反应可高效构筑五元环状化合物:
(R、Rˊ、R〞表示氢、烷基或芳基)含成五元环有机化合物J的路线如下:
已知:
(1)A属于炔烃,其结构简式是 。
(2)B由碳、氢、氧三种元素组成,相对分子质量是30。 B的结构简式是 。
(3)C、D含有相同的官能团,C是芳香族化合物。E中含有的官能团是 。
(4)F与试剂a反应生成G的化学方程式是 ;试剂b是 。
(5) M和N均为不饱和醇。M的结构简式是 。
(6)N为顺式结构,写出N和H生成I(顺式结构)的化学方程式 。
26.(12分)
氢能是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应I的化学方程式是 。
(2)反应I得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层一一含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异 b.加I2前,H2SO4溶液和HI溶液不互溶
c. I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是
③经检测,H2SO4层中c(H+):c(SO2-4) =2.06:1,其比值大于2的原因 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g) + O2(g) +2H2O(g) △H=+550kJ•mol-1
它由两步反应组成:
i. H2SO4(l) =SO3(g) +H2O(g) , △H=+177kJ•mol-1
ii. SO3(g)分解。
L(Ll, L2),X可分别代表压强或温度,下图表示L一定时,ii中SO3(g)
的平衡转化率随X的变化关系。
①X代表的物理量是 。
②判断Ll,L2的大小关系,并简述理由: 。
27.(14分)
研究CO2在海洋重工的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO-3占95%。写出CO2溶于水产生HCO-3的方程式 。
(2)在海洋碳循环中,通过右图所示的途径固碳。
①写出钙化作用的离子方程式 。
②同位素示踪法证实光合作用的化学方程式如下,将其补充完整:
+ (CH2O)x +x18O2 +xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:
①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用x mol•L-1 HCl溶液滴定,消耗y mLHCl溶液。海水中溶解无机碳的浓度= mol•L-1。
(4)利用右图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理:
②用该装置产生的物质处理b室排出的海水合格后排回大海。处理至合格的方法是
28.(15分)
为探讨化学平衡与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3+ +2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到
(2) iii是ii的对比实验,目的是排除ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因 。
(4)根据氧化还原反应的规律,该同学推测ⅰ中Fe2+向Fe3+转化的原因:外加Ag+使c (I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a,b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管中满加0.0lmol/LAgNO3溶液,产生的现象证实了其推测。该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实ii中Fe2+向Fe3+转化的原因。
①转化的原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I-> Fe2+:而实验II中,还原性Fe2+ >I-。将(3)和(4)、(5)作对比,得出结论是
。
2015年普通高等学校招生全国统一考试
北京市高考理综试题(化学参考答案)
题号
6
7
8
9
10
11
12
答案
C
D
A
C
D
B
C
25. (1)CH3-C≡CH (2)HCHO (3)碳碳双键、醛基
(4) NaOH的醇溶液
(5)CH3-C≡C-CH2OH
(6)
26. (1)SO2 + I2 +2H2O == 2HI + H2SO4
(2) ①a、c ②观察两层颜色,颜色深的是HI层,颜色浅的是H2SO4 ③存在少量HI
(3) ①压强 ②L2>L1 2SO3(g)2SO2(g)+O2(g) △=+196kJ•mol-1 根据压强增大,平衡逆向移动,确定X为压强,再由于反应吸热,所以在压强不变时,温度升高,平衡正向移动,所以L2>L1
27.(1) CO2 + H2O H2CO3 H2CO3H+ + HCO-3
(2) ①Ca2+ +2HCO-3 == CaCO3↓+ H2O +CO2↑ ②x CO2 +2xH218O (CH2O)n +x18O2 +xH2O
(3)① ②
(4) ①a室(阳极区)发生如下反应:2H2O-4e- =O2↑ +4H+, H+通过阳离子交换膜进入b室,与其中的
HCO-3发生反应:H+ + HCO-3 == H2O + CO2↑ ,产生CO2
②用c室产物NaOH溶液调节b室流出溶液的pH,至pH≈8
28.(1)平衡状态 (2)溶液稀释,c(Fe2+)降低
(3)i中Ag+消耗I-:Ag+(aq)+I-(aq) AgI(s) ,I-浓度下降,使平衡2Fe3+ + 2I-2Fe2+ +I2
逆向移动;ⅱ中增大Fe2+浓度,同样平衡2Fe3+ + 2I-2Fe2+ +I2逆向移动。
(4)①正 ②左侧溶液颜色褪色,有黄色沉淀生成,电流计指针向左偏转。
(5)①c(Fe2+)升高,导致Fe2+的还原性强于I-。
②当指针归零后,不向左管滴加AgNO3溶液, 而是向右管加入1mL1mol•L-1FeSO4溶液。
(6)还原剂还原性强弱与浓度有关,提高某种还原剂浓度可增强其还原性。
说明:1.高清试卷制作人:新洲吴秋生
2.所有图形由个人制作完成。图形用Visio2007制作,然后在Word2007中“选择性粘贴”→“图片(增强型图元文件)”进行粘贴, 图形放大缩小清晰度不变。试卷完成后保存为 Word2003版本(鉴于很多老师用Word2003)。
3.个人精力有限,制作中可能会出现少量编辑、遗漏、规范等问题,请专家批评指正(长期有效)。
邮箱:wqniao@sina.com QQ: 6937945(阿笨猫) (只讨论试卷上的问题,不聊天!)
4.制作目的:为广大高中化学老师免费提供高清试卷,方便出题、组题。
5.不搞水印、不设置障碍、不反对同仁转载其它网站赚点或利用本卷制作试卷解析等。
只需留下原卷最后“说明1~4”就行,这是对我制卷最大的支持。
6.已经制作高清化学试卷14套:(截止2015年6月30日晚完工)
2015年高考化学部分(新课标Ⅰ、新课标Ⅱ、安徽、北京、福建、广东、海南、江苏、山东、上海、四川、天津、浙江含自选、重庆)