- 76.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010年高考理综试题(天津卷)
1.(2010天津高考)以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
2.(2010天津高考)化学已渗透到人类生活的各个方面。下列说法不正确的是
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
3.(2010天津高考)下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
4.(2010天津高考)下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
5.(2010天津高考)列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ =Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2:Na2O2 +H2O =2Na+ + 2OH-+O2↑
C.将氯气溶于水制备次氯酸:Cl2+H2O =2H+ + Cl-+ ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+ 6H+ + 5H2O2=2Mn2+ + 5O2↑ + 8H2O
6.(2010天津高考)下列各表述与示意图一致的是
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1
NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)ΔH < 0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)CH3CH3(g);ΔH< 0
7.(2010天津高考)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L- 1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
8.(2010天津高考)Ⅰ.已知:R-CH=CH-O-R′ R-CH2CHO + R′OH
(烃基烯基醚)
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
请回答下列问题:
⑴ A的分子式为_________________。
⑵ B的名称是___________________;A的结构简式为________________________。
⑶写出C → D反应的化学方程式:_______________________________________。
⑷写出两种同时符合下列条件的E的同分异构体的结构简式:
_________________________、________________________。
①属于芳香醛;
②苯环上有两种不同环境的氢原子。
Ⅱ.由E转化为对甲基苯乙炔()的一条路线如下:
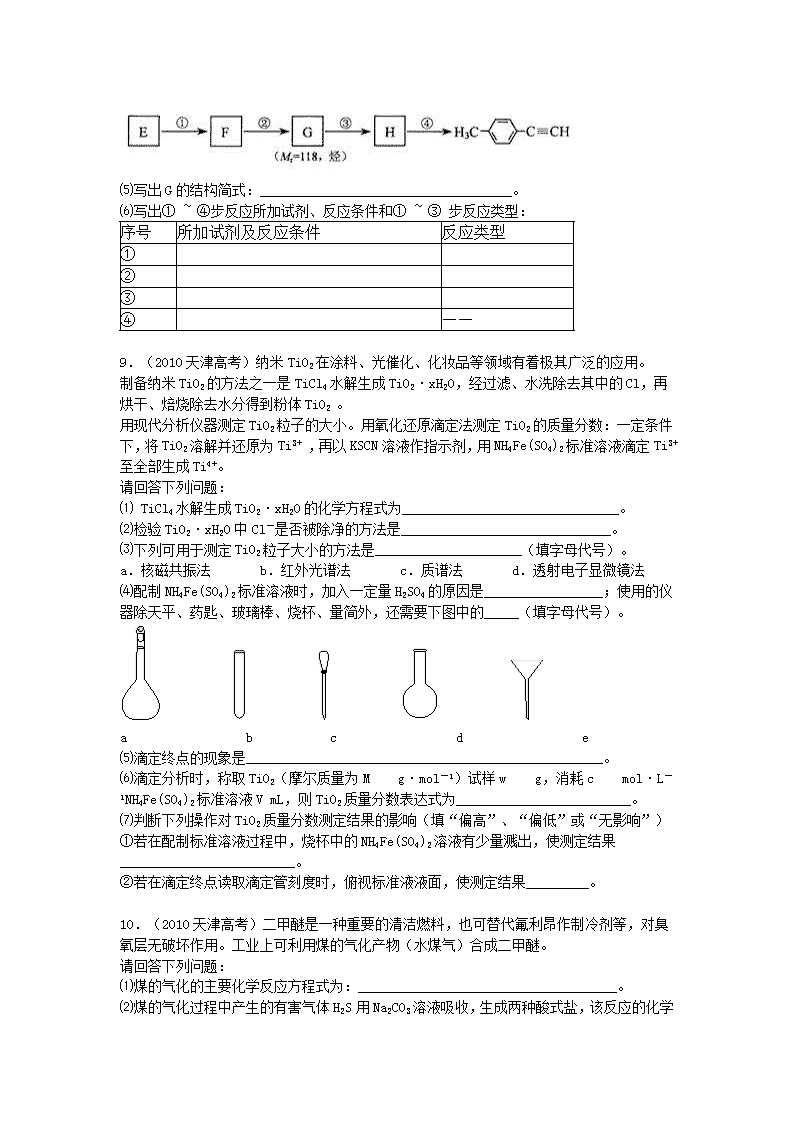
⑸写出G的结构简式:____________________________________。
⑹写出① ~ ④步反应所加试剂、反应条件和① ~ ③ 步反应类型:
序号
所加试剂及反应条件
反应类型
①
②
③
④
——
9.(2010天津高考)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
⑵检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
⑶下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
⑷配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
a b c d e
⑸滴定终点的现象是___________________________________________________。
⑹滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑺判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
10.(2010天津高考)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴煤的气化的主要化学反应方程式为:_____________________________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3
溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g)CH3OH(g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g)CH3OCH3(g)+CO2 (g)的ΔH=___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/(mol·L-1)
0.44
0.6
0.6
①比较此时正、逆反应速率的大小:v正______ v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) =_________;该时间内反应速率v(CH3OH) =__________。
《2010年高考理综试题(天津卷)》参考答案
1.D 2.C 3.C 4.B 5.A 6.B
7.⑴O
第3周期 第ⅢA族
Al > C > N > O > H
⑵
⑶34 H2SeO4 b
⑷Al + 3HCO3--3e- =Al(OH)3↓ +CO2↑
(或Al-3e-=Al3+ Al3+ + 3HCO3- =Al(OH)3↓ +CO2↑
2Al(OH)3 Al2O3 + 2H2O
8.⑴C12H16O
⑵1-丙醇(或正丙醇)
⑶CH3CH2CHO+2Ag(NH3)2OHCH3CH2COONH4+2Ag↓+3NH3 +H2O
⑷
(写出其中两种)
⑸
⑹
序号
所加试剂及反应条件
反应类型
①
H2,催化剂(或Ni、Pt、Pd),△
还原(或加成)反应
②
浓H2SO4,△
消去反应
③
Br2(或Cl2)
加成反应
④
NaOH,C2H5OH,△
——
9.⑴TiCl4 + (x+2)H2O TiO2·xH2O↓ + 4HCl
⑵取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。
⑶d
⑷抑制NH4Fe(SO4)2水解
a c
⑸溶液变为红色
⑹ (或%)
⑺①偏高 ②偏低
10.⑴C +H2O CO +H2
⑵H2S+Na2CO3 =NaHS + NaHCO3
⑶-246.4 kJ·mol-1 ;c e
⑷① >
②0.04 mol·L-1 0.16mol/L·min