- 282.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014年重庆高考化学试题解析
1.下列物质的使用不涉及化学变化的是( )
A.明矾用作净水剂 B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
【解题思路】有新物质生成的变化属于化学变化。显然,在四个选项中,液氨用作制冷剂只涉及氨的状态变化,属于物理变化,选项B符合题意。
参考答案:B
2.下列实验可实现鉴别目的的是( )
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
【解题思路】选项A, SO3(g)和SO2与KOH溶液反应没有明显现象,A错;选项B,两种气体均为红棕色,Br2(g)能使湿润碘化钾淀粉试纸变蓝,NO2与H2O反应生成HNO3,HNO3能将 I-氧化成I2,也能使湿润碘化钾淀粉试纸变蓝,B错;选项C,向NaAlO2溶液中通入CO2气体,有 Al(OH)3白色沉淀生成,而与CH3COONa溶液不发生反应,C正确;选项D,均有白色沉淀生成,D错。
参考答案:C
3.下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B. CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C. Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D. 25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
【解题思路】选项A,此方法只能得到Fe(OH)3沉淀,A错;选项B,根据弱电解质的电离平衡,CH3COONa溶液中滴加少量浓盐酸后,由于发生CH3COO-+H+CH3COOH,导致c(CH3COO-)减小,B错;选项C,该反应的化学方程式为Ca(HCO3)2+2NaOH(过量) =CaCO3↓+Na2CO3+2H2O, C错;选项D,根据难溶物的溶解平衡,在Cu(NO3)2溶液中平衡Cu(OH)2 (s) Cu2+(aq) + 2OH- (aq)左移 ,故25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度,D正确。
参考答案:D
4.茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
【解题思路】选项A,灼烧茶叶使之灰化,要用到酒精灯、泥三角、坩埚、A正确;选项B,用浓硝酸溶解茶叶灰并加蒸馏水稀释,不需要容量瓶,B错;选项C,过滤操作需要漏斗、玻璃棒和烧杯,C正确;选项D,检验滤液中的Fe3+,需要试管、胶头滴管和KSCN溶液,D正确。
参考答案:B
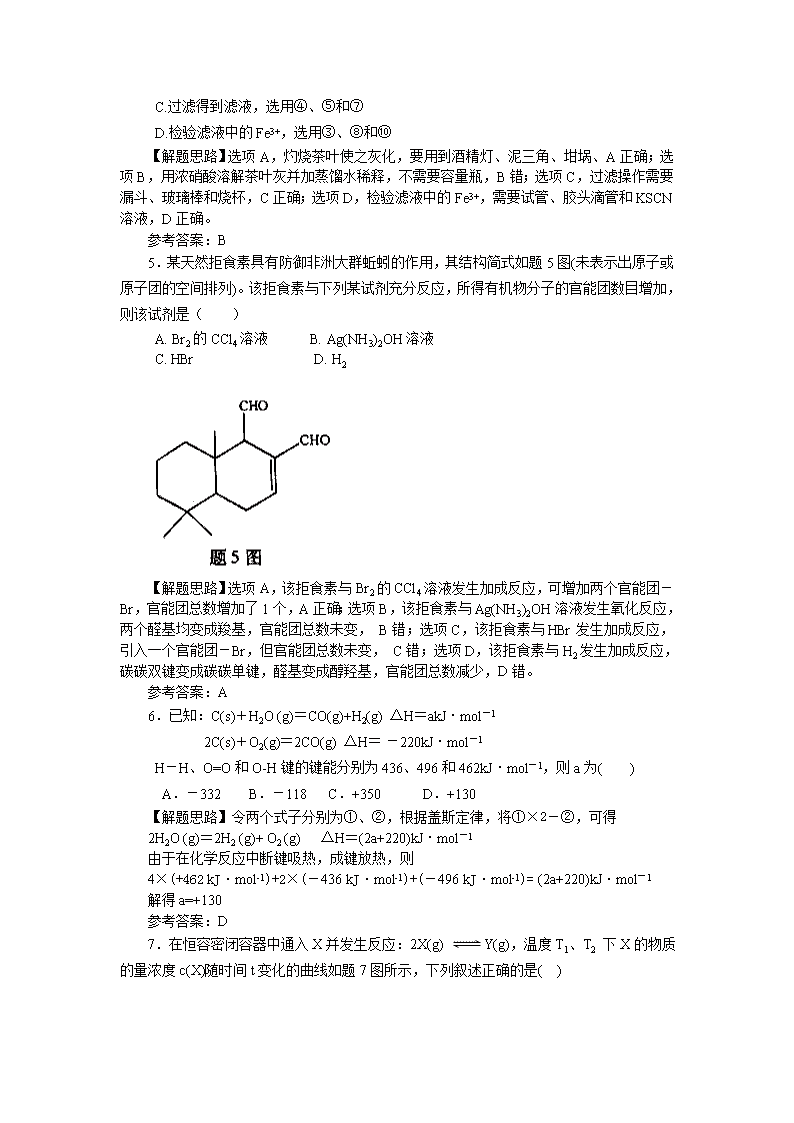
5.某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如题5图(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
A. Br2的CCl4溶液 B. Ag(NH3)2OH溶液
C. HBr D. H2
【解题思路】选项A,该拒食素与Br2的CCl4溶液发生加成反应,可增加两个官能团-Br,官能团总数增加了1个,A正确;选项B,该拒食素与Ag(NH3)2OH溶液发生氧化反应,两个醛基均变成羧基,官能团总数未变, B错;选项C,该拒食素与HBr发生加成反应,引入一个官能团-Br,但官能团总数未变, C错;选项D,该拒食素与H2发生加成反应,碳碳双键变成碳碳单键,醛基变成醇羟基,官能团总数减少,D错。
参考答案:A
6.已知:C(s)+H2O (g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH= -220kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
【解题思路】令两个式子分别为①、②,根据盖斯定律,将①×2-②,可得
2H2O (g)=2H2 (g)+ O2 (g) ΔH=(2a+220)kJ·mol-1
由于在化学反应中断键吸热,成键放热,则
4×(+462 kJ·mol-1)+2×(-436 kJ·mol-1)+(-496 kJ·mol-1)= (2a+220)kJ·mol-1
解得a=+130
参考答案:D
7.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2 下X的物质的量浓度c(X)随时间t变化的曲线如题7图所示,下列叙述正确的是( )
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,
C. M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
【解题思路】根据图像可知,T1>T2,该反应分别在温度T1、T2达到平衡时,温度越高,X的物质的量浓度越大,逆反应是吸热反应,则正反应是放热反应,即该反应的ΔH<0。选项A,该反应进行到W点时比进行到M时X转化得更多,放出的热量也更多,A错;选项B,T2下,在0~t1时间内,,由于,则,B错;选项C,M点处于平衡状态,其v正= v逆,由于T1>T2,从图像看M点的Y的物质的量浓度大于N点的Y的物质的量浓度,故M点的v逆大于N点的v逆,C正确;选项D,M点时再加入一定量X,相当于加压,平衡将正向移动,平衡后X的转化率将增大,D错。
参考答案:C
8.(15分)月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1) 3He是高效核能原料,其原子核内中子数为___________。
(2)Na的原子结构示意图为_______,Na在氧气中完全燃烧所得产物的电子式为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点__________(填“高”或”低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为____________________;SiO2的晶体类型为_________。
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___________________ (写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1kg3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵___________kg。
【解题思路】(1)根据“质量数=质子数+中子数”,可知3He原子核内中子数为3-2=1。
(2)Na的原子结构示意图为,Na在氧气中完全燃烧所得产物是Na2O2,其电子式为。
(3)①由于Mg2+的半径比Ba2+的半径小,MgO的离子键键能比BaO的的离子键键能大,故MgO的熔点比BaO的熔点高。
②可用NaOH溶液除去MgO中含有的少量SiO2,有关的离子方程式为SiO2+2OH-= SiO32-+H2O;SiO2属于原子晶体。
③MgO与碳粉和氯气在一定条件下反应制备MgCl2,反应的化学方程式为2MgO+C+2Cl2=2MgCl2+CO2(反应条件略去),若尾气用足量NaOH溶液完全吸收,生成的盐为NaCl、NaClO、Na2CO3。
(4)设最多可生产碳酸氢铵的质量为x,由N2+3H22NH3可知H2过量,结合NH3+CO2+H2O=NH4HCO3,则有
N2——2 NH4HCO3
28kg 158kg
700kg x
可得,解得x=3950kg
参考答案:
(1)1
(2)
(3) ①高
②SiO2+2OH-= SiO32-+H2O;原子晶体
③NaCl、NaClO、Na2CO3。
(4)3950
9.(15分)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用题9图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)仪器A的名称是______________,水通入A的进口为_____________。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为___________________。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题9图2中的____________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________________;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为______ g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____________。
【解题思路】(1)仪器A是冷凝管或冷凝器,水通入A时应该是“下进上出”即进口为b。
(2)SO2与H2O2反应的化学方程式为SO2+H2O2=H2SO4。
(3)应该用碱式滴定管盛装NaOH溶液,滴定前排气泡时应选择题9图2中的③;滴定终点时溶液的pH=8.8,应选择酚酞作指示剂;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积大于40mL。
(4)设该葡萄酒中SO2的物质的量为x,根据有关反应SO2+H2O2=H2SO4、2NaOH+H2SO4 =Na2SO4 +2H2O,由
SO2——H2SO4——2NaOH
1mol 2mol
x 0.025L×0.0900mol·L-1
可得
解得x=0.001125mol
该葡萄酒中SO2含量为
(5)若该测定结果比实际值偏高,原因是盐酸挥发,消耗更多的NaOH溶液。可以采取用难挥发的强酸如硫酸代替盐酸等措施。
参考答案:
(1)冷凝管或冷凝器 b
(2) SO2+H2O2=H2SO4
(3) ③ 酚酞 ④
(4)0.24
(5)原因:盐酸的挥发 改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响
10.(14分)结晶玫瑰是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分反应条件略去):
(1)A的类型是_____________,能与Cl2反应生成A的烷烃是_________。B中的官能团是____________。
(2)反应③的化学方程式为_____________________。
B 苯甲醇 +苯甲酸钾
KOH
(3)已知: ,则经反应路线①得到的产物加水萃取、分液,能除去的副产物是_________________。
(4)已知: ,则经反应路线②得
到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为______________。
(5)G的同分异构体L遇FeCl3溶液显色,与适量饱和溴水反应未见白色沉淀产生,则L与NaOH的乙醇溶液共热,所得有机物的结构简式为_________________。(只写一种)
【解题思路】(1)A(HCCl3)是三氯甲烷,属于卤代烃,是甲烷(CH4)与Cl2发生取代反应的产物;B中的官能团是醛基(—CHO)。
(2)根据G和J的结构简式,可知反应③是G与乙酸(CH3COOH)发生酯化反应生成J,其化学方程式为
—CH—OH
CCl3
+ CH3COOH
+ H2O
—CH—OOCCH3
CCl3
浓H2SO4
△
—CH—
CCl3
(3)由于B在KOH作用下生成苯甲醇和苯甲酸钾,其中,苯甲酸钾易溶于水,故加水萃取、分液,能除去的副产物是苯甲酸钾。
(4)根据提示信息,经反应路线②得到的副产物为 ,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为1:2:4:4。
(5)G的同分异构体L遇FeCl3溶液显色,说明L含有酚羟基;与适量饱和溴水反应未见白色沉淀产生,说明L的分子中酚羟基的邻对位上的H原子均已被其它原子或原子团取
OH
Cl—
—Cl
CH2—CH2Cl
代;L还能与NaOH的乙醇溶液共热发生消去反应,可推断L的结构简式为
OH
Cl—
Cl
—CHCl—CH3
OH
Cl—
Cl
—CH2—CH2Cl
OH
Cl—
—Cl
CHCl—CH3
、 或 ,故与NaOH
ONa
Cl—
Cl
—CH=CH2
Cl—
—Cl
CH=CH2
ONa
的乙醇溶液共热,所得有机物的结构简式为 或 。
参考答案:
—CH—OH
CCl3
+ CH3COOH
+ H2O
—CH—OOCCH3
CCl3
浓H2SO4
△
(1)卤代烃 甲烷或CH4 醛基或—CHO
(2)
(3)苯甲酸钾
(4)1:2:4:4
ONa
Cl—
Cl
—CH=CH2
Cl—
—Cl
CH=CH2
ONa
+ H2O
(5) 或
11.(14分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为___________________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为______________________,反应消耗1mol NaBH4时转移的电子数目为_________________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
。某温度下,向恒容密闭容器中加入环己
烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_______________。
(4)一定条件下,题11图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
①导线中电子移动方向为______________。(用A、D表示)
②生成目标产物的电极反应式为______________________________。
③该储氢装置的电流效率=______________________。
(,计算结果保留小数点后1位)
【解题思路】(1)氢气的燃烧产物是H2O。
(2) NaBH4与水反应的化学方程式为NaBH4+2H2O= NaBO2+4H2↑,反应消耗1mol NaBH4时有4mol电子转移,转移的电子数目为4NA或2.408×1024。
(3)由
c始/ mol·L-1 a 0 0
c变/ mol·L-1 b b 3b
c平/ mol·L-1 a-b b 3b
则该反应的平衡常数
(4)观察装置图,可知电极D发生还原反应,是电解池的阴极,A的电源的负极,故导线中电子移动方向为A→D。
②目标产物是环己烷,则生成环己烷的电极反应式是C6H6+6H++6e-=C6H12。
③阳极(E极)的电极反应式为4OH- -4e-=O2↑+2H2O,生成2.8mol O2,转移电子的11.2mol;阴极(D极)的电极反应式为C6H6+6H++6e-=C6H12、2H++2e-=H2↑,设参加反应的C6H6、生成H2的物质的量分别为x、y,根据图中信息及电子得失守恒,可得
6x+2y=11.2mol
参考答案:
(1)H2O
(2) NaBH4+2H2O= NaBO2+4H2↑ 4NA或2.408×1024
(3)
(4)①A→D
②C6H6+6H++6e-=C6H12
③64.3%