- 501.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
每日七选(一) 姓名: 时间14min 准确率
1.【2017新课标3卷】化学与生活密切相关。下列说法错误的是
A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.天然气和液化石油气是我国目前推广使用的清洁燃料
2.(2017•新课标Ⅱ-8)阿伏加德罗常数的值为NA.下列说法正确的是
A.1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NA
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
3.【2017江苏卷】下列指定反应的离子方程式正确的是
A.钠与水反应:Na +2H2ONa++2OH– + H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2OH2↑+Cl2↑+2OH–
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2+++OH–CaCO3↓+H2O
4.【2017新课标1卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
5.(2017•新课标Ⅱ-9)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是
A.原子半径:d>c>b>a B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱 D.d单质的氧化性比a单质的氧化性强
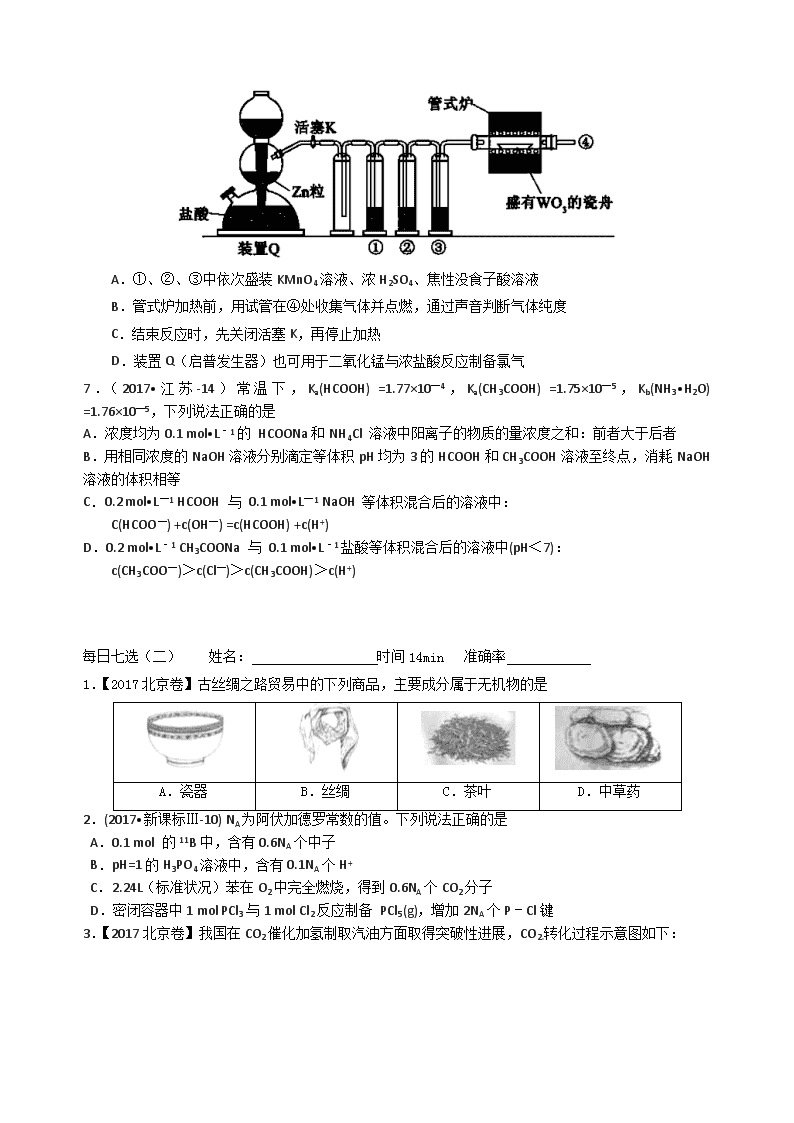
6.【2017新课标1卷】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
7.(2017•江苏-14)常温下,Ka(HCOOH) =1.77×10—4,Ka(CH3COOH) =1.75×10—5,Kb(NH3•H2O) =1.76×10—5,下列说法正确的是
A.浓度均为0.1 mol•L﹣1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol•L—1 HCOOH 与 0.1 mol•L—1 NaOH 等体积混合后的溶液中:
C(HCOO—) +c(OH—) =c(HCOOH) +c(H+)
D.0.2 mol•L﹣1 CH3COONa 与 0.1 mol•L﹣1盐酸等体积混合后的溶液中(pH<7):
c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+)
每日七选(二) 姓名: 时间14min 准确率
1.【2017北京卷】古丝绸之路贸易中的下列商品,主要成分属于无机物的是
A.瓷器
B.丝绸
C.茶叶
D.中草药
2.(2017•新课标Ⅲ-10) NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol 的11B中,含有0.6NA个中子
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P﹣Cl键
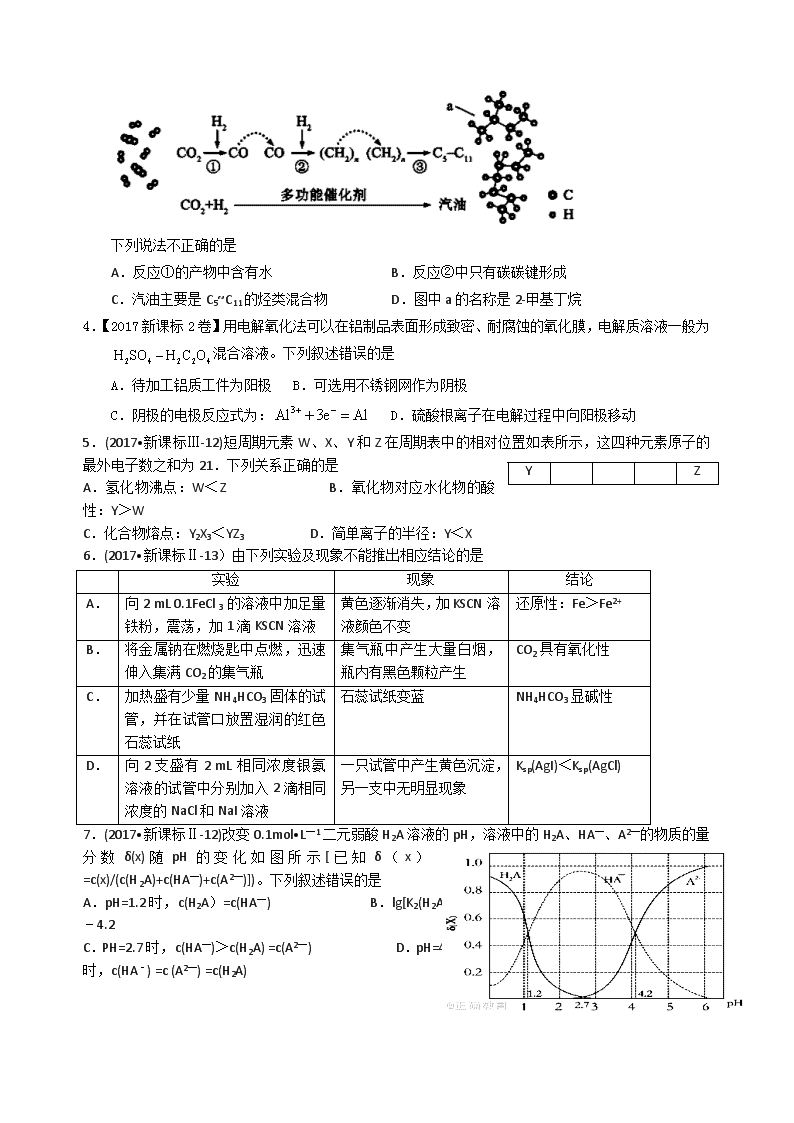
3.【2017北京卷】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
下列说法不正确的是
A.反应①的产物中含有水 B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物 D.图中a的名称是2-甲基丁烷
4.【2017新课标2卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为混合溶液。下列叙述错误的是
A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极
C.阴极的电极反应式为: D.硫酸根离子在电解过程中向阳极移动
Y
Z
5.(2017•新课标Ⅲ-12)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是
A.氢化物沸点:W<Z B.氧化物对应水化物的酸性:Y>W
C.化合物熔点:Y2X3<YZ3 D.简单离子的半径:Y<X
6.(2017•新课标Ⅱ-13)由下列实验及现象不能推出相应结论的是
实验
现象
结论
A.
向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D.
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
7.(2017•新课标Ⅱ-12)改变0.1mol•L—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/(c(H2A)+c(HA—)+c(A2—)])。下列叙述错误的是
A.pH=1.2时,c(H2A)=c(HA—) B.lg[K2(H2A)]=﹣4.2
C.PH=2.7时,c(HA—)>c(H2A) =c(A2—) D.pH=4.2时,c(HA﹣) =c (A2—) =c(H2A)
每日七选(三) 姓名: 时间14min 准确率
1.化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
次氯酸盐具有氧化性
漂白粉漂白织物
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
2.【2016新课标1卷】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.14 g乙烯和丙烯混合气体中的氢原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.1 mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
3.苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为。下列关于苯佐卡因的叙述正确的是
A.分子中含有3种官能团
B.1 mol该化合物最多与4 mol氢气发生加成反应
C.苯环上有2个取代基,且含有硝基的同分异构体有15种
D.分子式为C9H10NO2
4.(2016·四川)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1−xCoO2+LixC6LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6−xe−xLi++C6
C.充电时,若转移1 mol e−,石墨(C6)电极将增重7x g
D.充电时,阳极的电极反应式为LiCoO2−xe−Li1−xCoO2+xLi+
5.X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1 mol/L X和W形成化合物的水溶液pH=1。下列说法正确的是
A.Z与Y、Z与W形成的化合物的化学键完全相同
B.X与Y组成的简单氢化物的沸点高于X与R组成的简单氢化物的沸点,是因为非金属性Y>R
C.简单离子的半径:Z>R>W>Y
D.Y、Z、W三种元素组成的化合物的水溶液可能显碱性
6.利用如图装置进行实验,下列有关实验操作和现象正确的是
A.缓慢通入N2,再加热Ⅰ处的碳酸氢钠,可观察到Ⅱ处过氧化钠粉末由浅黄色变成白色
B.缓慢通入N2,加热Ⅰ处KClO3和MnO2的混合物,可观察到Ⅱ处干燥KI淀粉试纸变成蓝色
C.先对Ⅰ处的氯化铵加热,再缓慢通入N2,可看到Ⅰ处固体减少,Ⅱ处无固体沉积
D.先缓慢通入CO2,再加热Ⅰ处炭粉,可观察到Ⅱ处氧化铁粉末由红色变成黑色
7.(2017•新课标Ⅰ-13)常温下将溶液滴加到己二酸()溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A. 的数量级为
B. 曲线N表示pH与的变化关系
C. NaHX溶液中
D. 当混合溶液呈中性时,
每日七选(四) 姓名: 时间14min 准确率
1.新版人民币的发行,引发了人们对有关人民币中化学知识的关注。下列表述不正确的是
A.制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
B.用于人民币票面方案等处的油墨中所含有的Fe3O4是一种磁性物质
C.防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料
D.某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
2.设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,22.4 L H2O2中含有共价键的数目为3NA
B.4.6 g甲苯(C7H8)和丙三醇(C3H8O3)的混合物中含有的氢原子数为0.4NA
C.50 mL 18.4 mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92NA
D.已知SO2(g)+1/2O2(g)SO3(g) △H=−98.32 kJ·mol−1,则向容器中充入NA个SO2分子和0.5NA个O2分子在一定条件下充分反应,最终放出的热量为98.32kJ
3.下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、SO42−
②常温下pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③能溶解Al2O3的溶液中:Cl-、HCO3-、NO3-、NH4+
④由水电离出的c(OH-)=10−13 mol·L−1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、C1−、S2−、ClO-
⑥强酸性溶液中:SO32−、K+、MnO4−、Cl-
A.②④ B.②⑤ C.④⑥ D.②⑤⑥
4.已知H2O2是一种弱酸,在强碱溶液中主要以形式存在。现以Al−H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
A.燃料电池的总反应为:2Al+32+2H2O
B.电解时,Al消耗2.7 g,则产生氮气的体积为1.12 L
C.电极b是负极,且反应后该电极区pH增大
D.电解过程中,电子的流向:a→d,c→b
5.X、Y、Z、W、M五种短周期元素,X、Y同周期,X、Z同主族,Y形成化合物种类最多,X2-、W3+具有相同的电子层结构,M为短周期主族元素中原子半径最大的元素。下列说法正确的是
A.原子半径大小顺序为M>W>X>Z>Y
B.W元素形成的可溶性盐溶液一定显碱性
C.M、X只能形成离子化合物,且形成的离子化合物中只含离子键
D.W的氧化物与Z、M的最高价氧化物的水化物均能反应
6.下列实验,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
分别向2 mL 0.1 mol/L NaHCO3溶液和2 mL 0.1 mol/L Na2CO3 溶液中滴加2 mL 0.2 mol/L的盐酸
盛有NaHCO3溶液试管产生气泡速度快
结合H+能力>
B
将石蜡油(烷烃)蒸汽通过灼热的碎瓷片,并将产生的气体通人溴的四氯化碳溶液
溴的四氯化碳溶液褪色
生成气体中含有不饱和烃
C
向KI溶液中加入淀粉,然后滴入稀硫酸数滴
开始无明显现象,片刻溶液变蓝
氧化性:H2SO4 > I2
D
向某溶液中加入盐酸
产生刺激性气味的气体和黄色沉淀
溶液中一定存在
7.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO−)>c(OH−)>c(H+)
B.在B点:a>12.5,且有c(Na+)=c(CH3COO−)=c(OH−)=c(H+)
C.在C点:c(CH3COO−)>c(Na+)>c(H+)>c(OH−)
D.在D点:c(CH3COO−)+c(CH3COOH)=c(Na+)
每日七选(五) 姓名: 时间14min 准确率
1.化学与人类的生活,生产密切相关,下列说法中正确的是
A.蚕丝和棉花的组成元素相同,结构不同,因而性质不同
B.埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同
C.纯碱是属于碱类、谷氨酸钠(C5H8NO4Na,味精)属于盐类
D.压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的清洁燃料
2.设NA表示阿伏加德罗常数值。下列说法正确的是
A.常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5 mol O2时,转移电子数是2NA
B.标准状况下,11.2 L的甲醇所含的氢原子数等于2NA
C.电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
D.1 L 1 mol/L CuCl2溶液中含有的氯离子数为2NA
3.【2017新课标1卷】已知(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是
A.b的同分异构体只有d和p两种 B.b、d、p的二氯代物均只有三种
C.b、d、p均可与酸性高锰酸钾溶液反应 D.b、d、p中只有b的所有原子处于同一平面
4.【2017新课标3卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
5.a、b、c、d是原子序数依次增大的四种主族元素,a的原子半径最小,b形成的一种单质在天然物质中硬度最大,d在地壳中含量最高。则下列叙述正确的是
A.a、c、d形成的所有化合物只含共价键
B.a、b、c、d形成原子数目比为4∶1∶2∶1的化合物只有一种
C.a、c形成的化合物中可能含有非极性键
D.a分别与b、c、d形成的二元化合物中d的沸点最高
6.[2016·四川]根据下列实验操作和现象得出的结论正确的是
选项
实验操作
现象
结论
A
将某溶液与稀盐酸反应产生的气体通入澄清石灰水
石灰水变浑浊
该溶液中一定含有
B
常温下,将铁片浸入足量浓硫酸中
铁片不溶解
常温下,铁与浓硫酸一定没有发生化学反应
C
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐中一定没有添加KIO3
D
向苯酚钠溶液中滴加乙酸溶液
溶液变浑浊
相同条件下,乙酸的酸性一定比苯酚强
7.常温下,向20 mL 0.2 mol·L−1二元酸H2A溶液中滴加0.2 mol·L−l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是
A.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA−)>c(A2−)>c(OH−)>c(H+)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C.等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D.当V(NaOH) =40 mL时,升高温度,c(Na+)/c(A2−)减小
每日七选(六) 姓名: 时间14min 准确率
1.根据所给的信息和标志,判断下列说法错误的是( )
A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
碳酸氢钠药片
古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
2.(2014·四川理综)设NA为阿伏加德罗常数的值,下列说法正确的是:
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO32HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
3.【2017江苏卷】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
A.a和b都属于芳香族化合物
B.a和c分子中所有碳原子均处于同一平面上
C.a、b和c均能使酸性KMnO4溶液褪色
D.b和c均能与新制的Cu(OH)2反应生成红色沉淀
4.太阳能光电池由于具有可靠性好、寿命长等特点,适用于很多特殊环境和场合,现已得到广泛应用。氮化稼(GaN)光电池的结构如图所示。下列说法中正确的是
A.该装置系统中只存在两种能量转化
B.Cu电极上的电极反应为:CO2+8e−+8H+CH4+2H2O
C.离子交换膜为质子交换膜,H+从右池移向左池
D.常温下,当装置中有1 mol CH4生成时,GaN电极有44.8 L O2
5.短周期元素X、Y、Z、W的原子序数依次增大。X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性。则下列说法不正确的是
A.原子半径:W>Y>Z>X B.标准状况下的2.24 L M溶于水,所得溶液pH=13
C.YZ2能使湿润的淀粉KI试纸变蓝
D.一定条件下,Cu可与W的最高价氧化物对应水化物发生反应
6.[2015·全国卷Ⅱ]用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项
①中物质
②中物质
预测②中的现象
A
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
7.(2016·江苏)H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c()+ c()= 0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=2.5的溶液中:c(H2C2O4)+c()>c()
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c()
C.c()=c()的溶液中:c(Na+)>0.100 mol·L–1+c()
D.pH=7.0的溶液中:c(Na+)>2c()
每日七选(七) 姓名: 时间14min 准确率
1.化学与社会、科学、技术、环境(STSE)密切联系。下列说法正确的是
A.干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅
B.手机外壳上贴的碳纤维外膜是一种新型无机非金属材料
C.用淀粉溶液可以直接检验海水中是否含碘元素
D.明矾净水的原理和“84”消毒液消毒的原理相同
2.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.11 g T2O含有的电子数为5NA
B.常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液的氮原子数小于0.2NA
C.含4 mol HCl的浓盐酸与足量二氧化锰反应转移的电子总数为2NA
D.标准状况下,2.24 L H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA
3.下列说法中正确的是
A.丙烯所有原子均在同一平面上
B.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
C.乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应
D.分子式为C8H10的某芳香烃的一氯代物可能只有一种
4.锌溴液流电池用溴化锌溶液作电解液,并在电池间不断循环。下列有关说法正确的是
A.充电时Zn2+通过阳离子交换膜由左侧流向右侧
B.放电时每转移2 mol电子负极增重130 g
C.充电时阴极的电极反应式为Br2+2e−2Br−
D.若将电解液改为氯化锌溶液放电效果更好更安全
5.[2015·新课标全国卷Ⅰ] W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
A.单质的沸点:W>X B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Yc(HCO3-)
B.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:
2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
C.将100mL 0.1mol•L-1的醋酸稀释至pH=4:n(H+)+n(CH3COOH)=0.01mol
D.pH=5的NaHSO3溶液中:c(HSO3-)+c(SO32-)=c(Na+)