- 1.14 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014·山东卷(课标化学)
7. [2014·山东卷] 下表中对应关系正确的是(
A
CH3CH3+Cl2――→
光
CH3CH2Cl+HCl
CH2===CH2+HCl―→CH3CH2Cl
均为取代反应
B
由油脂得到甘油
由淀粉得到葡萄糖
均发生了水解反应
C
Cl2+2Br-===2Cl-+Br2
Zn+Cu2+===Zn2++Cu
均为单质被还原的置换反应
D
2Na2O2+2H2O===4NaOH+O2↑
Cl2+H2O===HCl+HClO
均为水作还原剂的氧化还原反应
【答案】B
【解析】CH2===CH2 与 HCl 的反应为加成反应,A 项错误;油脂水解生成甘油和高级脂肪酸,淀粉水
解的最终产物为葡萄糖,B 项正确;Zn+Cu2+===Zn2++Cu 的反应中被还原的是 Cu2+,C 项错误;Na2O2
与 H2O 的反应中氧化剂、还原剂均为 Na2O2,Cl2 与 H2O 的反应中氧化剂、还原剂均为 Cl2,D 项错误。
8. [2014·山东卷] 根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 3517Cl 与 3717Cl 得电子能力相同
【答案】D
【解析】同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱,A 项错误;如 Na+、Mg2+是核外
电子排布相同的微粒,二者性质不同,B 项错误;核外电子排布相同的简单离子,核电荷数越大离子半径
越小,S2-、Cl-、K+、Ca2+半径逐渐减小,C 项错误;3517Cl 与 3717Cl 互为同位素,二者化学性质(得电子能力、
化合价等)相同,D 项正确。
9. [2014·山东卷] 等质量的下列物质与足量稀硝酸反应,放出 NO 物质的量最多的是( )
A.FeO B.Fe2O3 C. FeSO4 D.Fe3O4
【答案】A
【解析】Fe2O3 与稀硝酸反应不能放出 NO,B 项错误;1 mol Fe3O4 中含有 1 mol Fe2+,利用得失电子
守恒可知生成 1 mol NO 需消耗 FeO、FeSO4、Fe3O4 的物质的量均为 3 mol,FeO、FeSO4、Fe3O4 的摩尔质
量(g/mol)分别为:72、152、232,所以等质量的 FeO、FeSO4、Fe3O4 与足量稀硝酸反应,放出 NO 物质的
量最多的是 FeO。
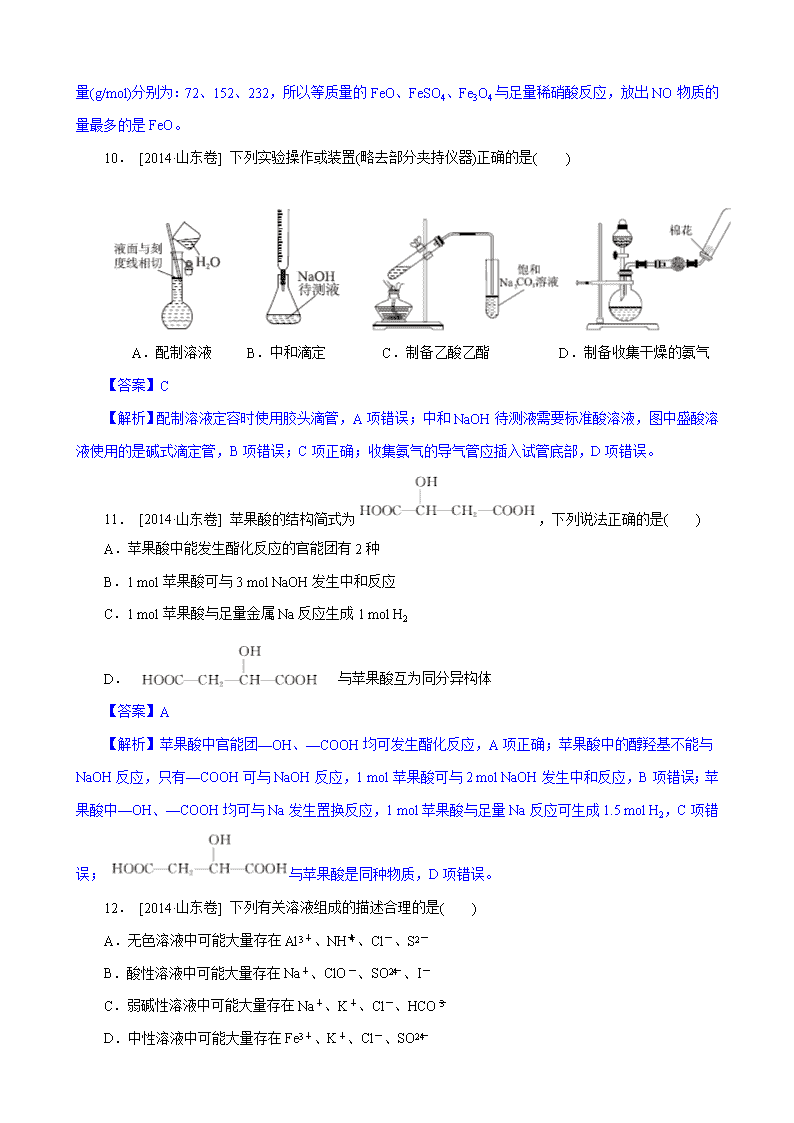
10. [2014·山东卷] 下列实验操作或装置(略去部分夹持仪器)正确的是( )
A.配制溶液 B.中和滴定 C.制备乙酸乙酯 D.制备收集干燥的氨气
【答案】C
【解析】配制溶液定容时使用胶头滴管,A 项错误;中和 NaOH 待测液需要标准酸溶液,图中盛酸溶
液使用的是碱式滴定管,B 项错误;C 项正确;收集氨气的导气管应插入试管底部,D 项错误。
11. [2014·山东卷] 苹果酸的结构简式为 ,下列说法正确的是( )
A.苹果酸中能发生酯化反应的官能团有 2 种
B.1 mol 苹果酸可与 3 mol NaOH 发生中和反应
C.1 mol 苹果酸与足量金属 Na 反应生成 1 mol H2
D. 与苹果酸互为同分异构体
【答案】A
【解析】苹果酸中官能团—OH、—COOH 均可发生酯化反应,A 项正确;苹果酸中的醇羟基不能与
NaOH 反应,只有—COOH 可与 NaOH 反应,1 mol 苹果酸可与 2 mol NaOH 发生中和反应,B 项错误;苹
果酸中—OH、—COOH 均可与 Na 发生置换反应,1 mol 苹果酸与足量 Na 反应可生成 1.5 mol H2,C 项错
误; 与苹果酸是同种物质,D 项错误。
12. [2014·山东卷] 下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在 Al3+、NH+
4 、Cl-、S2-
B.酸性溶液中可能大量存在 Na+、ClO-、SO2-
4 、I-
C.弱碱性溶液中可能大量存在 Na+、K+、Cl-、HCO-
3
D.中性溶液中可能大量存在 Fe3+、K+、Cl-、SO2-
4
【答案】C
【解析】Al3+、S2-发生水解互促反应不能大量共存,A 项错误;酸性溶液中不能大量存在 ClO-,B
项错误;HCO -
3 水解使溶液呈弱碱性,因此弱碱性溶液中可大量存在 Na+、K+、Cl-、HCO-
3 ,C 项正确;
中性溶液中不能大量存在 Fe3+,D 项错误。
13.H1 H3[2014·山东卷] 已知某温度下 CH3COOH 和 NH3·H2O 的电离常数相等,现向 10 mL 浓度
为 0.1 mol·L-1 的 CH3COOH 溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B. c(NH+
4 )
c(NH3·H2O)
先增大再减小
C.c(CH3COOH)与 c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为 10 mL 时,c(NH+
4 )=c(CH3COO-)
【答案】D
【解析】水的电离程度先增大,当反应完全后,随氨水的加入,水的电离程度减小,A 项错误;溶液
中 c(NH+
4 )
c(NH3·H2O)
=Kb(NH3·H2O)
c(OH-)
,滴定过程中 Kb(NH3·H2O)不变,溶液中 c(OH-)一直增大, c(NH+
4 )
c(NH3·H2O)
一直减小,B 项错误;利用原子守恒知溶液中 n(CH3COOH)与 n(CH3COO-)之和不变,滴定过程中溶液体
积不断增大,c(CH3COOH)与 c(CH3COO-)之和不断减小,C 项错误;由 CH3COOH 与 NH3·H2O 的电离程
度相等可知 CH3COONH4 溶液呈中性,当加入等体积氨水时,溶液恰好为 CH3COONH4 溶液,利用电荷守
恒知溶液中 c(NH+
4 )=c(CH3COO-),D 项正确。
29. [2014·山东卷] 研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数 K=________(用 K1、K2 表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向 2 L 恒容密闭容器中加入 0.2 mol NO 和 0.1 mol
Cl2,10 min 时反应(Ⅱ)达到平衡。测得 10 min 内 v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后 n(Cl2)=
________mol,NO 的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时 NO
的转化率α2________α1(填“>”“<”或“=”),平衡常数 K2______(填“增大”“减小”或“不变”)。若要使 K2 减小,
可采取的措施是________。
(3)实验室可用 NaOH 溶液吸收 NO2,反应为 2NO2+2NaOH===NaNO3+NaNO2+H2O。含 0.2 mol NaOH
的水溶液与 0.2 mol NO2 恰好完全反应得 1 L 溶液 A,溶液 B 为 0.1 mol·L-1 的 CH3COONa 溶液,则两溶液
中 c(NO-
3 )、c(NO-
2 )和 c(CH3COO-)由大到小的顺序为____________________________________________。
(已知 HNO2 电离常数 Ka=7.1×10-4 mol·L-1,CH3COOH 的电离常数 Ka=1.7×10-5 mol·L-1)
可使溶液 A 和溶液 B 的 pH 相等的方法是________。
a.向溶液 A 中加适量水
b.向溶液 A 中加适量 NaOH
c.向溶液 B 中加适量水
d.向溶液 B 中加适量 NaOH
【答案】(1)K21
K2
(2)2.5×10-2 75% > 不变 升高温度 (3)c(NO-
3 )>c(NO-
2 )>c(CH3COO-) b、c
【解析】(1)反应(Ⅰ)×2-反应(Ⅱ)即得到反应:4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),
利用平衡常数定义可知该反应平衡常数 K=K21
K2
。(2)平衡时容器中 n(ClNO)=7.5×10-3mol·L-1·min-1×10
min×2 L=0.15 mol,则平衡后 n(Cl2)=0.1 mol-1
2×0.15 mol=0.025 mol;NO 的转化率=0.15 mol
0.2 mol ×100%=
75%;若恒压下达到平衡态相当于将原平衡加压,平衡正向移动,NO 的转化率增大;平衡常数只与温度
有关,恒压下达到平衡的平衡常数与原平衡常数相等;因该反应为放热反应,升高温度,反应逆向进行,
反应平衡常数减小 。(3)反应后得到溶液 A 为物质的量浓度均为 0.1 mol/L 的 NaNO2 与 NaNO3 的混合溶液,
利用已知电离常数可知 CH3COO-水解程度大于 NO-
2 ,NO -
3 不发生水解,两溶液中 c(NO-
3 )>c(NO-
2 )>
c(CH3COO-);利用 CH3COO-水解程度大于 NO -
2 可知溶液 B 的碱性强于溶液 A,为使溶液 A、B 的 pH 相
等,可采取的措施有向溶液 A 中加适量 NaOH 或向 B 溶液中加入适量水稀释或向 B 溶液中加入适量稀醋
酸等。
30. [2014·山东卷] 离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl -
7 和 AlCl -
4 组成
的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极
电极反应式为__________________________________________。若改用 AlCl3 水溶液作电解液,则阴极产
物为________。
(2)为测定镀层厚度,用 NaOH 溶液溶解钢制品表面的铝镀层,当反应转移 6 mol 电子时,所得还原产
物的物质的量为________mol。
(3)用铝粉和 Fe2O3 做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀 H2SO4,滴加 KSCN 溶液无明显现象,
______________(填“能”或“ 不能”)说明固体混合物中无 Fe2O3,理由是________(用离子方程式说明)。
【答案】(1)负 4Al2Cl-
7 +3e-===Al+7AlCl-
4 H2 (2)3
(3)b、d 不能 Fe2O3+6H+===2Fe3++3H2O、Fe+2Fe3+===3Fe2+(或只写 Fe+2Fe3+===3Fe2+)
【解析】(1)电镀时,镀件应连接电源负极,作阴极;在阴极上发生还原反应,结合题中“电镀过程中
不产生其他离子且有机阳离子不参与电极反应”可知阴极上的反应式是 4Al2Cl-
7 +3e-===Al+7AlCl-
4 ;若改
用 AlCl3 水溶液作电解液,则阴极反应是水电离出的 H+得电子还原为 H2。(2)用 NaOH 溶解铝镀层时发生
反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,H2 是还原产物,当转移 6 mol 电子时,该反应可得到 3 mol
还原产物。(3)引发铝粉和 Fe2O3 粉末反应的助燃剂为 KClO3,然后插入镁条,点燃镁条即可使铝热反应发
生;混合物中即使含有 Fe2O3,Fe2O3 溶于酸后生成的 Fe3+与反应生成的 Fe 发生氧化还原反应生成 Fe2+,
再加入 KSCN 溶液后溶液也不显红色,因此不能证明反应后固体不含 Fe2O3。
31. (20 分)[2014·山东卷] 工业上常利用含硫废水生产 Na2S2O3·5H2O,实验室可用如下装置(略去部
分夹持仪器)模拟生产过程。
烧瓶 C 中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)=====
△
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液柱,若
________________,则整个装置气密性良好。装置 D 的作用是__________。装置 E 中为________溶液。
(2)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3 恰好完全反应,则烧瓶 C 中 Na2S 和 Na2SO3 物质
的量之比为________。
(3)装置 B 的作用之一是观察 SO2 的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和 Na2SO3 溶液
c.饱和 NaHSO3 溶液 d.饱和 NaHCO3 溶液
实验中,为使 SO2 缓慢进入烧瓶 C,采用的操作是__________________________。已知反应(Ⅲ)相对
较慢,则烧瓶 C 中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶 A,实
验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩、冷却结晶即可析出 Na2S2O3·5H2O,其中可能含有 Na2SO3、
Na2SO4 等杂质。利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说明实验操作、现象和结论:
________________________________________。
已知 Na2S2O3·5H2O 遇酸易分解:S2O2-
3 +2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2 溶液、AgNO3 溶液。
【答案】(1)液柱高度保持不变 防止倒吸 NaOH(合理答案均可)(2)2∶1
(3)c 控制滴加硫酸的速度(合理即可得分) 溶液变澄清(或浑浊消失) a、d
(4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤、取滤液),滴加 BaCl2 溶液,若出现沉淀
则说明含有 Na2SO4 杂质(合理答案均可)
【解析】(1)若装置气密性良好,则装置 B 中的长颈漏斗加入水,B 瓶内压强变大,在长颈漏斗的颈中
会形成一段液柱,且液柱高度保持不变;根据装置图可知装置 D 是安全瓶,可防止 E 中液体倒吸进入 C
中;装置 E 是用来吸收未反应完全的 H2S 或 SO2 的尾气处理装置,因此 E 中试剂需用碱溶液,如 NaOH
溶液。(2) 反应(Ⅰ)×2+反应(Ⅱ)+ 反应(Ⅲ)×3 可得该转化过程的总反应:2Na2S+Na2SO3+
3SO2===3Na2S2O3,则 C 瓶中 Na2S 和 Na2SO3 的物质的量之比最好为 2∶1。(3)为减少 SO2 的损失,装置 B
中液体最好是饱和亚硫酸氢钠溶液;可通过控制滴加浓硫酸的速率来减慢 SO2 的产生速率从而达到减慢
SO2 的进入烧瓶 C 的实验要求;烧瓶 C 中反应达到终点,溶液中的硫全部转化为 Na2S2O3,溶液由浑浊变
澄清;烧杯、锥形瓶加热时需垫石棉网,蒸发皿、试管可直接用酒精灯加热。(4)为检验产品中是否含有
Na2SO4,可取少量产品溶于足量盐酸,以排除溶液中 SO2-
3 (包含 S2O 2-
3 与盐酸反应生成的 SO2-
3 ),然后取上
层清液,滴加 BaCl2 溶液,看是否有白色沉淀,得出上层清液中是否含有 SO 2-
4 的结论,进而做出产品中有
无 Na2SO4 杂质的判断。
32. [2014·山东卷] [化学—化学与技术]工业上用重铬酸钠(Na2Cr2O7)给晶后的母液(含少量杂质 Fe3+
生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图所示:
(1)由 Na2Cr2O7 生产 K2Cr2O7 的化学方程式为_____________________________________。通过冷却结
晶析出大量 K2Cr2O2 的原因是___________________________________________。
(2)向 Na2Cr2O7 母液中加碱液调 pH 的目的是____________________________________。
(3)固体 A 主要为________(填化学式)。固体 B 主要为________(填化学式)。
(4)用热水洗涤固体 A,回收的洗涤液转移到母液______(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使
能耗最低。
【答案】(1)Na2Cr2O7+2KCl===K2Cr2O7+2NaCl 低温下 K2Cr2O7 溶解度远小于其他组分,随温度的
降低,K2Cr2O7 溶解度明显减小(合理即可)
(2)除去 Fe3+ (3)NaCl K2Cr2O7 (4)Ⅱ
【解析】(1)利用流程图知向母液Ⅰ(溶质为 Na2Cr2O7)中加入 KCl(s)固体后得到 K2Cr2O7,由此可知由
Na2Cr2O7 生成 K2Cr2O7 的反应的方程式为 Na2Cr2O7+2KCl===K2Cr2O7+2NaCl;再结合溶解度曲线图可知
该反应发生的原因是 K2Cr2O7 的溶解度受温度影响变化大,并且低温时溶解度远比其他组分小,将反应后
的热溶液降温可使 K2Cr2O7 结晶析出。(2)pH=4 时,Fe3+可完全转化为 Fe(OH)3 沉淀,通过过滤可进行固
液分离,因此向 Na2Cr2O7 母液中加碱调节 pH=4 的目的是除去 Fe3+。(3)利用(1)中反应方程式和溶解度曲
线知,母液Ⅱ中主要含有 NaCl 和少量 K2Cr2O7,再结合 K2Cr2O7 在高温时溶解度大可知将母液Ⅱ蒸发浓缩
得到固体 A 应是析出 NaCl 固体,母液Ⅲ为高温下不饱和的 K2Cr2O7 溶液,再冷却结晶得到固体 B 应是
K2Cr2O7。(4)洗涤固体 A(NaCl)的洗涤液中含有 K2Cr2O7,因此将回收液转移到母液Ⅱ中可提高 K2Cr2O7 的
产率,同时降低能耗。
33. [2014·山东卷] [化学—物质结构与性质]石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构
新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1 号 C 与相邻 C 形成σ键的个数为________。
(2)图(b)中,1 号 C 的杂化方式是________,该 C 与相邻 C 形成的键角________(填“>”“<”或“=”)图(a)
中 1 号 C 与相邻 C 形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在 H2O 中,则氧化石墨烯中可与 H2O 形成氢键的原子有
________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属 M 与 C60 可制备一种低温超导材料,晶胞如图所示,M 原子位
于晶胞的棱上与内部。该晶胞中 M 原子的个数为________,该材料的化学式为________。
【答案】(1)3 (2)sp3 < (3)O、H (4)12 M3C60
【解析】(1)由图(a)可知,1 号 C 与另外 3 个碳原子形成 3 个σ键。(2)图(b)中 1 号 C 与 3 个碳原子、1
个氧原子共形成 4 个σ键,其价层电子对数为 4,C 的杂化方式为 sp3;该 C 与相邻 C 的键角约为 109°28′,
图(a)中 1 号 C 采取 sp2 杂化,碳原子间夹角为 120°。(3)氧化石墨烯中“—OH”的 O 可与 H2O 中的 H 形成氢
键、氧化石墨烯中“—OH”的 H 可与 H2O 中的 O 形成氢键,氧化石墨烯中可与 H2O 形成氢键的原子有 O、
H。(4)利用“均摊法”可知该晶胞棱上 12 个 M 完全属于该晶胞的 M 为 12×1
4
=3,位于晶胞内的 9 个 M 完全
属于该晶胞,故该晶胞中 M 原子的个数为 12;该晶胞中含有 C60 的个数为 8×1
8
+6×1
2
=4,因此该晶胞的化
学式为 M3C60。
34. [2014·山东卷] [化学—有机化学基础]3对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,
其合成路线如下:
已知:HCHO+CH3CHO――→OH-,ΔCH2===CHCHO+H2O
(1)遇 FeCl3 溶液显紫色且苯环上有两个取代基的 A 的同分异构体有____________种,B 中含氧官能团
的名称为________。
(2)试剂 C 可选用下列中的________。
a.溴水 b.银氨溶液
c.酸性 KMnO4 溶液 d.新制 Cu(OH)2 悬浊液
(3) 是 E 的一种同分异构体,该物质与足量 NaOH 溶液共热的
化学方程式为____________________。
(4)E 在一定条件下可以生成高聚物 F,F 的结构简式为_____________________________。
【答案】(1)3 醛基 (2)b、d
(3) +2NaOH――→
△ +CH3CH===CHCOONa+H2O(配平不
作要求)
(4)
【解析】(1)遇 FeCl3 溶液显紫色,说明苯环上直接连有—OH,结合 A 的结构简式可知满足条件的同
分异构体的另一取代基为—CH===CH2,—OH 与—CH===CH2 两个取代基在苯环上的连接方式有邻、间、
对 3 种;利用题中已知,结合合成路线可知 B 的结构简式为 ,B 中含氧官能团(—CHO)
的名称是醛基。
(2)B+C→D 的反应为醛基发生氧化反应,溴水与 B 中的碳碳双键可发生加成反应,酸性 KMnO4 溶液
可将苯环上连接的—CH3 氧化为—COOH,为防止将—CH3 氧化,因此实现 B 转化为 D 的反应只能选用具
有弱氧化性的氧化剂银氨溶液、新制 Cu(OH)2 悬浊液。
(3)该物质的酯基是酚羟基与羧基发生酯化反应形成的,因此 1 mol 该物质可与 2 mol NaOH 反应,由
此可得反应的方程式。
(4)D 与甲醇发生酯化反应得到 E(结构简式为 ,F 为 E 发生加聚反应的高聚物,
故可得 F 的结构简式为 。