- 519.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2015年普通高等学校招生全国统一考试(四川卷)
化学
1.下列物质在生活中应用时,起还原作用的是
A.明矾作净水剂
B.甘油作护肤保湿剂
C.漂粉精作消毒剂
D.铁粉作食品袋内的脱氧剂
【答案】D
【解析】
试题分析:A、明矾净水是因为Al3+水解成Al(OH)3胶体吸附;B、甘油具有强的吸湿性,可以让皮肤上的水分不会太快散发,同时适当从空气中吸收水蒸气,故用作保湿剂;C、漂粉精具有强氧化性,故可作消毒剂;D、铁粉可以消耗食品袋中的氧气,铁粉自身被氧化,起还原作用。选D。
考点:氧化还原反应
2.下列有关CuSO4溶液的叙述正确的是
A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存
B.通入CO2气体产生蓝色沉淀
C.与H2S反应的离子方程式:Cu2++ S2-=CuS↓
D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
【答案】A
考点:离子反应
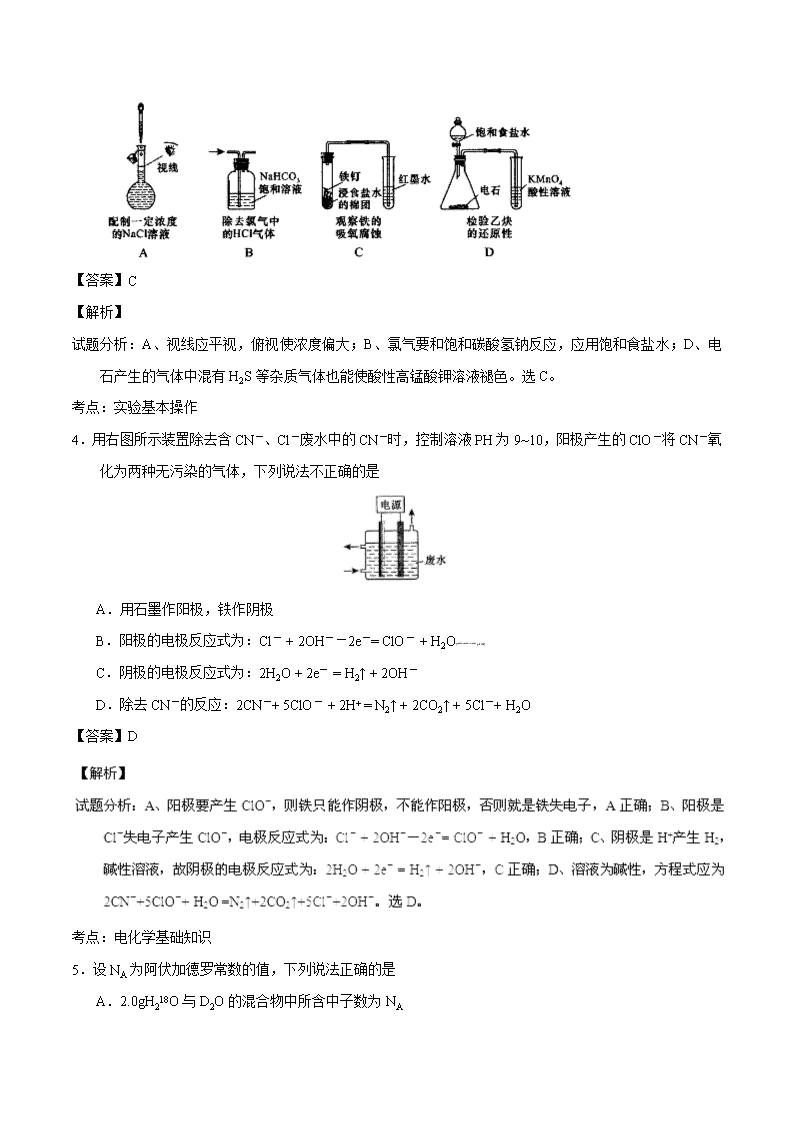
3.下列操作或装置能达到实验目的的是
【答案】C
【解析】
试题分析:A、视线应平视,俯视使浓度偏大;B、氯气要和饱和碳酸氢钠反应,应用饱和食盐水;D、电石产生的气体中混有H2S等杂质气体也能使酸性高锰酸钾溶液褪色。选C。
考点:实验基本操作
4.用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O[来源:学优高考网gkstk]
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
【答案】D
考点:电化学基础知识
5.设NA为阿伏加德罗常数的值,下列说法正确的是
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含σ键数目为0.7NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
【答案】A
【解析】
试题分析: A、H218O与D2O的相对分子质量均为20,且所含有中子数均为10个,A正确;B、4.4g乙醛为0.1mol,每个乙醛分子6个σ键,应为0.6NA,B错误;C应为0.25 NA,C错误;D浓盐酸反应变稀且具有挥发性,实际反应的盐酸小于0.6mol,故转移的电子数小于0.3NA,D错误。选A。
考点:阿伏伽德罗常数
6.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
【答案】C
考点:电解质溶液
7.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
【答案】B
考点:化学反应速率与化学平衡 化学平衡常数[来源:gkstk.Com]
8.(13分)X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是_____________________。
(2)利用价层电子对互斥理论判断TU3的立体构型是______。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是______(填化学式);Z和U的氢化物中沸点较高的是_____(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是_______(填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是_______________________。
【答案】
(1)1s22s22p63s23p2或者[Ne] 3s23p2
(2)三角锥形
(3)HNO3;HF;Si>Mg>Cl2
(4)P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4
考点:元素推断 物质结构、分子结构、晶体结构
9.(13分)(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液 b.用0.2000mol/L NaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A
至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在400℃分解的化学方程式是______________________.
【答案】
(1)圆底烧瓶
(2)dbaec
(3)0.03 mol
(4)取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体
(5)NH3
(6)3(NH4)2SO44NH3↑+ N2↑+3SO2↑ + 6H2O↑
(4)取装置D内溶液少许于试管中,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀且加入盐酸后白色沉淀能完全溶液,则说明原溶液中有SO32-,无SO42-
(5)NH3
(6)3(NH4)2SO44NH3↑+ N2↑+3SO2↑ + 6H2O
考点:实验设计与评价
10.(16分)化合物F(异戊巴比妥)是临床常用的镇静催眠药物,其合成路线如下(部分反应条件和试剂略);
请回答下列问题:
(1)试剂I的化学名称是 ① ,化合物B的官能团名称是 ② ,第④步的化学反应类型是 ③ 。[来源:学优高考网gkstk]
(2)第①步反应的化学方程式是 。
(3)第⑤步反应的化学方程式是 。
(4)试剂Ⅱ的相对分子质量为60,其结构简式是 。
(5)化合物B的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H。H在一定条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是 。
【答案】
(1)乙醇,醛基,酯化反应(取代反应)。
(2)
(3)
+ C2H5OH + NaBr
(4)
(5)
【解析】学优高考网
试题分析: 由题意可知①为卤代烃水解为醇A:CH3CH2CH(CH2OH)2,②为醇催化氧化为醛B:
CH3CH2CH(CHO)2,③为醛催化氧化为羧酸C:CH3CH2CH(COOH)2,④为羧酸与乙醇发生酯化反应生成
D:CH3CH2CH(COOC2H5)2,⑤为利用信息1,发生取代反应得E:,⑥为利用信息2,发生取代反应得F,可推知试剂Ⅱ为CO(NH2)2。
考点:有机推断与有机合成[来源:学优高考网]
11.(16分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。[来源:学优高考网]
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) =-1648kJ/mol
C(s)+O2(g)=CO2(g) =-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
【答案】
(1)Fe2O3+6H+=2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。
(4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) =-260kJ/mol。
(5)FeS2+4e-= Fe +2S2-
(6)-kg。
【解析】学优高考网
试题分析:
(1)Fe2O3+6H+=2Fe3++3H2O
(2)若Fe3+没有完全还原,则可以用KSCN检验。
(3)部分Fe2+被氧化为Fe3+。
(4)根据盖斯定律可得:4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) =-260kJ/mol。
(5)正极得电子,化合价降低,可得正极方程式:FeS2+4e- = Fe +2S2-
(6)由于最终得到FeSO4,根据元素守恒,n(Fe)=n(S),Fe来自于Fe2O3、FeS2、FeCO3;S来自于FeS2、H2SO4则有:
( ×2 + ×2×)×96% + = + ×2××2 ×96%
则得答案:-kg。
考点:化学工艺流程 化学反应与能量 元素及化合物 化学计算