- 227.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
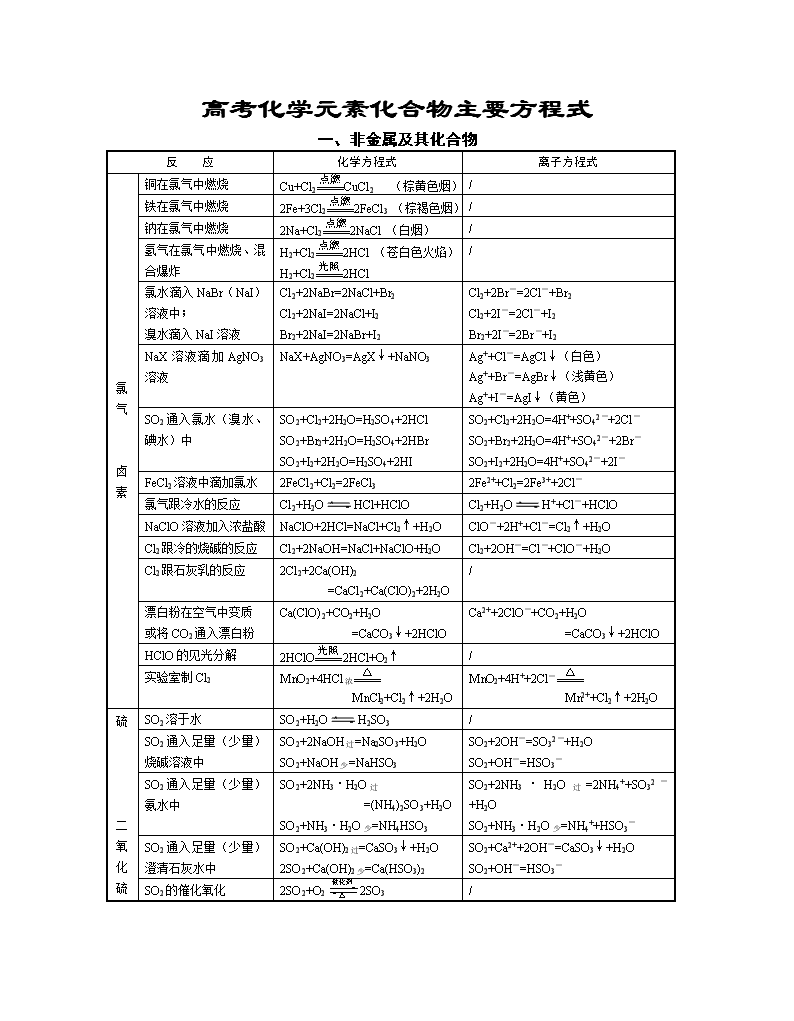
高考化学元素化合物主要方程式
一、非金属及其化合物
反 应
化学方程式
离子方程式
氯
气
卤
素
铜在氯气中燃烧
Cu+Cl2CuCl2 (棕黄色烟)
/
铁在氯气中燃烧
2Fe+3Cl22FeCl3 (棕褐色烟)
/
钠在氯气中燃烧
2Na+Cl22NaCl (白烟)
/
氢气在氯气中燃烧、混合爆炸
H2+Cl22HCl (苍白色火焰)
H2+Cl22HCl
/
氯水滴入NaBr(NaI)溶液中;
溴水滴入NaI溶液
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaI=2NaCl+I2
Br2+2NaI=2NaBr+I2
Cl2+2Br-=2Cl-+Br2
Cl2+2I-=2Cl-+I2
Br2+2I-=2Br-+I2
NaX溶液滴加AgNO3溶液
NaX+AgNO3=AgX↓+NaNO3
Ag++Cl-=AgCl↓(白色)
Ag++Br-=AgBr↓(浅黄色)
Ag++I-=AgI↓(黄色)
SO2通入氯水(溴水、碘水)中
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Br2+2H2O=H2SO4+2HBr
SO2+I2+2H2O=H2SO4+2HI
SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Br2+2H2O=4H++SO42-+2Br-
SO2+I2+2H2O=4H++SO42-+2I-
FeCl2溶液中滴加氯水
2FeCl2+Cl2=2FeCl3
2Fe2++Cl2=2Fe3++2Cl-
氯气跟冷水的反应
Cl2+H2OHCl+HClO
Cl2+H2OH++Cl-+HClO
NaClO溶液加入浓盐酸
NaClO+2HCl=NaCl+Cl2↑+H2O
ClO-+2H++Cl-=Cl2↑+H2O
Cl2跟冷的烧碱的反应
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2OH-=Cl-+ClO-+H2O
Cl2跟石灰乳的反应
2Cl2+2Ca(OH)2
=CaCl2+Ca(ClO)2+2H2O
/
漂白粉在空气中变质
或将CO2通入漂白粉
Ca(ClO)2+CO2+H2O
=CaCO3↓+2HClO
Ca2++2ClO-+CO2+H2O
=CaCO3↓+2HClO
HClO的见光分解
2HClO2HCl+O2↑
/
实验室制Cl2
MnO2+4HCl浓
MnCl2+Cl2↑+2H2O
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
硫
二
氧
化
硫
SO2溶于水
SO2+H2OH2SO3
/
硫
酸
SO2通入足量(少量)烧碱溶液中
SO2+2NaOH过=Na2SO3+H2O
SO2+NaOH少=NaHSO3
SO2+2OH-=SO32-+H2O
SO2+OH-=HSO3-
SO2通入足量(少量)氨水中
SO2+2NH3·H2O过
=(NH4)2SO3+H2O
SO2+NH3·H2O少=NH4HSO3
SO2+2NH3·H2O过=2NH4++SO32-+H2O
SO2+NH3·H2O少=NH4++HSO3-
SO2通入足量(少量)澄清石灰水中
SO2+Ca(OH)2过=CaSO3↓+H2O
2SO2+Ca(OH)2少=Ca(HSO3)2
SO2+Ca2++2OH-=CaSO3↓+H2O
SO2+OH-=HSO3-
SO2的催化氧化
2SO2+O22SO3
/
SO2通入溴水(氯水、碘水)
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Br2+2H2O=H2SO4+2HBr
SO2+I2+2H2O=H2SO4+2HI
SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Br2+2H2O=4H++SO42-+2Br-
SO2+I2+2H2O=4H++SO42-+2I-
SO2通入氢硫酸(H2S)
SO2+2H2S=3S↓+2H2O
/
SO3溶于水
SO3+H2O=H2SO4
/
SO3跟CaO反应
SO3+CaO=CaSO4
/
SO3跟Ca(OH)2反应
SO3+Ca(OH)2=CaSO4+H2O
/
铜跟H2SO4共热
Cu+2H2SO4浓
CuSO4+SO2↑+2H2O
/
碳跟H2SO4共热
C+2H2SO4浓
CO2↑+2SO2↑+2H2O
/
氮
气
氮
氧
化
物
氨
硝
酸
N2与H2合成氨
N2+3H22NH3
/
N2与O2高温或放电
N2+O22NO
/
NO与O2反应
2NO+O2=2NO2
/
NO2溶于水
3NO2+H2O=2HNO3+NO
3NO2+H2O=2H++NO3-+NO
NH3溶于水
NH3+H2O=NH3·H2O
/
氨水受热分解
NH3·H2ONH3↑+H2O
/
NH3的催化氧化
4NH3+5O24NO+6H2O
/
NH3与HCl形成白烟
NH3+HCl=NH4Cl
/
NH4Cl的受热分解
NH4ClNH3↑+HCl↑
/
NH4HCO3的受热分解
NH4HCO3
NH3↑+CO2↑+H2O
/
实验室制取NH3
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
/
铜溶于浓HNO3
Cu+4HNO3浓
=Cu(NO3)2+2NO2↑+2H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
铜溶于稀HNO3
3Cu+8HNO3稀
=3Cu(NO3)2+2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
浓HNO3跟炽热的碳反应
C+4HNO3浓
CO2↑+4NO2↑+2H2O
/
Fe2+被稀HNO3氧化
/
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
硅
二
氧化硅
Si粉末在O2中加热
Si+O2SiO2
/
硅酸
硅
酸
钠
SiO2跟NaOH溶液共热
SiO2+2NaOHNa2SiO3+H2O
SiO2+2OH-SiO32-+H2O
SiO2跟CaO高温
SiO2+CaOCaSiO3
/
SiO2跟CaCO3高温
SiO2+CaCO3CaSiO3+CO2↑
/
SiO2跟Na2CO3高温
SiO2+Na2CO3Na2SiO3+CO2↑
/
用焦炭还原二氧化硅
2C+SiO2Si+2CO↑
/
用氢氟酸雕刻玻璃
SiO2+4HF=SiF4↑+2H2O
/
水玻璃溶液在空气中变质
Na2SiO3+CO2+H2O
=Na2CO3+H2SiO3↓
SiO32-+CO2+H2O=CO32-+H2SiO3↓
水玻璃溶液滴加盐酸
Na2SiO3+2HCl=2NaCl+H2SiO3↓
SiO32-+2H+=H2SiO3↓
原硅酸脱部分水生成硅酸
H4SiO4H2SiO3+H2O
/
硅酸受热分解
H2SiO3SiO2+H2O
/
二、金属及其化合物
反 应
化学方程式
离子方程式
钠
碱
金
属
钠跟水的反应
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2Na++2OH-+H2↑
在空气中切开钠
4Na+O2=2Na2O
/
钠在空气中燃烧
2Na+O2Na2O2
/
钠在氯气中燃烧
2Na+Cl22NaCl
/
氧化钠溶于水
Na2O+H2O=2NaOH
Na2O+H2O=2Na++2OH-
氧化钠与盐酸反应
Na2O+2HCl=2NaCl+H2O
/
氧化钠与CO2反应
Na2O+CO2=Na2CO3
/
过氧化钠溶于水
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
过氧化钠跟CO2反应
2Na2O2+2CO2=2Na2CO3+O2↑
/
碳酸钠溶液滴加过量盐酸
Na2CO3+2HCl
=2NaCl+H2O+CO2↑
CO32-+2H+=H2O+CO2↑
小苏打溶液中滴加稀盐酸
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H+=H2O+CO2↑
碳酸氢钠受热分解
2NaHCO3
Na2CO3+CO2↑+H2O
/
小苏打溶液跟烧碱反应
NaHCO3+NaOH=Na2CO3+H2O
HCO3-+OH-=CO32-+H2O
少量小苏打溶液跟澄清石灰水反应
NaHCO3+Ca(OH)2
=CaCO3↓+NaOH+H2O
HCO3-+Ca+OH-=CaCO3↓+H2O
过量小苏打溶液跟澄清石灰水反应
2NaHCO3+Ca(OH)2
=CaCO3↓+Na2CO3+2H2O
2HCO3-+Ca+2OH-
=CaCO3↓+CO32-+2H2O
铝跟氢氧化钠溶液的反应
2Al+2NaOH+2H2O =2NaAlO2+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
铝
铝在氧气中加热或燃烧
4Al+3O22Al2O3
/
铝的重要化合物
铝在氯气中燃烧
2Al+3Cl22AlCl3
/
氧化铝溶于稀盐酸
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+6H+=2Al3++3H2O
氧化铝溶于氢氧化钠溶液
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2OH-=2AlO2-+H2O
氯化铝溶液中滴加少量氢氧化钠溶液
AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al3++3OH-=Al(OH)3↓
氯化铝溶液中滴加过量氢氧化钠溶液
AlCl3+4NaOH
=NaAlO2+2H2O+3NaCl
Al3++4OH-=AlO2-+2H2O
氯化铝溶液中滴加少量(过量)氨水
AlCl3+3NH3·H2O
=Al(OH)3↓+3NH4Cl
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
氢氧化铝溶于盐酸
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
氢氧化铝溶于氢氧化钠溶液
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+OH-=AlO2-+2H2O
偏铝酸钠溶液通入少量(过量)CO2
2NaAlO2+CO2少+3H2O
=2Al(OH)3↓+Na2CO3
NaAlO2+CO2过+2H2O
=Al(OH)3↓+NaHCO3
2AlO2-+CO2少+3H2O
=2Al(OH)3↓+CO32-
AlO2-+CO2过+2H2O=Al(OH)3↓+HCO3-
偏铝酸钠溶液滴加少量(过量)盐酸
NaAlO2+HCl少+H2O
=Al(OH)3↓+NaCl
NaAlO2+4HCl过
=AlCl3+NaCl+2H2O
AlO2-+H++H2O=Al(OH)3↓
AlO2-+4H+=Al3++ 2H2O
偏铝酸钠溶液滴加氯化铝溶液
3NaAlO2+AlCl3+6H2O
=4Al(OH)3↓+3NaCl
3AlO2-+Al3++6H2O=4Al(OH)3↓
铝热反应
2Al+Fe2O3Al2O3+2Fe
/
镁
镁跟沸水的反应
Mg+2H2OMg(OH)2+H2↑
/
镁在CO2中燃烧
2Mg+CO22MgO+C
/
镁跟氮气反应
3Mg+N2Mg3N2
/
氮化镁溶于水
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
/
铁
铁的重要化合物
铁跟水蒸气的反应
3Fe+4H2O(g)Fe3O4 +4H2↑
/
铁在氧气中燃烧
3Fe+2O2 (g) Fe3O4
/
氧化铁溶于稀盐酸
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+6H+=2Fe3++3H2O
四氧化三铁溶于稀盐酸
Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
Fe3O4+8H+=2Fe3++Fe2++4H2O
硫酸亚铁溶液中滴加氢氧化钠溶液
FeSO4+2NaOH
=Fe(OH)2↓+Na2SO4
Fe2++2OH-=Fe(OH)2↓
氯化亚铁溶液中滴加氨水
FeCl2+2NH3·H2O
=Fe(OH)2↓+2NH4Cl
Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
氯化亚铁溶液中滴加新制氯水
2FeCl2+Cl2=2FeCl3
2Fe2++Cl2=2Fe3++2Cl-
氢氧化亚铁变成红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
/
铁片溶于氯化铁溶液
Fe+2FeCl3=3FeCl2
Fe+2Fe3+=3Fe2+
铜
铜片溶于氯化铁溶液
Cu+2FeCl3=2FeCl2+CuCl2
Cu+2Fe3+=2Fe2++Cu2+
铜溶于浓HNO3
Cu+4HNO3浓
=Cu(NO3)2+2NO2↑+2H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
铜溶于稀HNO3
3Cu+8HNO3稀
=3Cu(NO3)2+2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O