- 873.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电化学
历年(2015-2018)高考真题
1.【2017新课标Ⅰ卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
2.【2017新课标Ⅱ卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为混合溶液。下列叙述错误的是
A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极
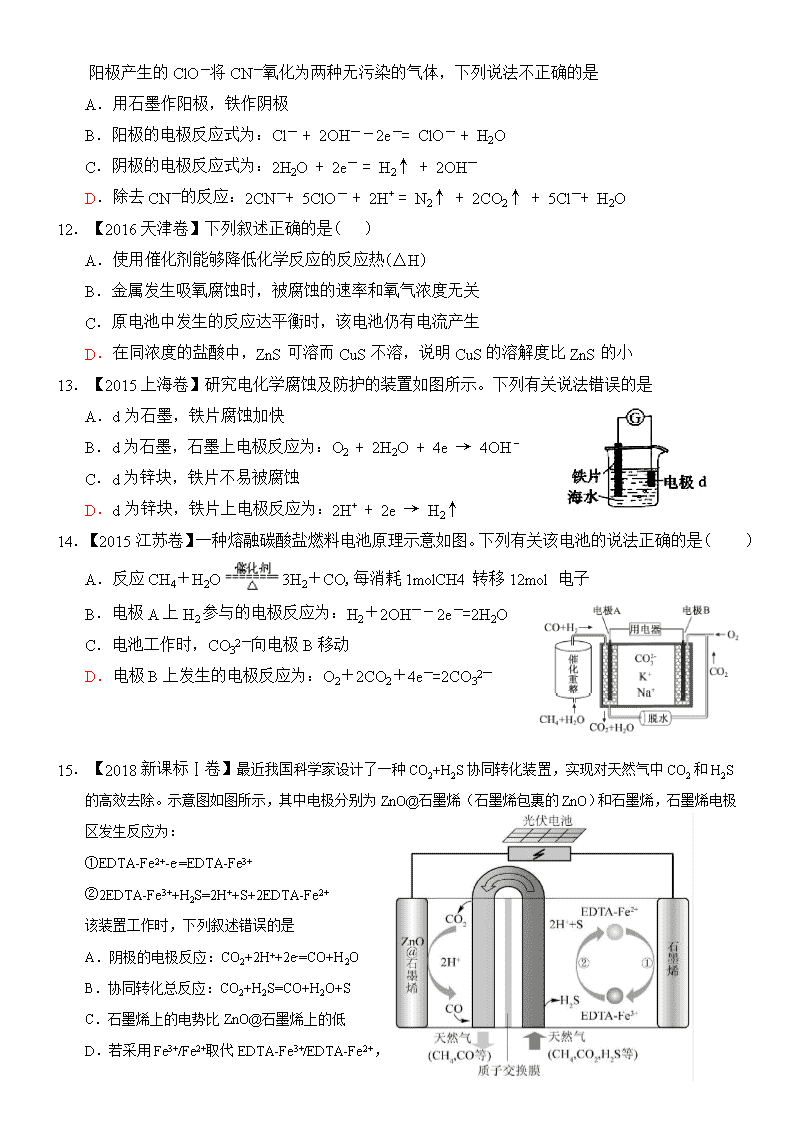
C.阴极的电极反应式为: D.硫酸根离子在电解过程中向阳极移动
3.【2017新课标Ⅲ卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
4.【2016新课标Ⅱ卷】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+ B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移 D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
5.【2016新课标Ⅰ卷】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O − 4e– = O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
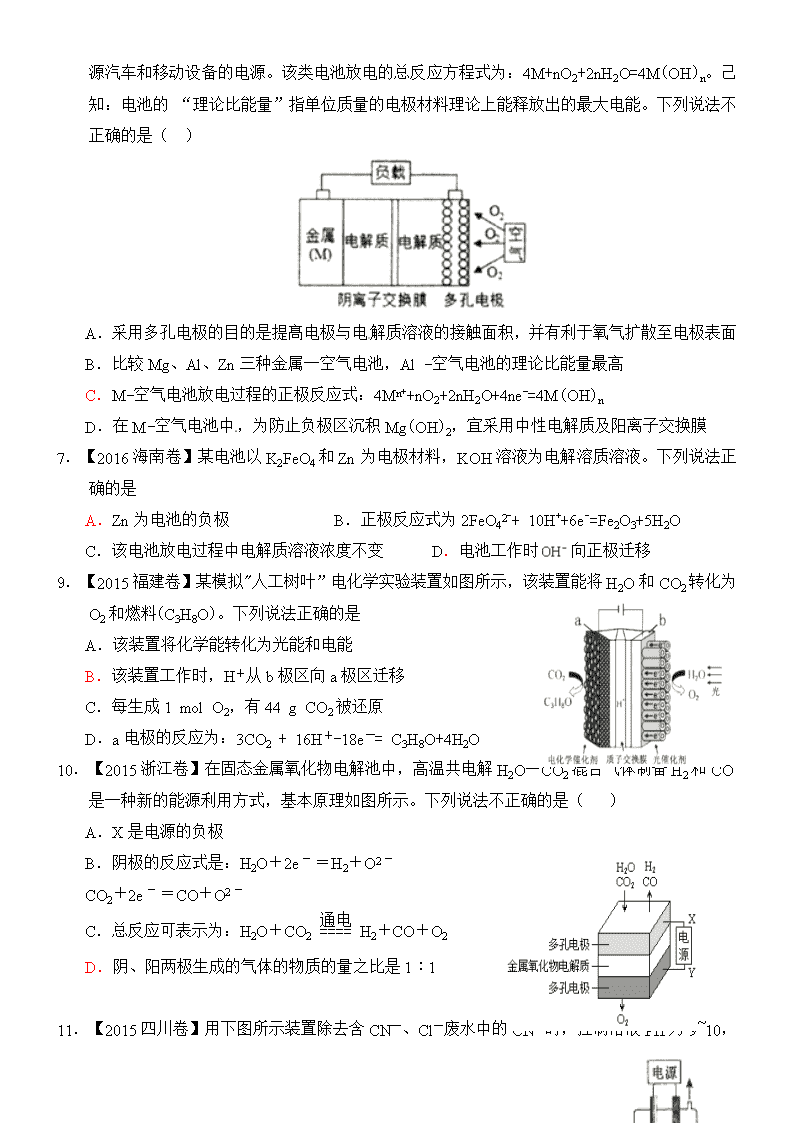
6.【2016浙江卷】金属(M
)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的 “理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
A.采用多孔电极的目的是提髙电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属一空气电池,Al -空气电池的理论比能量最高
C.M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
D.在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
7.【2016海南卷】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.Zn为电池的负极 B.正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变 D.电池工作时向正极迁移
9.【2015福建卷】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为:3CO2 + 16H+-18e-= C3H8O+4H2O
10.【2015浙江卷】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ
CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
11.【2015四川卷】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10
,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
12.【2016天津卷】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热(△H)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.原电池中发生的反应达平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
13.【2015上海卷】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
14.【2015江苏卷】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A.反应CH4+H2O3H2+CO,每消耗1molCH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
15.【2018新课标Ⅰ卷】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:CO2+2H++2e-=CO+H2O
B.协同转化总反应:CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
16.【2018新课标Ⅱ卷】(6分)我国科学家研发了一种室温下“可呼吸”的Na﹣CO3二次电池,将NaClO4溶于有机溶剂作为电解液。钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na⇌2Na2CO3+C,下列说法错误的是( )
A.放电时,ClO4﹣向负极移动 B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e﹣═2CO32﹣+C D.充电时,正极反应为:Na++e﹣═Na
17.【2018新课标Ⅲ卷】一种可充电锂﹣空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2﹣x(x=0或1)。下列说法正确的是( )
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向多孔碳材料区迁移
D.充电时,电池总反应为Li2O2﹣x═2Li+(1﹣)O2
18.【2018北京卷】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
①
②
③
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法不正确的是
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
19.【2017江苏卷】(12分)铝是应用广泛的金属。以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3
等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,
原因是________ ___。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_____________________,
阴极产生的物质A的化学式为____________。
【答案】(3)石墨电极被阳极上产生的O2氧化 (4)4CO32-+2H2O−4e−=4HCO3-+O2↑ H2
20.【2017天津卷】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
【答案】(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液
CrO42-和Cr2O72- NaOH和H2
21.【2016江苏卷】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72–的酸性废水通过铁炭混合物,在微电池正极上Cr2O72–转化为Cr3+,其电极反应式为_____________。
【答案】(1)Cr2O72–+6e-+14H+=2Cr3++7H2O
22.【2016天津卷】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH−)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因: 。
【答案】(1)H2+2OH--2e-=2H2O (5)①阳极室 ②防止Na2FeO4与H2反应使产率降低
③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低)。
23.【2016浙江卷】催化还原CO2是解决温室效应及能源问题的重要手段之一。
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在 极,该电极反应式是 。
【答案】(5)阴 CO2+6H++6e−==CH3OH+H2O
24.【2015新课标2卷】(15分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为 。
【答案】(2)①NH4Cl+2HCl3H2↑+NCl3
25.【2015重庆卷】(14分)我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
【答案】(5) ① c ② 2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ ③0.448
26.【2015新课标Ⅱ卷】酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
溶解度/(g/100 g水)
温度/℃
化合物
0
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(1)该电池的正极反应式为________________________,电池反应的离子方程式为________________________。
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过______________________分离回收;滤渣的主要成分是MnO2、______和______,欲从中得到较纯的MnO2,最简便的方法为__________,其原理是__________________________________。
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀H2SO4和H2O2溶解,铁变为________,加碱调节至pH为________时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1
时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2,后果是________________________,原因是__________________________________________。
答案:(1)MnO2+H++e-===MnOOH 2MnO2+Zn+2H+===2MnOOH+Zn2+
(注:式中Zn2+可写为Zn(NH3)、Zn(NH3)2Cl2等,H+可写为NH)
(2)加热浓缩、冷却结晶 碳粉 MnOOH 空气中加热 碳粉转变为CO2,MnOOH氧化为MnO2
(3)Fe3+ 2.7 6 Zn2+和Fe2+分离不开 Fe(OH)2和Zn(OH)2的Ksp相近
27.[2016·全国卷Ⅰ] NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO2中Cl的化合价为____________。
(2)写出“反应”步骤中生成ClO2的化学方程式:____________________________________________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为__________、__________。“电解”中阴极反应的主要产物是__________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为____________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________。(计算结果保留两位小数)
答案:(1)+3 (2)2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4
(3)NaOH溶液 Na2CO3溶液 ClO(或NaClO2) (4)2∶1 O2 (5)1.57
28.【2018新课标Ⅰ卷 27(14分)】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3
和Na2SO3。阳极的电极反应式为_____________。电解后,_____________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L−1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L−1(以SO2计)。
29.【2018新课标Ⅲ卷(14分)】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是 。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
酸化反应”所得产物有KH(IO3)2、Cl2和KCI.“逐Cl2”采用的方法是 。“滤液”中的溶质主要是 。“调pH”中发生反应的化学方程式为 。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式 。
②电解过程中通过阳离子交换膜的离子主要为 ,其迁移方向是 。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有 (写出一点)。