- 52.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
Si
SiO2
Na2SiO3
H2SiO3
O2
NaOH
CO2
C
Na2CO3
CaCO3
HF
CaO
Na2SiO3
CaSiO3
SiO2
SiF4
H4SiO4
CaSiO3
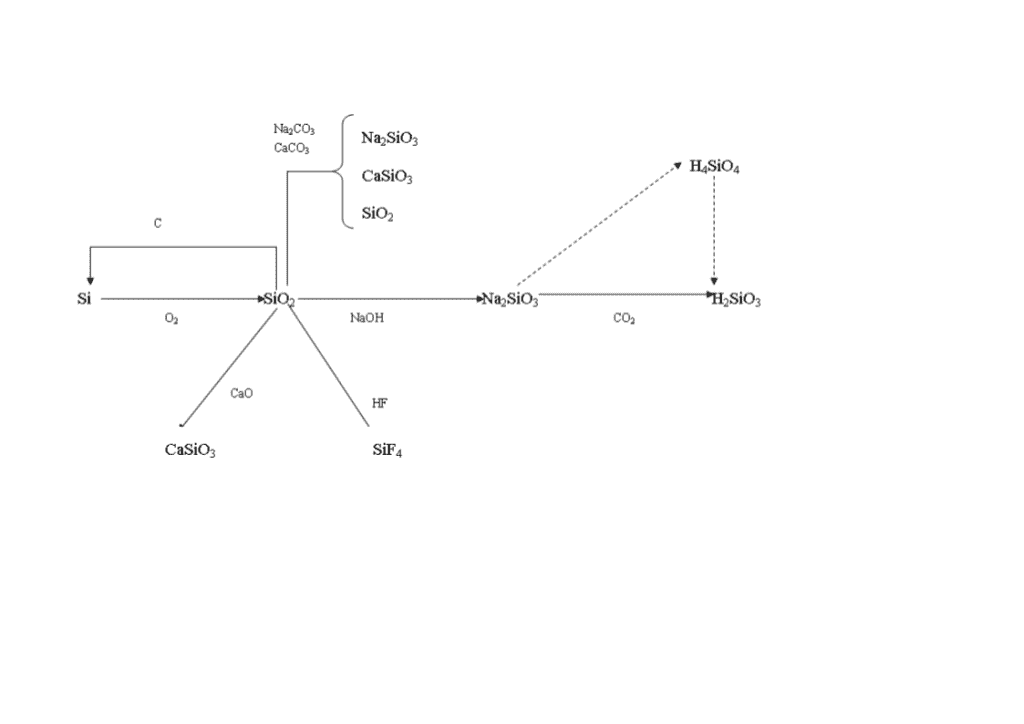
1、单质硅
主要以晶体和无定型两种形式存在;自然界中没有游离态的硅;高纯硅用作半导体材料(太阳能电池极、电脑芯片、集成电路)
Si + 2NaOH + H2O ==== Na2SiO3 +2H2↑
2、二氧化硅
主要以晶体和无定型两种形式存在,这两种形式统称为硅石;二氧化硅俗名石英,是沙子、水晶、玛瑙的主要成分。
SiO2 + 4HF ==== SiF4↑+ 2H2O (腐刻玻璃的原因)
SiO2 + 2NaOH ====Na2SiO3 + H2O (碱性溶液不用玻璃塞的主要原因)
制取玻璃的主要方程
普通玻璃:Na2SiO3、CaSiO3、SiO2
钢化玻璃:Na2SiO3、CaSiO3、SiO2(普通玻璃骤冷)
有色玻璃:添加显色粒子
石英玻璃:SiO2含量高,耐高温
SiO2 +CaO==== CaCO3 (SiO2是酸性氧化物,是酸酐,并且是唯一一个常见的不能与水直接生成对应酸的酸酐)
3、硅酸钠
俗名水玻璃,常用作玻璃胶
Na2SiO3 + CO2 + H2O ==== Na2CO3 + H2SiO3 ↓ (生成硅胶) 证明碳酸酸性强于硅酸
4、H4SiO4 (原硅酸)易失去水生成硅酸
硅酸制取:二氧化硅→硅酸钠→硅酸
S
SO2
SO3
H2SO4
O2
O2
H2O
H2O
H2SO3
O2
加
热
1、硫单质
自然界中游离态的硫存在于火山口,单质硫是淡黄色固体,难溶于水、微溶于酒精、易溶于CS2。
化石燃料(煤、石油、天然气)的燃烧是酸雨的主要成因
2、二氧化硫
无色刺激性气味气体。致癌。
酸雨的成因 酸雨静止一段时间酸性增强的原因
二氧化硫遇品红生成不稳定的络合物使品红褪色,加热后颜色恢复。因此,经常可以认为二氧化硫表现弱漂白性。
SO2 + NaOH (少量)==== NaHSO3
SO2 + 2NaOH (足量)==== Na2SO3
二氧化硫是酸性氧化物、是亚硫酸的酸酐。
3、 亚硫酸是不稳定的酸