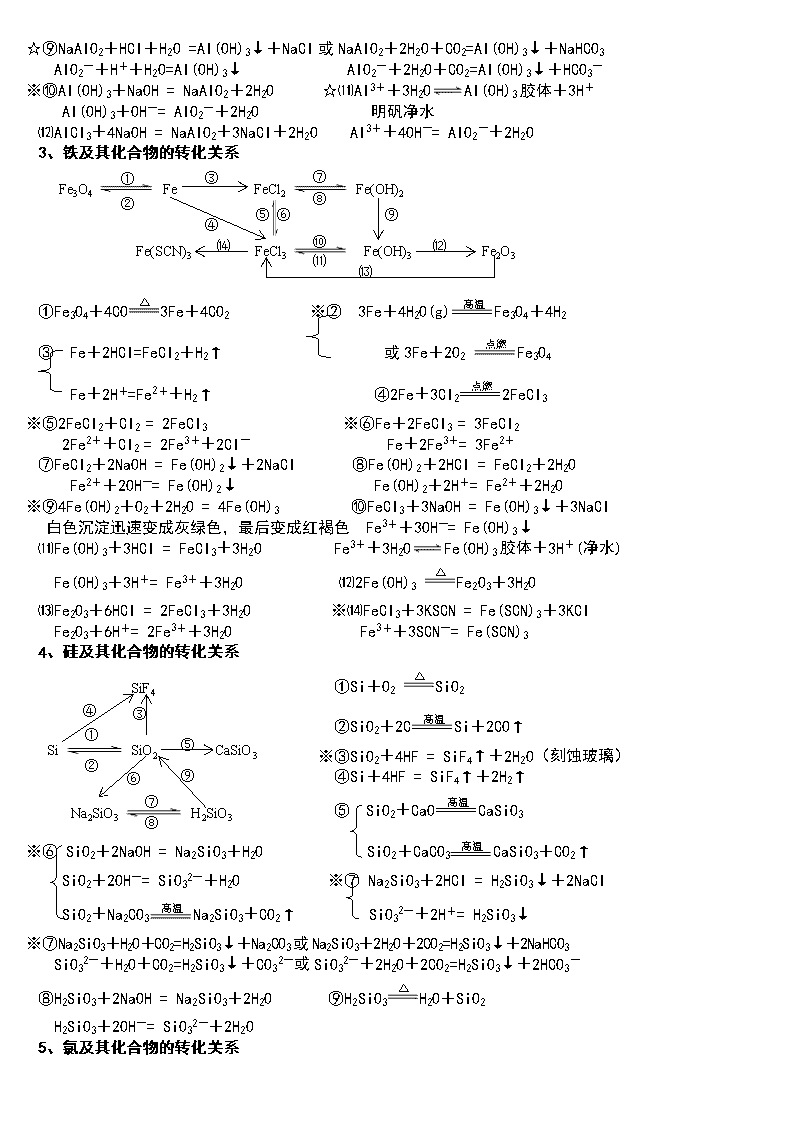- 371.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高中化学必修本化学方程式汇总
必修一
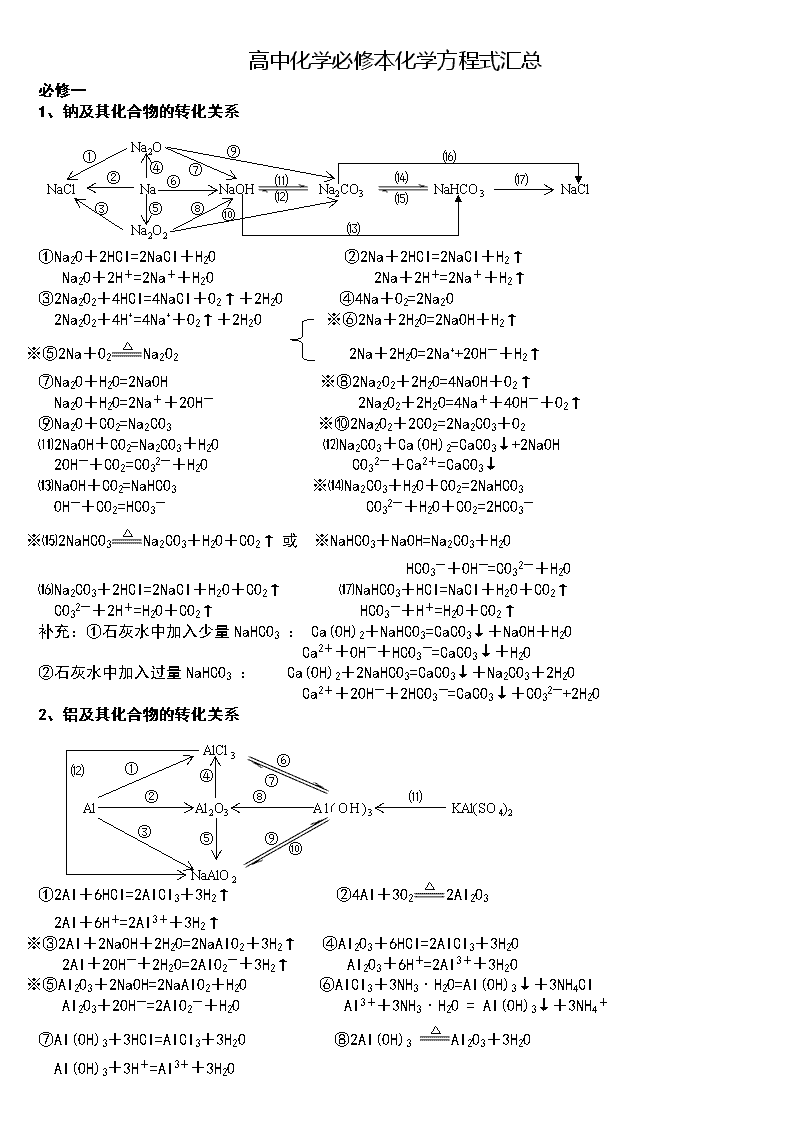
1、钠及其化合物的转化关系
NaCl Na NaOH Na2CO3 NaHCO3 NaCl
Na2O
Na2O2
①
②
③
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
⒀
⒁
⒂
⒃
⒄
④
①Na2O+2HCl=2NaCl+H2O ②2Na+2HCl=2NaCl+H2↑
Na2O+2H+=2Na++H2O 2Na+2H+=2Na++H2↑
③2Na2O2+4HCl=4NaCl+O2↑+2H2O ④4Na+O2=2Na2O
2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑
※⑤2Na+O2Na2O2 2Na+2H2O=2Na++2OH-+H2↑
⑦Na2O+H2O=2NaOH ※⑧2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2Na++2OH- 2Na2O2+2H2O=4Na++4OH-+O2↑
⑨Na2O+CO2=Na2CO3 ※⑩2Na2O2+2CO2=2Na2CO3+O2
⑾2NaOH+CO2=Na2CO3+H2O ⑿Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
2OH-+CO2=CO32-+H2O CO32-+Ca2+=CaCO3↓
⒀NaOH+CO2=NaHCO3 ※⒁Na2CO3+H2O+CO2=2NaHCO3
OH-+CO2=HCO3- CO32-+H2O+CO2=2HCO3-
※⒂2NaHCO3Na2CO3+H2O+CO2↑ 或 ※NaHCO3+NaOH=Na2CO3+H2O
HCO3-+OH-=CO32-+H2O
⒃Na2CO3+2HCl=2NaCl+H2O+CO2↑ ⒄NaHCO3+HCl=NaCl+H2O+CO2↑
CO32-+2H+=H2O+CO2↑ HCO3-+H+=H2O+CO2↑
补充:①石灰水中加入少量NaHCO3 : Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
Ca2++OH-+HCO3-=CaCO3↓+H2O
②石灰水中加入过量NaHCO3 : Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
2、铝及其化合物的转化关系
Al Al2O3 Al(OH)3 KAl(SO4)2
NaAlO2
AlCl3
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
①2Al+6HCl=2AlCl3+3H2↑ ②4Al+3O22Al2O3
2Al+6H+=2Al3++3H2↑
※③2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ④Al2O3+6HCl=2AlCl3+3H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+6H+=2Al3++3H2O
※⑤Al2O3+2NaOH=2NaAlO2+H2O ⑥AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
Al2O3+2OH-=2AlO2-+H2O Al3++3NH3·H2O = Al(OH)3↓+3NH4+
⑦Al(OH)3+3HCl=AlCl3+3H2O ⑧2Al(OH)3 Al2O3+3H2O
Al(OH)3+3H+=Al3++3H2O
☆⑨NaAlO2+HCl+H2O =Al(OH)3↓+NaCl或NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3
AlO2-+H++H2O=Al(OH)3↓ AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
※⑩Al(OH)3+NaOH = NaAlO2+2H2O ☆⑾Al3++3H2OAl(OH)3胶体+3H+
Al(OH)3+OH-= AlO2-+2H2O 明矾净水
⑿AlCl3+4NaOH = NaAlO2+3NaCl+2H2O Al3++4OH-= AlO2-+2H2O
3、铁及其化合物的转化关系
Fe3O4 Fe FeCl2 Fe(OH)2
Fe(SCN)3 FeCl3 Fe(OH)3 Fe2O3
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
⒁
⒀
①Fe3O4+4CO3Fe+4CO2 ※② 3Fe+4H2O(g)Fe3O4+4H2
③ Fe+2HCl=FeCl2+H2↑ 或3Fe+2O2 Fe3O4
Fe+2H+=Fe2++H2↑ ④2Fe+3Cl22FeCl3
※⑤2FeCl2+Cl2 = 2FeCl3 ※⑥Fe+2FeCl3 = 3FeCl2
2Fe2++Cl2 = 2Fe3++2Cl- Fe+2Fe3+= 3Fe2+
⑦FeCl2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl2+2H2O
Fe2++2OH-= Fe(OH)2↓ Fe(OH)2+2H+= Fe2++2H2O
※⑨4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ⑩FeCl3+3NaOH = Fe(OH)3↓+3NaCl
白色沉淀迅速变成灰绿色,最后变成红褐色 Fe3++3OH-= Fe(OH)3↓
⑾Fe(OH)3+3HCl = FeCl3+3H2O Fe3++3H2OFe(OH)3胶体+3H+(净水)
Fe(OH)3+3H+= Fe3++3H2O ⑿2Fe(OH)3 Fe2O3+3H2O
⒀Fe2O3+6HCl = 2FeCl3+3H2O ※⒁FeCl3+3KSCN = Fe(SCN)3+3KCl
Fe2O3+6H+= 2Fe3++3H2O Fe3++3SCN-= Fe(SCN)3
4、硅及其化合物的转化关系
Na2SiO3
SiF4
Si
SiO2
H2SiO3
CaSiO3
①
②
③
④
⑤
⑥
⑦
⑧
⑨
①Si+O2 SiO2
②SiO2+2CSi+2CO↑
※③SiO2+4HF = SiF4↑+2H2O(刻蚀玻璃)
④Si+4HF = SiF4↑+2H2↑
⑤ SiO2+CaOCaSiO3
※⑥ SiO2+2NaOH = Na2SiO3+H2O SiO2+CaCO3CaSiO3+CO2↑
SiO2+2OH-= SiO32-+H2O ※⑦ Na2SiO3+2HCl = H2SiO3↓+2NaCl
SiO2+Na2CO3Na2SiO3+CO2↑ SiO32-+2H+= H2SiO3↓
※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3
SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
⑧H2SiO3+2NaOH = Na2SiO3+2H2O ⑨H2SiO3H2O+SiO2
H2SiO3+2OH-= SiO32-+2H2O
5、氯及其化合物的转化关系
CuCl2
HClO
HCl
Cl2
FeCl3
NaClO
Ca(ClO)2
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
①2Fe+3Cl2 2FeCl3
②Cu+Cl2 CuCl2
③2FeCl3+Cu = 2FeCl2+CuCl2
2Fe3++Cu = 2Fe2++Cu2+
点燃
或光照
④H2+Cl2 2HCl
※⑤MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
光照
MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
光照
※⑥Cl2+H2O = HCl+HClO ※⑦2HClO 2HCl+O2↑
Cl2+H2O = H++Cl-+HClO 2HClO 2H++2Cl-+O2↑
※⑧Cl2+2NaOH = NaCl+NaClO+H2O ※⑨2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
Cl2+2OH-= Cl-+ClO-+H2O 工业制漂白粉
※⑩Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO或Ca(ClO)2+2HCl = CaCl2+2HClO
Ca2++2ClO-+H2O+CO2= CaCO3↓+2HClO或ClO-+H+= HClO
漂白粉的漂白原理
向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO
ClO-+H2O+CO2 = HCO3-+HClO
6、硫及其化合物的转化关系
①
⑤
S SO2 SO3 H2SO4
CaSO3 CaSO4
②
③
④
⑥
⑦
⑧氯水
⑨Cu
⑩C
①S+O2 SO2
②2H2S+SO2=3S+2H2O
※③SO2+O22SO3
④SO3+H2O = H2SO4
⑤SO2+CaOCaSO3 或 SO2+Ca(OH)2 = CaSO3↓+H2O
⑥ SO3+CaO = CaSO4 SO2+Ca2++2OH-=CaSO3↓+H2O
SO3+Ca(OH)2 = CaSO4+H2O ⑦2CaSO3+O22CaSO4
※⑧SO2+Cl2+2H2O = H2SO4+2HCl ※⑨Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
SO2+Cl2+2H2O = 4H++SO42-+2Cl- Cu+2H2SO4(浓)Cu2++SO42-+SO2↑+2H2O
※⑩C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
高温或放电
7、氮及其化合物的转化关系
①
⑨
⑧
⑦
⑥
④
③
⑤
N2 NH3 NH4Cl
NO NO2 HNO3
②
③
※①N2+O2 2NO
※②2NO+O2 = 2NO2
※③3NO2+H2O = 2HNO3+NO
3NO2+H2O =2H++2NO3-+NO
以上三个反应为“雷雨发庄稼”原理
扩展反应有:4NO2+O2+2H2O = 4HNO3
4NO+3O2+2H2O = 4HNO3
光照
※④Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 上面两个反应主要用于气体溶于水时的计算
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 或4HNO3 4NO2↑+ O2↑+ 2H2O
C+4HNO3(浓)CO2↑+2NO2↑+2H2O 浓硝酸见光易变黄的原因
※⑤3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O ⑥N2+3H22NH3
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 合成氨反应是人工固氮的主要途径
⑦NH3+HCl = NH4Cl ⑧NH4Cl NH3↑+HCl↑
NH3+H+ = NH4+(水溶液中) 补充:NH4HCO3 NH3↑+H2O+CO2↑
氨气与酸均能反应生成铵盐,且与挥发性酸(如浓HCl、浓HNO3)相遇时空气中有白烟 铵盐受热都易分解,但并不是所有的铵盐
都分解出氨气,如NH4NO3、(NH4)2SO4
※⑧NH4Cl+NaOH NaCl+NH3↑+H2O NH4++OH-NH3↑+H2O
所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
※⑧⑶2NH4Cl+2Ca(OH)2CaCl2+2NH3↑+2H2O
实验室制氨气,此反应为固体反应,不能写成离子方程式。
☆⑨4NH3+5O24NO+6H2O 氨的催化氧化反应,工业制硝酸的第一步。
注:带“※”的反应为重要反应,必须熟记;带“☆”的反应只需了解。
必修二
第一章 物质结构 元素周期律
1、Li与O2反应(点燃): 4Li + O2 2Li2 O
Na与O2反应(点燃): 2Na+O2Na2O2
Na与H2O反应: 2Na+2H2O===2NaOH+H2↑
K与H2O反应: 2K+2H2O===2KOH+H2↑
2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应:
F2 + H2 === 2HF Cl2 + H2 === 2HCl
Br2 + H2 === 2Br I2 + H2 === 2HI
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:
① Cl2+2NaBr===Br2+2NaCl
② Cl2+2NaI===I2+2NaCl
(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr
4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑
Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑
Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑
5、Na与Cl2反应(点燃):
6、用电子式表示氯化氢的形成过程:
第二章 化学反应与能量
1、Ba(OH)2•8H2O与NH4Cl的反应 :
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
2、原电池原理
典型的原电池(Zn-Cu原电池)
负极(锌):Zn-2e-===Zn2+(氧化反应)
正极(铜):2H++2e-===H2↑(还原反应)
电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn+2H+===Zn2++H2↑
3、H2O2在催化剂作用下受热分解: 2H2O2 2H2O+O2↑
4、Na2SO4与CaCl2反应:Na2SO4+CaCl2===CaSO4↓+Na2CO3
5、高炉炼铁:2C + O2 === 2CO
Fe2O3 + 3CO ==2Fe + 3CO2
第三章 有机化合物
1、甲烷的主要化学性质
(1)氧化反应(与O2的反应):CH4(g)+2O2(g) CO2(g)+2H2O(l)
(2)取代反应(与Cl2在光照条件下的反应,生成四种不同的取代物):
2、乙烯的主要化学性质
(1)氧化反应(与O2的反应):C2H4+3O2 2CO2+2H2O
(2)加成反应((与Br2的反应):
(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:
CH2=CH2 + H2CH3CH3
CH2=CH2+HClCH3CH2Cl(一氯乙烷)
CH2=CH2+H2OCH3CH2OH(乙醇)
(4)聚合反应:
(乙烯制聚乙烯)①
(氯乙烯制聚氯乙烯)②
3、苯的主要化学性质:
(1)氧化反应(与O2的反应):2C6H6+15O2 12CO2+6H2O
(2)取代反应:
Br
① 与Br2的反应: + Br2 + HBr
② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。反应方程式:
—NO2
+ HONO2 + H2O
(3)加成反应
用镍做催化剂,苯与氢发生加成反应: + 3H2
4、乙醇的重要化学性质
(1)乙醇与金属钠的反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑
(2)乙醇的氧化反应
①乙醇的燃烧: CH3CH2OH+3O2 2CO2+3H2O
②乙醇的催化氧化反应: 2CH3CH2OH+O2 2CH3CHO+2H2O
③乙醇在常温下的氧化反应:
CH3CH2OHCH3COOH
5、乙酸的重要化学性质
(1)乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2)乙酸的酯化反应
①反应原理(与乙醇的反应):
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
6、①蔗糖水解反应:C12H22O11+H2O→C6H12O6+C6H12O6
②淀粉(纤维素)水解反应:
③油脂的重要化学性质——水解反应:
a)油脂在酸性条件下的水解: 油脂+H2O甘油+高级脂肪酸
b)油脂在碱性条件下的水解(又叫皂化反应):
油脂+H2O甘油+高级脂肪酸
蛋白质+H2O各种氨基酸
第四章 化学与可持续发展
1、HgO受热分解:2HgO 2Hg + O2↑
Ag2O受热分解:2Ag2O 4Ag + O2↑
2、CO还原Fe2O3:Fe2O3 + 3CO 2Fe +3CO2 (高炉炼铁)
① C 还原ZnO :2 ZnO + C 2 Zn +CO2↑
② C 还原MgO : MgO +C Mg + CO↑
③ Al 还原Fe2O3(铝热反应): Fe2O3 + 2Al 2Fe + Al2O3
④ Fe还原CuSO4: CuSO4 + Fe ==== FeSO4 +Cu (湿法炼铜)
3、电解
①电解NaCl:2NaCl(熔融) 2Na +Cl2↑
②电解MgCl2: MgCl2(熔融) Mg +Cl2↑
③电解Al2O3: 2Al2O3(熔融) 4Al + 3O2↑
4、石油的催化裂化
例如:C4H10 C2H4 + C2H6
C16H34 C8H18 +C8H16
C8H18 C4H10 +C4H8
C4H10 CH4 + C3H6
C4H10 C2H4 + C2H6