- 2.79 MB
- 2021-06-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
泉州市 2020 届普通高中毕业班适应性线上测试
理科综合能力测试
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写清楚。
2.选择题按老师规定的方式作答。非选择题请自行打印答题卡,按照题号顺序在各题目的答题区域
内作答;不能打印的,非选择题请标明题号,自行画定答题区域,并在相应区域内答题, 超出答题区域书
写的答案无效。
3.答题完毕,请将答案按老师要求用手机拍照并上传给学校,要注意照片的清晰,不要多拍、漏拍。
可能用到的相对原子质量 H 1 C 12 O 16 F 19Na 23 P 31 S 32Cl 35.5 K 39 Ca 40 Zn 65
一、选择题:本题共 13 个小题,每小题 6 分。共 78 分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1.下列关于细胞结构和功能的叙述,错误的是
A.多数细菌可以进行有氧呼吸,但不含有线粒体
B.细菌中 DNA 不与蛋白质结合,但能复制与表达
C.颤藻和叶肉细胞均含有叶绿素能进行光合作用
D.生物膜间可通过囊泡实现物质运输和膜成分更新
2.下列技术手段与相关实验相符合的是
3.研究人员发现,抑癌基因 p53 发生突变的缺陷型肿瘤细胞中 a-酮戊二酸相对含量降低,细胞恶性增殖。
加入 a-酮戊二酸进行培养,该肿瘤细胞的增殖受到抑制。下列相关推测合理的是
A.α-酮戊二酸能促进肿瘤细胞增殖
B.α-酮戊二酸促进肿瘤细胞 p53 基因发生突变
C.α-酮戊二酸是抑癌基因 p53 影响肿瘤细胞增殖的媒介
D.α-酮戊二酸通过调节抑癌基因 p53 的表达对肿瘤细胞的增殖起作用
2
4.下列关于一个基因型为 AaBb 的精原细胞产生的 4 个精子的种类及比例的分析,错误的是
A.若 AaB︰b=2︰2,则分裂过程中可能有同源染色体未分离
B.若 AB︰ab=2︰2,则这两对等位基因可能位于同一对同源染色体上
C.若 AB︰aB︰ab=1︰1︰2,则减数分裂过程中 A 基因与 a 基因发生了交换
D.若 AB︰Ab︰aB︰ab=1︰1︰1︰1,则这两对等位基因可能位于同一对同源染色体上
5.某乡村的景观空间格局以成片的农田为基底,以村落、池塘等为斑块,以道路、林带、河流等为廊道,
打造成了全国美丽乡村的样板。下列相关叙述错误的是
A.农田群落物种组成比较单一,但仍具有垂直结构和水平结构
B.人类活动会使群落演替按照不同于自然演替的速度和方向进行
C.实施美丽乡村项目能实现能量的多级利用,提高能量的传递效率
D.乡村绿地能调节小气候、保持水土,体现了生物多样性的间接价值
6.下图为某种单基因常染色体隐性遗传病的系谱图。假定图中Ⅱ3、Ⅱ4 个体生出一个患该遗传病子代的概
率是 1/8,那么得出此概率值需要的限定条件是
A.Ⅱ3、Ⅱ4 必须为杂合子 B.Ⅰ1、Ⅱ2 和Ⅱ3 必须为杂合子
C.Ⅰ2 必须为纯合子,Ⅱ2 必须为杂合子 D.Ⅰ1 或Ⅰ2 必须为纯合子,Ⅱ4 必须为杂合子
7.下列有关化学与生活的说法错误的是
A.用可溶性的铝盐和铁盐对水进行杀菌消毒
B.用石灰、碳酸钠等碱性物质处理废水中的酸
C.牛奶、鸡蛋清均可用于重金属中毒解毒
D.碘酒、双氧水均可用于伤口消毒
8.香茅醛 Y 主要用于食用香精,也用作其他香料的原料,在一定条件下可分别转化为 X、Z。下列叙述错
误的是
A.Y 的分子式为 C10H18O
B.X 能与 Z 发生取代反应
C.可用新制 Cu(OH)2 鉴别出 X、Y、Z
D.X、Y、Z 均存在对应的芳香族同分异构体
3
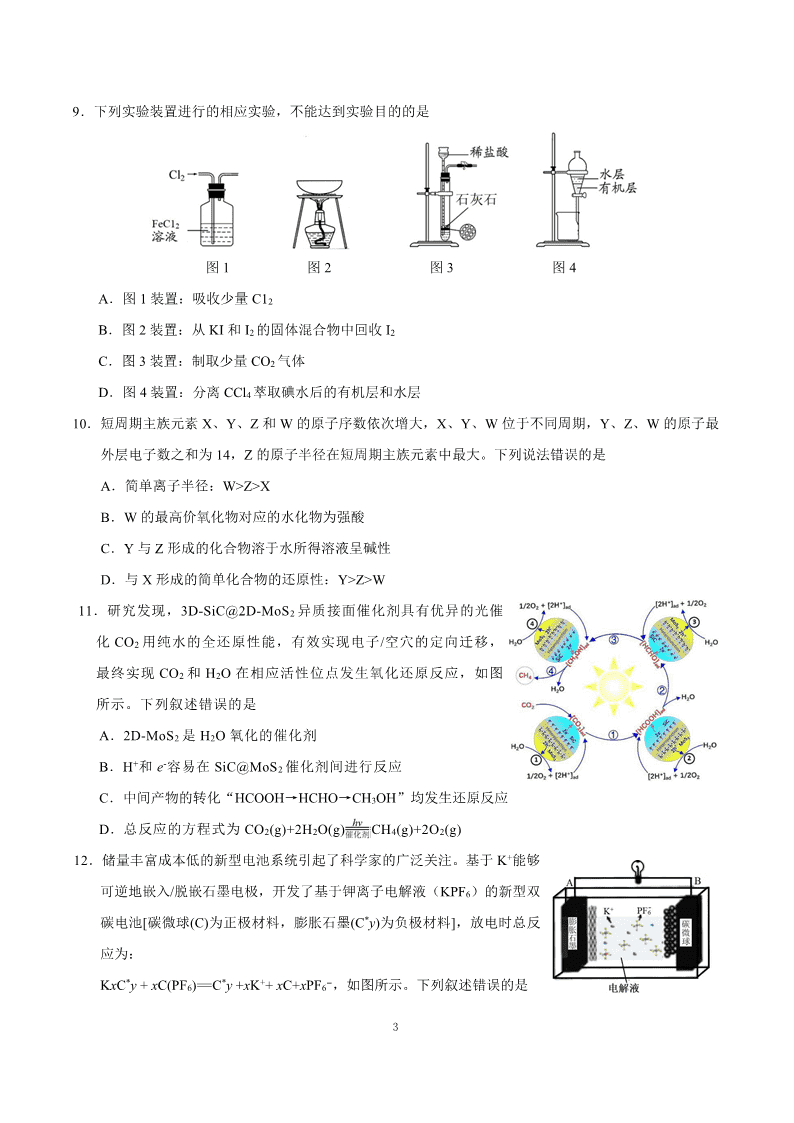
9.下列实验装置进行的相应实验,不能达到实验目的的是
图 1 图 2 图 3 图 4
A.图 1 装置:吸收少量 C12
B.图 2 装置:从 KI 和 I2 的固体混合物中回收 I2
C.图 3 装置:制取少量 CO2 气体
D.图 4 装置:分离 CCl4 萃取碘水后的有机层和水层
10.短周期主族元素 X、Y、Z 和 W 的原子序数依次增大,X、Y、W 位于不同周期,Y、Z、W 的原子最
外层电子数之和为 14,Z 的原子半径在短周期主族元素中最大。下列说法错误的是
A.简单离子半径:W>Z>X
B.W 的最高价氧化物对应的水化物为强酸
C.Y 与 Z 形成的化合物溶于水所得溶液呈碱性
D.与 X 形成的简单化合物的还原性:Y>Z>W
11.研究发现,3D-SiC@2D-MoS2 异质接面催化剂具有优异的光催
化 CO2 用纯水的全还原性能,有效实现电子/空穴的定向迁移,
最终实现 CO2 和 H2O 在相应活性位点发生氧化还原反应,如图
所示。下列叙述错误的是
A.2D-MoS2 是 H2O 氧化的催化剂
B.H+和 e-容易在 SiC@MoS2 催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为 CO2(g)+2H2O(g) CH4(g)+2O2(g)
12.储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于 K+能够
可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双
碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反
应为:
KxC*y + xC(PF6)=C*y +xK++ xC+xPF6-,如图所示。下列叙述错误的是
4
A.放电时,K+在电解质中由 A 极向 B 极迁移并嵌入碳微球中
B.充电时,A 极的电极反应式为 C*y + xK++xe-=KxC*y
C.放电时,每转移 0.1 NA 电子时,电解质增重 18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
13.常温下,向 20mL 0.1 mol·L-1 NH4HSO4 溶液中逐滴加入 0.1 mol·L-1 的 NaOH 溶液,溶液中由水电离出
的 c 水(H+)与所加 NaOH 溶液的体积的关系如图所示。下列分析正确的是
A.c 点之前,主要的反应为 NH4++ OH-=NH3·H2O
B.b 点和 d 点对应溶液的 pH 均为 7
C.常温下,Kb(NH3·H2O)=5×10-5.4 mol·L-1
D.d 点溶液中,c(Na+)+c(NH4+)=c(SO42-)
二、选择题:本题共 8 小题,每小题 6 分。在每小题给出的四个选项中,第 14~18 题只有一项符合题目要
求,第 19~21 题有多项符合题目要求。全部选对的得 6 分,选对但不全的得 3 分,有选错的得 0 分。
14.如图,缆车用钢索悬挂着,处于静止状态,其底板上放置一小物块,物块与缆车左侧壁用水平轻弹簧
连接起来,弹簧处于拉伸状态,物块恰好不会相对底板滑动。已知缆车质量远大于物块质量,物块与
缆车底板间的动摩擦因数为μ,最大静摩擦力等于滑动摩擦力,不计空气阻力,重力加速度为 g,则钢
索断开瞬间
A.物块没有受到摩擦力 B.物块受到滑动摩擦力
C.物块的加速度大小为 g D.物块的加速度大小为μg
15.利用频闪照相法记录了一竖直上抛小球的运动轨迹,并描绘出小球的位移 x 随时间 t 的变化图象如图
所示,其中 0 时刻、第 1 个像都对应小球的抛出点,t1 时刻、第 5 个像都对应小球运动的最高点,且
t2=2t1,重力加速度为 g,则
A.t1 时刻前后,小球加速度方向相反
B.0~t1 和 t1~t2 两段时间内,小球速度变化量大小相等、方向相反
C.第 3 个像与第 4 个像之间的高度差为 5
32gt12
D.在 t1 时刻以相同方式抛出另一个小球,两球将相遇在第 3 个像的位置
16.如图,O 点为纸面内矩形 abcd 的中心,e 和 f 是其上、下两边的中点,两根通电长直导线垂直纸面固
定在矩形左右两边的中点处,两导线中的电流强度大小相等、方向相反。已知通电长直导线周围磁场
中某点磁感应强度大小与导线中电流强度成正比,与该点到导线的距离成反比,不计地磁场的影响,
则
A.O 点的磁感应强度为零
B.e、f 两点磁感应强度大小相等、方向相反
C.放在 a、c 两点的小磁针,静止时 N 极指向相同
D.电子沿 fe 做直线运动的过程中,经过 O 点时受到的磁场力最大
10-5.3
10-7
c 水(H+)/(mol·L-1)
20 35V(NaOH)/mL
O
a b
cd
e
f
x
t
O t1 t2
1
2
3
4
5
P
钢索
5
17.如图,理想自耦变压器原线圈的 a、b 两端接有瞬时值表达式为 u=20 2sin(50πt)V 的交变电压,指示灯
L 接在变压器的一小段线圈上,调节滑动片 P1 可以改变副线圈的匝数,调节滑动片 P2 可以改变负载电
阻 R2 的阻值,则
A.t=0.04s 时电压表 V1 的示数为零
B.只向上移动 P2,指示灯 L 将变暗
C.P1、P2 均向上移动,电压表 V2 的示数可能不变
D.P1、P2 均向上移动,原线圈输入功率可能不变
18.2019 年 3 月 10,长征三号乙运载火箭将“中星 6C”通信卫星(记为卫星Ⅰ)送入地球同步轨道上,
主要为我国、东南亚、澳洲和南太平洋岛国等地区提供通信与广播业务。在同平面内的圆轨道上有一
颗中轨道卫星Ⅱ,它运动的每个周期内都有一段时间 t(t 未知)无法直接接收到卫星Ⅰ发出的电磁波
信号,因为其轨道上总有一段区域没有被卫星Ⅰ发出的电磁波信号覆盖到,这段区域对应的圆心角为
2α。已知卫星Ⅰ对地球的张角为 2β,地球自转周期为 T0,万有引力常量为 G,则根据题中条件,可求
出
A.地球的平均密度为 3π
GT02
B.卫星Ⅰ、Ⅱ的角速度之比为 sinβ
sin(α-β)
C.卫星Ⅱ的周期为 sin3β
sin3(α-β)·T0
D.题中时间 t 为 sin3β
sin3(α-β)·α
πT0
19.科学家们在探索微观世界奥秘的过程中不断取得新的认知,下列对微观领域认知的理解正确的是
A.β射线与阴极射线本质一样,都是原子核外电子所形成的粒子流
B.氢原子的核外电子由外轨道跃迁至内轨道上时,氢原子电势能的减少量大于电子动能增加量
C.用激光照射某金属,金属中吸收两个光子的电子逸出时的最大初动能,是只吸收一光子的电子逸出
时最大初动能的两倍
D.在康普顿效应中,当入射光光子与晶体中的电子碰撞时,把一部分动量转移给电子,因此,散射
后光的波长变长了
20.如图甲所示,倾角为θ的绝缘传送带以 2m/s 的恒定速率沿顺时针方向转动,其顶端与底端间的距离为
5m,整个装置处于方向垂直传送带向上的匀强电场中,电场强度大小随时间按图乙规律变化。t=0 时
刻将一质量 m=0.02kg 的带正电小物块轻放在传送带顶端,物块与传送带之间的动摩擦因数为 6
6
,已
知 sinθ= 1
5
、cosθ= 2 6
5
,E0= 2 6mg
5q
,取 g =10m/s2,则
小物块
A.始终沿传送带向下运动
B.运动过程中加速度大小不变
C.在传送带上运动的总时间为 5s
D.与传送带之间因摩擦产生的总热量为 0.16J
地球
Ⅱ
Ⅰ
“中星 6C”
2α2β
a
b
R2
R1
L
P1
V1
V2 P2
甲
θ
E
乙
E0
1
t/s
E
O 2 3 4 5
6
21.如图,正方形导线框 abcd 静置在光滑水平桌面上,其 ab 边恰好与匀强磁场的左边界重合,磁场方向
垂直桌面向下,磁场左右边界的距离大于导线框的边长。t=0 时刻开始,在 ab 中点施加一水平向右的
拉力,使导线框向右做匀加速直线运动,直到 cd 边离开磁场。规定沿 adcba 的方向为感应电流的正方
向,用 I 表示感应电流,用 Uab 表示 a、b 两点间的电势差,用 F、P 表示拉力的大小和拉力的功率,
则下列相关的关系图像中可能正确的是
三、非选择题:共 174 分,第 22~32 题为必考题,每个试题考生都必须作答。第 33~38 题为选考题,考生
根据要求作答。
(一)必考题:共 129 分。
22.(6 分)
如图甲所示的实验装置,一木块放在水平长木板上,左侧拴有一细线,跨过固定在木板边缘的定滑轮
与一重物相连,木块右侧通过纸带与打点计时器相连。释放重物后,木块在木板上向左加速运动。图乙是
重物落地前,打点计时器在纸带上打出的一些点(单位:cm)。
(1)已知打点计时器使用的交变电流频率为 50Hz,由图乙给出的数据,可得木块运动加速度的大小为
__________m/s2,纸带打 P 点时重物的瞬时速度大小为__________m/s(计算结果均保留 3 位有效数字)。
(2)设重物的质量为 M,木块的质量为 m,且线与纸带的质量均不计,除了木块与木板间有摩擦外,其它
部分的摩擦不计,重力加速度用 g 表示,若测得的加速度为 a,则木块和木板之间的动摩擦因数μ的表达式
为μ= ___________________。
23.(9 分)
为了较精确地测量一只微安表的内阻,要求按照如图给出的实验电路进行测量,器材规格如下:
A.待测微安表(量程 500μA,内阻约 1kΩ)
B.电阻箱 R0(阻值 0~999.9Ω)
C.滑动变阻器 R1(阻值 0~10Ω)
D.滑动变阻器 R2(阻值 0~1kΩ)
E.电源(电动势 2V,内阻不计)
F.开关、导线
(1)实验中滑动变阻器应选用 。
(2)按照电路图将实物图连成实验电路。
t
I
O
t
F
O
A B C D
抛物线
t
P
O
t
Uab
O
a
bc
d
纸带 打点计时器
图甲 图乙
7.72 8.40 9.06 9.72 10.37 11.05
P cm
μAμA
R0
R
S
P
7
(3)在实验过程中步骤如下:先将滑动变阻器 R 的滑片 P 移到最右端,调整电阻箱 R0 的阻值为零,
合上开关 S,再将滑片 P 缓慢左移,使微安表上电流满偏;固定滑片 P 不动,调整 R0 的阻值,使微安
表上读数正好是满刻度的3
4
,记下此时 R0 的电阻为 320Ω,则微安表内阻的测量值为 Ω,
测量值比真实值 (选填“偏大”、“偏小”或“相等”)。
24.(12 分)
如图所示,质量不同、电荷量均为 q 的正离子先后从 A 孔飘入电压为 U1 的加速电场,然后射入板间距
离为 d 的平行板电容器中,电容器两极板间有垂直纸面向外、磁感应强度大小为 B 的匀强磁场。通过调节
电容器的电压使先后进入的不同离子都沿直线穿过,并垂直于 MQ 边界进入1
4
圆形区域 QMN 内的匀强磁场
中,该区域磁场方向垂直纸面向里,磁感应强度大小未知,不计离子
的重力。
(1)求质量为 m 的离子穿过电容器时,电容器两极板间的电压 U2;
(2)若质量为 4m 的离子垂直 MN 边界射出磁场,求从 M 点射出磁
场的离子质量 m′。
25.(20 分)
如图所示,质量为 M =8kg 的木板静置于足够大的水平地面上,木板与地面间的动摩擦因数μ = 0.05,
板上最左端停放着质量 m = 2kg、可视为质点的电动小车,车与木板的挡板相距 L = 10m。启动电源,车由
静止开始向右做匀加速运动,经时间 t = 2s,车与挡板相碰,碰撞时间极短且碰后电动机的电源切断,车与
挡板粘合在一起运动。取 g = 10m/s2。
(1)电动小车在木板上运动时,木板是否也在地面上运动?请
说明理由。
(2)求碰后木板在水平地上滑动的距离。
26.(15 分)“84”消毒液、医用酒精等能对新冠病毒进行有效消杀。某兴趣小组在实验室自制“84”消毒液。
请回答以下问题:
(1)“84”消毒液消杀新冠病毒的原理是 。
(2)甲同学设计左下图实验装置(夹持装置省略)制取“84”消毒液。
① B 中的试剂是 。
② 干燥管的作用是 。
③ 当 C 中 NaOH 溶液吸收完全后,停止通氯气,检验氯气已过量的方法为 。
Mm
L
M N
Q
A
加速电压
电容器
8
(3)乙同学设计右上图电解装置制取“84”消毒液。
①铁电极作 极。
②该电解制取 NaClO 的总反应的化学方程式为 。
③充分电解后,为检验电解液中是否还残留少量 Cl-,取少量电解后溶液于试管中,滴加 AgNO3 溶
液,试管中产生白色沉淀并有无色气体产生,该气体能使带火星的木条复燃。试管中发生反应的
离子方程式为 。
④取 25.00 mL 电解后溶液,加入过量 KI 与稀硫酸混合溶液,充分反应后加入 2 滴淀粉液,用 0.1000
mol·L-1 Na2S2O3 溶液滴定,消耗 12.00 mL。则该电解液有效氯(以有效氯元素的质量计算)的浓
度为 mg/L。
(已知:2S2O32-+I2=S4O62-+2I-)
(4)与甲同学制法相比,乙同学制法的优点除了有装置与操作简单外还有: 、 (列举两种)。
27.(14 分)从某矿渣(成分为 NiFe2O4、NiO、FeO、 CaO、SiO2 等)中回收 NiSO4 的工艺流程如下:
已知①600℃时发生反应:NiFe2O4 + 4H2SO4= NiSO4 + Fe2(SO4)3 + 4H2O
②Ksp(CaF2)=4.0×10-11
回答下列问题:
(1)将 NiFe2O4 写成氧化物的形式为 ;(NH4)2SO4 的作用是 。
(2)“焙烧”时矿渣中部分 FeO 反应生成 Fe2(SO4)3 的化学方程式为__________。
(3)“浸渣”的成分有 Fe2O3、FeO(OH)、CaSO4 外,还含有_____ (写化学式)。
(4)向“浸出液”中加入 NaF 以除去 Ca2+,当溶液中 c(F-)=2.0×10-3mol·L-1 时,若除钙率为 99%,则原“浸
出液”中 c(Ca2+ )= g·L-1。
(5)“萃取”后,分离得到无机层的操作为 ,用到的主要玻璃仪器是 。
(6)将“浸渣”进一步处理后,利用以下流程可得到高铁酸盐。K2FeO4 是倍受关注的一类新型、高效、无
毒的多功能水处理剂。回答下列问题:
①反应液Ⅰ和 90% Fe(NO3)3 溶液反应的离子方程式为 。
②反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到 K2FeO4 晶体,流程中的碱用 KOH 而不用 NaOH
的原因是 。
9
28.(14 分)羰基硫(COS)主要存在于煤、石油和天然气中,会造成设备腐蚀、环境污染,更危害人体健康。
目前,我国已经实现了在催化剂(γ-Al2O3)、低温条件下的精度脱除 COS,下图为天然气中脱除 COS 反
应流化床示意图:
(1)①已知:H2(g)+COS(g) H2S(g)+CO(g) ΔH1=+6.2kJ·mol-1
H2(g)+CO2(g) H2O(g)+CO(g) ΔH2=+41.2kJ·mol-1
则 COS 精度脱除反应 H2O(g)+COS(g) H2S(g)+CO2(g)的ΔH= kJ·mol-1。
②将 H2O 与 COS 以体积比 1∶2 置于恒温恒容密闭容器中反应,若测得该反应平衡时 H2O 与 COS
的体积比 1∶6,则该温度下,脱除反应的平衡常数 K= (保留两位小数)。
(2)T℃时,以一定流速、不同物质的量的 H2O(g)和 COS(g)通过流化床,测得 COS(g)脱除速率变化关
系如右下图。
已知:COS 脱除反应机理如下,其中吸附在催化剂表
面的物种用*标注。
a.吸附:H2O→H2O*
b.反应:COS+H2O*→CO2+H2S*
c.脱附:H2S*→H2S
①若 COS(g)脱除速率 v=knx(COS)·ny(H2O) (mol·min-1),由图中的数据可算出 x、k 的值:x=____,
k=_____。
②“吸附”步骤为________(填“快反应”或“慢反应”),理由是____________。
③脱除反应的决速步骤为________(填“a”、“b”或“c”)。
④少量氢气可以抑制催化剂积硫(S*)中毒,分析该流化床中可能存在的可逆反应是___________。
(3)工业上常采用右图所示电解装置,将气态废弃物中的硫化氢转化为可利用的
硫。首先通电电解 K4[Fe(CN)6]与 KHCO3 的混合溶液,通电一段时间后,再
向所得溶液通入 H2S 时发生反应的离子方程式为 2[Fe(CN)6]3-+2CO2-
3 +
H2S===2[Fe(CN)6]4 - + 2HCO -
3 + S↓ 。 电 解 过 程 中 阴 极 区 电 极 反 应 式 为
___________。
10
29.(10 分)
冠状病毒是一类包膜病毒,由 RNA 和蛋白质外壳组成核衣壳,在核衣壳外面有包膜包被,在电镜下包
膜上的棘突蛋白呈皇冠状排列,当棘突蛋白与宿主细胞接触时,能帮助冠状病毒进入宿主细胞。下图是该类
病毒侵染宿主细胞的示意图,请据图回答:
(1)冠状病毒进入人体细胞的方式为 ,细胞膜能控制物质进出细胞,但是病毒等有害物质仍能
进入人体细胞,说明 。
(2)核糖体是生产蛋白质的机器,图中 的核糖体参与病毒衣壳蛋白的合成, 的
核糖体参与病毒棘突蛋白的合成。
(3)图中病毒的 RNA 进入细胞后具有多方面的功能,表现在 等方面(至少写出两个功能)。
(4)从病毒的棘突蛋白和宿主细胞间相互识别角度分析,不同的冠状病毒可以感染同一种宿主细胞的原因
可能是 。
30.(9 分)
研究表明,脱落酸(ABA)在干旱、高盐、低温和病虫害等逆境胁迫反应中起到重要作用。10℃条件下,
外施 ABA 对油棕幼苗抗寒生长的影响如图所示。
回答下列问题。
11
(1)ABA 在植物体中的主要合成部位有 (答出两点即可)。
(2)在低温条件下,植物细胞光合作用速率下降,主要原因是 。
(3)分析上图可知:低温条件下,ABA 对油棕幼苗的生长具有 作用,并在一定范围内浓度越
大该作用越强。得到上述结论的依据是:① ;② 。
31.(8 分)
冬泳能增强体质、磨练意志,被越来越多的人所喜爱。冬泳时人体会启动一系列调节机制,维持内环
境的稳态。请回答下列问题:
(1)人体皮肤内的 接受冷水刺激时,产生的兴奋沿反射弧传递到皮肤引起 ,从
而减少散热。
(2)冬泳时人体主要通过 消耗大量的血糖,导致 ,这种信号直接刺激胰岛 A 细
胞分泌增加;同时,冷水刺激产生的兴奋还可以通过位于 的神经中枢作用于胰岛 A 细胞引起激
素分泌增加,使血糖上升。
(3)人体的免疫系统由 组成,长期坚持适度冬泳可促进人体内淋巴细胞数量增加,从而增强
人体免疫系统的 和 等功能。
32.(12 分)
果蝇有 4 对染色体(I~IV 号,其中 I 号为性染色体)。纯合野生型果蝇表现为灰体、长翅、直刚毛。
从该野生型群体中得到了甲、乙、丙三种单基因隐性突变的纯合果蝇,对应关系如表所示。
表现型 表现型特征 基因型 基因所在染色体
甲 黑檀体 体呈乌木色、黑亮 ee Ⅲ
乙 黑体 体呈深黑色 bb Ⅱ
丙 残翅 翅退化,部分残留 gg Ⅱ
注:bbee 表现型为黑体
利用果蝇进行杂交实验,探究其性状的遗传规律。回答下列问题。
(1)若要利用甲、乙、丙来验证自由组合定律,最好应选择 作亲本进行实验,原因是 。
(2)用甲果蝇与乙果蝇杂交,F1 的基因型为 ,F1 雌雄果蝇交配得到的 F2 中果蝇体色性状表现
型及比例为 。
(3)果蝇的直刚毛和焦刚毛是由一对等位基因控制,现有纯合的直刚毛和焦刚毛果蝇若干,欲通过一代杂
交试验确定这对等位基因是位于常染色体上还是位于 X 染色体上。请说明推导过程(要求:写出实验思路、
预期实验结果、得出结论)。
12
(二)选考题:共 45 分。请考生从 2 道物理题、2 道化学题、2 道生物题中每科任选一题作答。如果多做,
则每科按所做的第一题计分。
33.[物理—选修 3-3](15 分)
(1)(5 分)下列说法正确的是(填正确答案标号。选对 1 个得 2 分,选对 2 个得 4 分,选对 3 个得 5 分。
每选错 1 个扣 3 分,最低得分为 0 分)
A.扩散现象的原因是分子间存在斥力
B.露珠呈球形是由于液体表面张力的作用
C.不可能从单一热源吸收热量,使之完全变成功,而不产生其他影响
D.与热现象有关的自发过程总是向着分子热运动无序性增大的方向进行的
E.影响蒸发快慢以及影响人们对干爽与潮湿感受的因素是空气中水蒸气的绝对数量
(2)(10 分)一定质量的理想气体被一薄活塞封闭在导热性能良好的汽缸内。活塞的质量 m=20kg、面积
S=200cm2,活塞可沿汽缸壁无摩擦滑动且不漏气,开始时汽缸水平放置,如图甲所示,活塞与汽缸底
的距离 L1=22cm,离汽缸口的距离 L0=4cm。外界气温为 27℃,大气压强为 1.0×l05Pa,将汽缸缓慢地
转到开口向上的竖直位罝,待稳定后如图乙所示,然后对缸内气体缓慢加热,使活塞上表面刚好与汽
缸口相平,如图丙所示,g 取 10m/s2。
(i)求图乙状态下活塞与汽缸底部的距离 L2;
(ii) 在对缸内气体加热的过程中,气体膨胀对外做功,气体
增加的内能ΔU=368J,求该过程气体吸收的热量 Q。
34.[物理——选修 3-4](15 分)
(1)(5 分)如图所示,由单色光①、②组成的一束细光束投射在屏幕上的 P 点,当把三棱镜 ABC 放在它
的传播方向上,且光束与斜面 AB 垂直时,屏幕上出现两个光斑,单色光①的光斑位置较高,单色光
②的光斑位置较低,则下列说法正确的是(填正确答案标号。选对 1 个得 2 分,选对 2 个得 4 分,选
对 3 个得 5 分。每选错 1 个扣 3 分,最低得分为 0 分)
A.两个光斑均在 P 的上方
B.两个光斑均在 P 的下方
C.在三棱镜中,单色光①的传播速度比较小
D.适当增大光束射到 BC 面的入射角,单色光①在 BC 面的折射光先消失
E.用同一双缝干涉实验装置观察这两色光的干涉条纹时,单色光①的条纹间
距比较大
(2)(10 分)一列简谐横波沿 x 轴正方向传播,频率为 5 Hz,某时刻的波形如下图所示,介质中质点 A 的
平衡位置在 x1=7.5 cm 处,质点 B 的平衡位置在 x2=16 cm 处,从图示对应的时刻算起
(i)判断 A、B 两质点,谁先回到平衡位置,并求出它们先后回到平衡位置的时间差;
(ii)求出质点 A 的振动方程。
L1 L0
甲
L2
乙 丙
B
5 10 15
20 x/cm
y/cm
-5 O 16
A
7.5
10
-10
A
B
C
P
13
35.【化学一物质结构与性质】(15 分)
Cu、Zn 及其化合物在生产、生活中有着重要作用。
(1)Cu、Zn 在周期表中________区,焰色反应时 Cu 的 4s 电子会跃迁至 4p 轨道,写出 Cu 的激发态电
子排布式__________。
(2)分别向 CuSO4、MgSO4 溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3 与 Cu2+形成配合物的能力大于 Mg2+的原因是____________。
②溶液中的水存在 H3O+、H5O2+等微粒形式,H5O2+可看作是 H3O+与 H2O 通过氢键形成的离子,则
H5O2+的结构式是_________。
(3)Zn 的某种化合物 M 是很好的补锌剂,结构式如右图:
①1molM 含有的σ键的数目为________。
②常见含 N 的配体有 H2NCH2COO-、NH3、N3
-等,NH3 的分子空间构型为________
N3
-的中心 N 原子杂化方式为________。
③M 在人体内吸收率高的原因可能是锌形成螯合物后,电荷__________(填“变多” “变少” 或“不变”),
可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如下表:
卤化锌/ZnX2 ZnF2 ZnCl2 ZnBr2 ZnI2
熔点/℃ 872 283 394 445
则 ZnX2 熔点如表变化的原因是____________。
(5)Zn 的某种硫化物的晶胞如右下图所示。已知晶体密度为 d g•cm-3,且 S2-、
Zn2+相切,则 Zn2+与 S2+的核间距为_______nm(写计算表达式)。
36.【化学——选修 5:有机化学基础】(15 分)
那可丁是一种药物,为支气管解痉性镇咳药,能解除支气管平滑肌痉挛,抑制肺牵张反射引起的咳嗽,
化合物 H 是制备该药物的重要中间体,合成路线如下:
14
已知:a. , b. RNH2 RNHCH3
(1)反应①的条件为__________。
(2)反应②的反应类型为____________。
(3)化合物 G 的结构简式为________。
(4)下列说法正确的是___________。
a.物质 D 能与 FeCl3 发生显色反应 b.物质 F 具有碱性
c.物质 G 能和银氨溶液发生反应 d.物质 H 的分子式是 C12H15NO4
(5)写出 C→D 的化学方程式:___________。
(6)满足下列条件,化合物 A 所有同分异构体有__________种(不包括 A)。
①可以与活波金属反应生成氢气,但不与 NaHCO3 溶液反应;
②分子中含有 结构;
③含有苯环,且有两个取代基。
(7)已知 ,请以 、CH3CHClCH3 为原料合成化合物
,写出制备的合成路线流程图(无机试剂任选)
________________________________________________________
37.【生物——选修 1:生物技术实践】(15 分)
长期使用有机农药 X 会污染环境。欲获得能够降解 X 的细菌,请回答下列问题:
(1)培养细菌更适合使用 (填“牛肉膏蛋白胨”“马铃薯”或“MS”)培养基,选择培养时需
加入 X 的目的是 。
(2)在以 X 作为唯一碳源的培养基中生长的细菌不一定能降解 X,其原因是 。
(3)图中纯化培养所使用的接种方法是 ,纯化培养与选择培养所使用的培养基的区别
是 。
(4)在进行生化鉴定实验前需将纯化的菌种分别接种到试管的 培养基,进行临时保藏。接种
完后接种工具需进行 处理。
15
38.【生物——选修 3:现代生物科技专题】(15 分)
如图为 PCR 技术流程图,①②③步骤组成一轮循环(即一次复制),请回答下列问题:
(1)PCR 技术的原理是 ,该反应体系的主要成分应该包含扩增缓冲液、 、 、
Taq 酶、引物等。
(2)图中②须进行 处理,其目的是 。
(3)设计引物时,引物自身不能存在互补配对序列,以避免 。
(4)当引物越短,PCR 扩增出来的非目标 DNA 就越多,其原因是 。
泉州市 2020 届普通高中毕业班适应性线上测试
理科综合能力测试生物学科参考答案
1-6:B D C C C D
29.(共 10 分)
(1)胞吞(1 分) 细胞膜的控制作用是相对的(1 分)
(2)游离分布在细胞质中(游离型)(2 分) 附着在内质网上(附着型/结合型)(2
分)
(3)翻译的模板、RNA 自我复制的模板、病毒的组成成分(2 分,写对一个 1 分)
(4)不同冠状病毒的棘突蛋白结构能被同一种宿主细胞表面的受体识别(或:同一种宿主
细胞表面存在着不同的受体,可以识别不同的冠状病毒的棘突蛋白)(2 分)
30.(共 9 分)
(1)根冠、萎蔫的叶片(2 分)
(2)低温会降低(抑制)光合作用过程中相关酶的活性,导致光合作用速率下降(2 分)
(3)提高(促进)(1 分)
①外施 ABA 比对照组(不施用 ABA)油棕幼苗株高生长量和全株干质量高(2 分)
②在一定范围内,施用 ABA 的浓度越大,油棕幼苗株高生长量和全株干质量越高(2 分)
31.(每空 1 分,共 8 分)
(1)温度感受器(冷觉感受器) 皮肤血管收缩和汗腺分泌减少
(2)细胞呼吸(有机物氧化分解或有氧呼吸) 血糖含量下降 下丘脑
(3)免疫器官、免疫细胞、免疫活性物质 防卫 监控清除
32.(共 12 分)
(1)甲和丙(2 分) 两对等位基因位于两对同源染色体上,能进行自由组合(1 分),且
性状表现易于区分(1 分)
(2)EeBb(2 分) 灰体:黑檀体:黑体 = 9:3:4(2 分,全对得分)
(3)取直刚毛雌雄果蝇与焦刚毛雌雄果蝇,进行正交和反交(即直刚毛×焦刚毛,非直毛
×焦刚毛),观察子代表现性状(2 分)。若正、反交后代性状表现一致,则该等位基位于常
染色体上(1 分);若正、反交后代性状表现不一致,则该等位基因位于 X 染色体上(1 分)。
37.(除说明外,每空 2 分,共 15 分)
(1)牛肉膏蛋白胨 (富含 X 的环境能够)提高降解 X 的细菌含量
(2)培养基中生长的可能是自养型细菌,可能以空气中二氧化碳为碳源(3 分)
(3)平板划线法 纯化培养使用固体培养基(或纯化培养基中加入了琼脂)
(4)固体斜面 (灼烧)灭菌
38.(除说明外,每空 2 分,共 15 分)
(1)DNA 双链复制 模板 DNA dNTP(四种脱氧核苷酸或脱氧核糖核苷三磷酸)
(2)降低温度(低温不得分) 引物与 DNA 单链相应互补序列结合
(3)引物自身通过折叠形成双链区
(4)引物越短,在模板 DNA 上的结合特异性越差,就容易与模板 DNA 中非目的基因位点结
合而扩增(或在扩增时引物越短与模板 DNA 错配现象越多)(3 分)
泉州市 2020 届高三适应性线上测试化学试题解析及参考答案
可能用到的原子量 C 12 F 19 P 31 K 39
7.下列有关化学与生活的说法错误的是
A.用可溶性的铝盐和铁盐对水进行杀菌消毒
B.用石灰、碳酸钠等碱性物质处理废水中的酸
C.牛奶、鸡蛋清均可用于重金属中毒解毒 D.碘酒、双氧水均可用于伤口消毒
答案 A
解析:考查生活中的化学常识。铝盐和铁盐,如明矾(KAl(SO4)2·12H2O)、FeCl3 等均
可以利用其水解产生的胶体粒子吸附水中悬浮杂质进行净水,但不能起到杀菌消毒的作用。
8.香茅醛 Y 主要用于食用香精,也用作其他香
料的原料,在一定条件下可分别转化为 X、Z。下
列叙述错误的是
A.Y 的分子式为 C10H18O
B.X 能与 Z 发生取代反应
C.可用新制 Cu(OH)2 鉴别出 X、Y、Z
D.X、Y、Z 均存在对应的芳香族同分异构体
答案 D
解析:考查有机物键线式、结构简式、分子式,官能团的性质,反应的类型,同分异构
体的判断等。X、Y、Z 的分子式分别为 C10H20O、C10H18O、C10H18O2,A 正确。X、Y 分
子中所含的-OH 和-COOH 能发生酯化反应(取代反应),B 正确。Z 分子中含有-COOH,
能与 Cu(OH)2 发生中和反应,而使得新制 Cu(OH)2 变澄清;Y 分子中含有-CHO,在加热下
能产生砖红色沉淀;C 正确。芳香族化合物分子中含有苯环,不饱和度大于等于 4(即对比
饱和碳原子,至少缺少 8 个以上氢原子,分子中 H 在 14 个以下;D 错误。
9.下列实验装置进行的相应实验,不能达到实验目的的是
图 1 图 2 图 3 图 4
A.图 1 装置:吸收少量 Cl2
B.图 2 装置:从 KI 和 I2 的固体混合物中回收 I2
C.图 3 装置:制取少量 CO2 气体
D.图 4 装置:分离 CCl4 萃取碘水后的有机层和水层
答案 B
解析:考查实验基础知识,仪器的用法,物质的分离提纯方法等。
2FeCl2+Cl2=2FeCl3,且气体的流向为“长进短出”,A 正确;蒸发皿用以少量固
体的加热(可直接加热),利用 I2 易升华的性质,可以从 KI 和 I2 的固体混合物中分离出
I2,但由于是敞口体系,不能达到回收的目的;B 错误。
10.短周期主族元素 X、Y、Z 和 W 的原子序数依次增大,X、Y、W 位于不同周期,Y、Z、
W 的原子最外层电子数之和为 14,Z 的原子半径在短周期主族元素中最大。下列说法
错误的是
A.简单离子半径:W>Z>X
B.W 的最高价氧化物对应的水化物为强酸
C.Y 与 Z 形成的化合物溶于水所得溶液呈碱性
D.与 X 形成的简单化合物的还原性:Y>Z>W
答案 D
解析:考查元素周期表(律)以及元素化合物知识。
由题中信息推知,X、Z 分别为 H、Na,Y、W 有两种组合,分别为 O 和 Cl,或者 F
和 S。简单离子半径 Cl-(或 S2-)>Na+>H+,A 正确,但应注意 O2->F->Na+,原子半径却
为 Na>O>F[规律为,一看电子层数、二看质子数、三看电子数]。W 可以为 Cl 或 S,对应的
最高价氧化物对应的水化物为 HClO4 或 H2SO4,均为强酸,且 HClO4>H2SO4;B 正确。Y
与 Z 形成的化合物可能为 Na2O、Na2O2、NaF,溶于水则为 NaOH 溶液、NaF 溶液,HF 溶
液为弱酸溶液[注:酸性 HI>HBr>HCl>HF],NaF 水解显碱性;C 正确。与 X 形成的简单化
合物可以为 H2O(HF)、NaH、HCl(H2S),还原性应为 NaH>HCl>H2O 或 NaH>H2S>HF;
D 错误。
11.研究发现,3D-SiC@2D-MoS2 异质接面催化剂具有优异的光催化 CO2 用纯水的全还
原性能,有效实现电子/空穴的定向迁移,最终实现 CO2 和 H2O 在相应活性位点发
生氧化还原反应,如图所示。下列叙述错误的是
A.2D-MoS2 是 H2O 氧化的催化剂
B.H+和 e-容易在 SiC@MoS2 催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均
发生还原反应
D.总反应的方程式为 CO2(g)+2H2O(g)
CH4(g)+2O2(g)
答案 B
解析:考查新情景下信息的提取应用能力。
从图中可以看出,H2O 在 2D-MoS2 界面,失去 e-转化为 O2 和 H+,发生氧化反应;
A 正确。从 3D-SiC@2D-MoS2 异质接面微粒的变化(箭头方向),可以判断 H+和 e-并
不是在催化剂间进行反应的,而是迁移后在 3D-SiC 反应参与化学反应的;B 错误。有
机化合物分子中碳原子的化合价可以用平均值计算或从“得氧(或失氢)氧化”判断氧
化还原反应,“HCOOH(+2 价)→HCHO(0 价)→CH3OH(-2 价)”,发生还原反应;C 正确。
从物质守恒可以看出,D 中总反应是正确的,并且也可以分步写出反应的方程式。
12.储量丰富成本低的新型电池系统引起了科学家的广泛关
注。基于 K+能够可逆地嵌入/脱嵌石墨电极,开发了基于
钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极
材料,膨胀石墨(C*y)为负极材料],放电时总反应为:
KxC*y + xC(PF6) = C*y + xK++ xC + xPF6-,如图所示。下
列叙述错误的是
A.放电时,K+在电解质中由 A 极向 B 极迁移并嵌入碳微球中
B.充电时,A 极的电极反应式为 C*y + xK+ + xe- = KxC*y
C.放电时,每转移 0.1 NA 电子时,电解质增重 18.4 g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
答案 A
解析:通过新型电池考查电化学基础知识和信息的获取应用能力。
储量丰富成本低是新型电池研究的方向之一。由于 Li 储量少,其发展受到了诸多限制。
由于 K+半径偏大会导致动力学不稳定,K+能够可逆地嵌入/脱嵌的电极材料较少。膨胀石墨
(C*y)为负极材料可以实现转化:KxC*y C*y + xK+ + xe-,碳微球(C)正极电极反应为
C(PF6) + e- C + PF6-。在充电过程中,K+从电解质嵌入 C*y 中形成化合物 KxC*y,放电
时 K+从 KxC*y 中脱嵌进入电解质中(并没有进入正极);同理,充电时 PF6-从电解质嵌入
C 中形成化合物 C(PF6),放电时 PF6-从 C(PF6)中脱嵌进入电解质中(并没有进入负极);
故 A 错。放电时,K+和 PF6-分别从电极化合物中脱嵌进入电解质中,每转移 0.1 NA 电子时,
脱嵌 0.1mol K+和 PF6-,质量为 18.4g;C 正确。
13.常温下,向 20mL 0.1 mol·L-1 NH4HSO4 溶液中逐滴加入 0.1 mol·L-1 的 NaOH 溶液,溶
液中由水电离出的 c 水(H+)与所加 NaOH 溶液的体积的关系如图所示。下列分析正确的是
A.c 点之前,主要的反应为 NH4++ OH- =NH3·H2O
B.b 点和 d 点对应溶液的 pH 均为 7
C.常温下,Kb(NH3·H2O)=5×10-5.4 mol·L-1
D.d 点溶液中,c(Na+)+c(NH4+)=c(SO42-)
答案 C
解析:在溶液中有 NH4HSO4=NH4++H++SO42-,NH4+发生水解,对水的电离产生一定的促
进作用,但由于溶液中含有 0.1 mol·L-1 的 H+,对 NH4+的水解和水的电离均产生较强的抑
制作用,对水的电离总体体现抑制作用,使得 c 水(H+)≈10-13 mol·L-1。加入 NaOH 溶液后,
理论上直至加入 20mL 时发生反应 H+ + OH- = H2O,即 20mL 时完全反应生成(NH4)2SO4,
溶液的酸性由 NH4+水解产生,c 水(H+)=10-5.3 mol·L-1,对水的电离产生的促进作用最大(c
点)。Kh=c(NH3·H2O)c(OH-)/c(NH4+)=10-5.3×10-5.3/0.05,所以 Kb=Kw/Kh=5×10-5.4 mol·L-1。
图中 b 点处为 NH4+水解的促进作用和 H+的抑制作用相当的点,a→c 过程溶液始终显酸性。
c 点之后才开始发生反应:NH4++ OH- =NH3·H2O,当继续加入 10mL 时,NH4+反应了一半,
溶液中含溶质 NH4+∶NH3·H2O=1∶1,由于 Kb˃Kh,同浓度的 NH3·H2O 的电离大于 NH4+的
水解,对水的电离产生抑制作用,溶液显碱性。图中 d 点所加入 NaOH 溶液的体积应小于
30mL,且在 c→d 过程中,对水电离的影响,NH4+的促进作用逐渐减弱,NH3·H2O 的抑制
作用逐渐增强,溶液由 NH4+水解的酸性逐渐被 NH3·H2O 的碱性消除,于 d 点相互抵消,此
时溶液方呈中性。根据电荷守恒 c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-)且 c(H+)=c(OH-),
即 c(Na+)+c(NH4+)=2c(SO42-)。
10 5.3
10 7
c 水(H+)/(mol·L 1)
20 35 V(NaOH)/mL
此外,加入 30mL 时,n(NH4HSO4)∶n(NaOH)=2∶3,发生反应后(不考虑电离水解),
微粒的比例为 c(Na+)∶c(SO42-)∶c(NH4+)∶c(NH3·H2O)=3∶2∶1∶1,可讨论 e、d 点处离子
浓度大小关系。
26.(15 分)“84”消毒液、医用酒精等能对新冠病毒进行有效消杀。某兴趣小组在实验
室自制“84”消毒液。请回答以下问题:
(1)“84”消毒液消杀新冠病毒的原理是 。
(2)甲同学设计左下图实验装置(夹持装置省略)制取“84”消毒液。
① B 中的试剂是 。
② 干燥管的作用是 。
③ 当 C 中 NaOH 溶液吸收完全后,停止通氯气,检验氯气已过量的方法为 。
(3)乙同学设计右上图电解装置制取“84”消毒液。
①铁电极作 极。
②该电解制取 NaClO 的总反应的化学方程式为 。
③充分电解后,为检验电解液中是否还残留少量 Cl-,取少量电解后溶液于试管中,
滴加 AgNO3 溶液,试管中产生白色沉淀并有无色气体产生,该气体能使带火星的木
条复燃。试管中发生反应的离子方程式为 。
④取 25.00 mL 电解后溶液,加入过量 KI 与稀硫酸混合溶液,充分反应后加入 2 滴淀
粉液,用 0.1000 mol·L-1 Na2S2O3 溶液滴定,消耗 12.00 mL。则该电解液有效氯(以
有效氯元素的质量计算)的浓度为 mg/L。
(已知:2S2O32-+I2=S4O62-+2I-)
(4)与甲同学制法相比,乙同学制法的优点除了有装置与操作简单外还有: 、
(列出两种)。
26 题参考答案及评分细则
26.(15 分)
(1)强氧化性使病毒的蛋白质发生变性,失去生理活性 (2 分)
(强氧化性 1 分,蛋白质变性 1 分)
(2)①饱和食盐水或饱和 NaCl 溶液 (1 分)
② 防倒吸 (1 分)
③ C 装置的导管口放一张湿润的淀粉碘化钾试纸,试纸变蓝 (2 分)
(操作 1 分,现象 1 分。注意“湿润”。其它能在氯气作用下有明显现象的合理试剂也可以)
(3)①阴 (1 分)
②NaCl + H2O NaClO + H2↑ (2 分)
(反应物和生成物书写正确,其它不完整扣 1 分)
③2ClO— + 2Ag+ = 2AgCl↓ +O2 ↑ (2 分)
(同上。写成 2ClO— = 2Cl—+O2 ↑ ,Ag++Cl— = AgCl↓也得分)
④852 (2 分)
(4)原料经济、原料利用率高、不产生污染性气体、有效氯含量高等合理答案
(各 1 分,共 2 分)
26 题解析
26.
(1)病毒、细菌的消杀是其中的蛋白质发生变性,失去生理活性。加热、酒精、紫外线、强
氧化剂等均能使蛋白质发生变性,其中 H2O2、O3、次氯酸及次氯酸盐等具有强氧化性,是
常见的消毒剂。
①浓盐酸易挥发,若不除去,与 C 中 NaOH 反应生成 NaCl,有效氯浓度降低,所以要
用饱和食盐水除去。由于该反应在水溶液中进行,氯气不需要干燥。
③检验氯气,用湿润的淀粉碘化钾试纸,试纸变蓝。操作简便,现象明显。
(3)电解制 NaClO,是电解饱和食盐水制氯气的拓展应用:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,
生成的 Cl2 与 NaOH 溶液反应:Cl2+2NaOH=NaCl+NaClO+H2O。两个反应合并得总反应方
程式:NaCl + H2O NaClO + H2↑。
阳极(图中石墨)生成 Cl2,阴极(图中铁)生成 OH—与 H2,下方生成的 Cl2 在逸出过
程中与上方的 OH—反应:Cl2+2OH—=Cl—+ClO—+H2O,生成的 Cl—再循环参与放电。
①也可从以下角度分析:铁是非惰性金属,若作阳极,比 Cl—更容易放电生成 Fe2+,达
不到制 NaClO 的目的。
③能使能使带火星的木条复燃的无色气体是 O2,电解后溶液中主要含 H2O、Na+和 ClO
—,加硝酸银溶液后会生成气体,肯定不可能是 H2O、Na+,只能是 ClO—发生反应,其中 O
元素升价,根据化合价“有升必有降”,Cl 元素降价生成 Cl—,再与 Ag+反应生成白色沉淀
AgCl,与题中现象吻合。
④根据 ClO—+2I-+2H+ =Cl—+I2+H2O, 2S2O32-+I2=S4O62-+2I-
确定关系 ClO— ~ 2S2O32-
n(ClO—)=0.1000×12.00×10-3×1/2mol=6.0×10-4mol → 有效氯 n(Cl)=6.0×10-4mol
(根据单位 mg/L)浓度:(6.0×10-4×35.5×103mg)÷(0.025L)=852mg/L
(4)与甲同学制法中制取 Cl2,需多种原料:浓盐酸、KMnO4、NaOH 均比食盐水不易获取,
价格高;制得的“84”消毒液中含大量的 NaCl。
27.(14 分)
从某矿渣(成分为 NiFe2O4、NiO、FeO、 CaO、SiO2 等)中回收 NiSO4 的工艺流程如下:
已知①600℃时发生反应:NiFe2O4 + 4H2SO4 = NiSO4 + Fe2(SO4)3 + 4H2O,
② Ksp(CaF2)=4.0×10-11 , 回答下列问题:
(1)将 NiFe2O4 写成氧化物的形式为 ;
(NH4)2SO4 的作用是 。
( 2 ) “ 焙烧” 时 矿 渣 中 部 分 FeO 反 应 生 成 Fe2(SO4)3 的 化 学 方 程 式 为
_______________。
(3)“浸渣”的成分有 Fe2O3、FeO(OH)、CaSO4 外,还含有 _____ (写化学式)。
(4)向 “浸出液”中加入 NaF 以除去溶液中 Ca2+,当溶液中 c(F-)=2.0×10-3mol·L-1 时,
若除钙率为 99%时,则原“浸出液”中 c(Ca2+ )= g·L-1。
(5)“萃取”后分离得到无机层的操作是 ,用到的主要玻璃
仪器是
(6)将“浸渣”进一步处理后,利用以下流程可得到高铁酸盐。K2FeO4 是倍受关注的
一类新型、高效、无毒的多功能水处理剂。回答下列问题:
①反应液Ⅰ和 90% Fe(NO3)3 溶液反应的离子方程式为
②反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到 K2FeO4 晶体,流程中的碱用 KOH 而不
用 NaOH 的原因是
27.【解析】某矿渣的主要成分是 NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2 等,加入硫
酸铵研磨后,600°C 焙烧,据题意知(NH4)2SO4 在 600℃以上会分解生成 NH3 和 H2SO4。
NiFe2O4 在焙烧过程中与硫酸反应生成 NiSO4、Fe2(SO4)3,在 90°C 的热水中浸泡过滤得
到浸出液,加入 NaF 除去钙离子。
(1)多元含氧化合物可以写成氧化物形式,NiFe2O4 写成氧化物的形式为 NiO·Fe2O3,
(NH4)2SO4 的主要作用是提供和矿渣反应的硫酸。
(2)矿渣中部分 FeO 焙烧时与 H2SO4 及空气中的氧气反应生成 Fe2(SO4)3 和水,反应的化
学方程式为 4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O;
(3)矿渣的主要成分是 NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2 等,加入硫酸铵加热
浸取后的浸渣为不反应和不溶于水的硫酸钙和二氧化硅,“浸渣”的成分除 Fe2O3、FeO(OH)、
CaSO4 外,还含有 SiO2;
(4)当溶液中 c(F-)=2.0×10-3mol·L-1 时,
Ksp(CaF2)=c(Ca2+)×c2(F-)=c(Ca2+)×(2.0×10-3mol·L-1)2=4.0×10-11,故 c(Ca2+)=1.0×10-5mol/L,
除钙率=
mol·L-1×40g·mol-1=4.0×10-2g·L -1
(5)萃取后要分离上下层液体进行的操作是分页,故答案为分液、分液漏斗。
(6)①根据题意氢氧化钾和氯气反应获得 KClO 氧化剂,在碱性环境下氧化 Fe3+为高铁酸
盐,故离子反应为 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O。
②高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液。可用氢氧化钾将高铁酸盐从苛性钠溶
液中沉淀出来,制备高铁酸盐固体。
【27 答案】
(1) NiO·Fe2O3 (写 Fe2O3· NiO 不扣分) (1 分)
提供和矿渣反应的硫酸(或硫酸铵分解产生硫酸等答案) (2 分)
(2)4FeO+6H2SO4+O2 = 2Fe2(SO4)3 + 6H2O (2 分)
(3)SiO2 (1 分)
(4)4.0×10-2 (或 0.04) (2 分)
(5)分液 (1 分)
分液漏斗 (填写了玻璃棒等不扣分) (1 分)
(6)①2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O (2 分)
②高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液 (或相同条件下 K2FeO4 的溶解度
小等,有说明溶解度的大小比较就各分) (2 分)
28.(14 分)
羰基硫(COS)主要存在于煤、石油和天然气中,会造成设备腐蚀、环境污染,更危害人
体健康。目前,我国已经实现了在催化剂(γ-Al2O3)、低温条件下的精度脱除 COS,下图为天
然气中脱除 COS 反应流化床示意图:
(1)①已知:H2(g)+COS(g) H2S(g)+CO(g) ΔH1=+6.2kJ·mol-1
H2(g)+CO2(g) H2O(g)+CO(g) ΔH2=+41.2kJ·mol-1
则 COS 精度脱除反应 H2O(g)+COS(g) H2S(g)+CO2(g) 的 ΔH= kJ·mol-1。
②将 H2O 与 COS 以体积比 1:2 置于恒温恒容密闭容器中反应,若测得该反应平衡时
H2O 与 COS 的体积比 1:6,则该温度下,脱除反应的平衡常数 K= (保留两位小
数)。
(2)T℃时,以一定流速、不同物质的量的 H2O(g)和 COS(g)通过流化床,测得 COS(g)脱除
速率变化关系如下图。
已知:COS 脱除反应机理如下,其中吸附在催化剂表面的物种用*标注。
a.吸附:H2O→H2O*
b.反应:COS+H2O*→CO2+H2S*
c.脱附:H2S*→H2S
①若 COS(g)脱除速率 v=knx(COS)·ny(H2O) (mol·min-1),由图中的数据可算出 x、k 的值:x
=______,k=______。
②“吸附”步骤为________(填“快反应”或“慢反应”),理由是
_________________________________。
③脱除反应的决速步骤为________(填“a”、“b”或“c”)。
④少量氢气可以抑制催化剂积硫(S*)中毒,分析该流化床中可能存在的可逆反应是
___________。
(3)工业上常采用下图所示电解装置,将气态废弃物中的硫化氢转化为可利用的硫。首先
通电电解 K4[Fe(CN)6]与 KHCO3 的混合溶液,通电一段时间后,再向所得溶液通入 H2S 时
发生反应的离子方程式为 2[Fe(CN)6]3-+2CO2-
3 +H2S===2[Fe(CN)6]4-+2HCO-
3 +S↓。电解
过程中阴极区电极反应式为___________。
28 【命题意图】
本题以利用天然气中脱除 COS 反应为背景,对化学反应原理的必备知识进行深度考查,
如盖斯定律、化学平衡的移动及三段式平衡计算、化学反应速率影响因素、电解池等核心知
识。能力层面上考查学生独立思考能力、获取信息能力、逻辑推理能力、及对图像观察思考
能力。
【讲评建议】
(1)①由盖斯定律可得 H2O(g)+COS(g) H2S(g)+CO2(g) ΔH=-35.0kJ·mol-1
②已知:H2O 与 COS 以体积比 1:2,根据阿伏伽德罗定律,物质的量之比为 1:2,
利用“三段式”计算,设 n 始(H2O)=1 mol,n 始(COS)=2 mol,则平衡时 n 平(H2O)=a mol,n 平
(COS)=6a mol
H2O(g)+COS(g) H2S(g)+CO2(g)
起始(mol) 1 2 0 0
转化(mol) 1-a 2-6a 1-a 1-a
平衡(mol) a 6a 1-a 1-a
由 1-a=2-6a 可推出 a=0.2mol
带入可得出平衡时 n 平(H2O)=0.2 mol,n 平(COS)=1.2 mol,n 平(H2S)=n 平(CO2)=0.8 mol
K=(0.8×0.8)/(0.2×1.2)≈2.67(由于是等体积的反应,可直接带入 n)
(2)①由图可知:COS(g)水解速率 v 不受 n(H2O)的影响,但与 n(COS)呈现一次函数关系,
则 x=0,y=1,可知 v=kn(COS) (mol·min-1),当 n(COS)=0.15mol 时,v=0.3 mol·min-1,
k=2(min-1);
②根据 COS(g)脱除反应机理可知,脱除反应分为三个步骤,再由速率方程 v=kn(COS)可知
脱除速率与 n(H2O)无关,n(H2O)不影响总反应速率因此吸附:H2O→H2O*步骤是非常快速
完成(快反应)。
③根据 COS(g)脱除速率方程及 COS 脱除反应机理可知,脱除反应速率与 COS(g)有关,可
知反应:COS+H2O*→CO2+H2S*步骤是比较三个步骤中最慢的,因此决速步骤为 b。
④在 COS 脱除反应中,硫元素是以 H2S(g)形式被脱除,因此在实验过程中少量氢气可以和
催化剂积硫(S*)反应形成 H2S*,从而达到抑制催化剂积硫(S*)中毒的目的,S*+H2 H2S*
(3)对比原装置中试剂及向所得溶液通入 H2S 时发生反应的离子方程式 2[Fe(CN)6]3-+
2CO2-
3 +H2S===2[Fe(CN)6]4-+2HCO-
3 +S↓,可得出在电解过程中阳极区发生电极反应
[Fe(CN)6]4--e-=== [Fe(CN)6]3-,那么阴极区则由 HCO-
3 转变为 CO2-
3 ,也可理解为阴极区
参与放电的为 2H2O+2e-=== H2↑+2OH-,再把 2OH-+2HCO-
3 ===2CO2-
3 +2H2O 两个反应
加起来可得出 2HCO-
3 +2e-=== H2↑+2CO2-
3 。
28.(14 分)
(1)①-35.0 (2 分)
②2.67 (2 分)
(2)1;2 ( 各 1 分 , 2 分)
(3)①快反应 ( 1 分)
由于 H2O(g)的物质的量不影响总反应速率,因此“吸附”步骤是快反应 ( 1 分)
②b (2 分)
③S*+H2 H2S*(没有注明*扣 1 分) (2 分)
(4)2HCO-
3 +2e-=== H2↑+2CO2-
3 ( 2 分)
∆
35.【化学一物质结构与性质】(15 分)
Cu、Zn 及其化合物在生产、生活中有着重要作用。
(1)Cu、Zn 在周期表中________区,焰色反应时 Cu 的 4s 电子会跃迁至 4p 轨道,写出
Cu 的激发态电子排布式__________。
(2)分别向 CuSO4、MgSO4 溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3 与 Cu2+形成配合物的能力大于 Mg2+的原因是____________。
②溶液中的水存在 H3O+、H5O2+等微粒形式,H5O2+可看作是 H3O+与 H2O 通过氢键形
成的离子,则 H5O2+的结构式是_________。
(3)Zn 的某种化合物 M 是很好的补锌剂,结构式如右图:
①1molM 含有的 σ 键的数目为________。
②常见含 N 的配体有 H2NCH2COO-、NH3、N3
-等,NH3 的分子
空间构型为________,N3
-的中心 N 原子杂化方式为________。
③M 在人体内吸收率高的原因可能是锌形成螯合物后,电荷__________(填“变多” “变
少” 或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如下表:
卤化锌/ZnX2 ZnF2 ZnCl2 ZnBr2 ZnI2
熔点/℃ 872 283 394 445
则 ZnX2 熔点如表变化的原因是____________。
(5)Zn 的某种硫化物的晶胞如右下图所示。已知晶体密度为
d g•cm-3,且 S2-、Zn2+相切,则 Zn2+与 S2+的核间距为
__________nm(写计算表达式)。
35 题评分细则
(1)ds [Ar]3d104p1 或 1s22s22p63s23p63d104p1 (各 1 分,共 2 分)
(2)
①由于 Cu2+对配体 NH3 的孤电子对吸引力大(或电子云重叠大),配位键强。(或由于姜
泰勒效应(畸变效应) 铜离子形成配位键能获得额外稳定能,形成的配位键更稳定;或路易
斯软硬酸碱理论,铜离子是软酸,氨分子是软碱。以上竞赛学生可能回答) 只写半径大不
得分。 (2 分)
② (2分) (氢键符号错,H2O的H形成氢键不得分)
(3)
①20NA (2 分)
②三角锥型(形) sp 杂化 (各 1 分,共 2 分)
③ 变少 (1 分)
(4)ZnF2 属于离子晶体,ZnCl2、 ZnBr2、 ZnI2 属于分子晶体;ZnCl2、 ZnBr2、 ZnI2 相对分
子质量依次增大,范德华力也依次增大 (2 点各 1 分,共 2 分)
(5)√ퟑ
ퟒ × √ퟑퟖퟖ
풅푵푨
ퟑ × ퟏퟎퟕ (2 分) (其他合理写法也给分)
35 题解析
(1)ds [Ar]3d104p1 (各 1 分)
解析:4s 电子激发到 4p,且只有一个电子。
(2)
①由于 Cu2+对配体 NH3 的孤电子对吸引力大(或电子云重叠大),配位键强。(或由于姜
泰勒效应(畸变效应) 铜离子形成配位键能获得额外稳定能,形成的配位键更稳定;或路易
斯软硬酸碱理论,铜离子是软酸,氨分子是软碱。以上竞赛学生可能回答)(2 分)
解析:人教版“科学视野”有叙述:许多过渡金属离子对配体具有很强的结合力,因而过渡
金属配合物远比主族金属配合物稳定。考过的 NH3 比 H2O 更易形成配位键是从给出孤电子
对能力考虑,因此本题应联想到从吸引孤电子对的能力回答。其本质姜泰勒效应(畸变效应)
或路易斯软硬酸碱理论属于拓展视野。
② (2 分)
解析:氢键连接,所以中间的符号表示要准确,H3O+更易提供 H 与 H2O 的 O 形成氢键,考
虑 H 的正电性和 O 的空间位阻。
(3)
①20NA (2 分)
解析:碳原子上连结的 H 原子要补完整,否则易错误为 16NA。
②三角锥型(形) sp 杂化(各 1 分)
解析:可用公式计算,注意 N 做配位原子(-1);或者利用其与 CO2 是等电子体,杂化方
式与 C 相同。
③ 变少 (1 分)
解析:氨基酸锌的生物利用率高,其原因可能是 Zn2+与 H2NCH2COO-形成螯合物后,分子
内电荷趋于中性,可在消化道内维持良好的稳定性,受其它无机离子或拮抗物的影响较小,
不易与其他物质结合形成不溶性化合物或被吸附于不溶性胶体上。
(4)ZnF2 属于离子晶体,ZnCl2、 ZnBr2、 ZnI2 属于分子晶体;ZnCl2、 ZnBr2、 ZnI2 相对分
子质量依次增大,范德华力也依次增大(2 点各 1 分,共 2 分)
(5)√ퟑ
ퟒ × √ퟑퟖퟖ
풅푵푨
ퟑ × ퟏퟎퟕ (2 分)
解析:体对角线的体心、正四面体空隙原子补完整,则为 Zn2+与 S2-的核间距的 4 倍。由密
度算出晶胞参数,再算出体对角线,得到答案。
36.【化学——选修 5:有机化学基础】 (15 分)
那可丁是一种药物,为支气管解痉性镇咳药,能解除支气管平滑肌痉挛,抑制肺牵张反
射引起的咳嗽,化合物 H 是制备该药物的重要中间体,合成路线如下:
已知:a. , b. RNH2 RNHCH3
(1)反应①的条件为__________。
(2)反应②的反应类型为____________。
(3)化合物 G 的结构简式为________。
(4)下列说法正确的是___________。
a.物质 D 能与 FeCl3 发生显色反应 b.物质 F 具有碱性
c.物质 G 能和银氨溶液发生反应 d.物质 H 的分子式是 C12H15NO4
(5)写出 C→D 的化学方程式:___________。
(6)满足下列条件,化合物 A 所有同分异构体有__________种(不包括 A)。
①可以与活波金属反应生成氢气,但不与 NaHCO3 溶液反应;
②分子中含有 结构;
③含有苯环,且有两个取代基。
(7)已知 ,请以 、CH3CHClCH3 为原料合
成化合物 ,写出制备的合成路线流程图(无机试剂任选)
__________________________________________________________________
36.[化学——选修 5:有机化学基础] 参考答案(15 分)
(1)H+或酸化 (2 分)
(2)取代反应 (2 分)
(3) (2 分)
(4)BD (各 1 分,共 2 分)
(5) 或
(2 分)
(6)12 (2 分)
(6)
(3 分)
【解析】
(1)A 含有酚羟基和醛基和醚键,酚羟基能与溴发生反应,在酚羟基的邻位发生取代
反应,故 B 的结构为 ,B 再氢氧化钠溶液的条件下,卤原子发生水解反应生
成酚羟基,进一步反应生成钠盐,再结合 D 的结构可知 C 的结构为 ,因此①
的条件是把钠盐转化成酚羟基,所以①的条件:H+或酸化;
(2)结合已知条件 b 和②的反应试剂 CH3I,可得反应②的反应类型为取代反应;
(3)结合已知条件 b 和②的反应试剂 CH3I,可得 G 的结构为
(4)含有酚羟基的物质能与 FeCl3 发生显色反应,而物质 D 不含酚羟基,A 错误;物
质 F 含有氨基,具有碱性,B 正确;物质 G 不含醛基,不能和银氨溶液发生反应,C 错误;
物质 H 的分子式是 C12H15NO4,D 正确,故选 BD。
(5)根据上述分析可知 C 的结构为 ,结合已知条件 a 分析,C→D 的化
学方程式为
或
(6)A 的分子式是 C8H8O3,含有 结构,且可以与活波金属反应生成氢气,
但不与 NaHCO3 溶液反应,说明含有羟基和酯基;含有苯环,且有两个取代基,结构可能如
下,共 12 种:
、 、 、 、 、
、 、 、 、 、
、 ;
(7)合成 ,逆推方法,需要合成 CH2ClCHClCH2Cl,逆推需要合
成 CH2=CHCH2Cl,再需要合成 CH2=CHCH3,由 CH3CHClCH3 发生消去反应即可,故合
成路线为:
1
泉州市 2020 届高三毕业班适应性线上测试参考答案
物理试题部分
一、选择题:本题共 8 小题,每小题 6 分。在每小题给出的四个选项中,第 14~18 题只有一项符合题
目要求,第 19~21 题有多项符合题目要求。全部选对的得 6 分,选对但不全的得 3 分,有选错的得 0
分。
14.A 15.D 16. C 17.D 18.C 19.BD 20.ABC 21.BD
二、非选择题:包括必考题和选考题两部分。第 22 题~第 25 题为必考题,每个试题考生都必须作答。
第 33 题~第 34 题为选考题,考生根据要求作答。
(一)必考题(共 47 分)
22.(6 分)(1)4.14 (4.12—4.16)(2 分) 2.59(2.59—2.61)(2 分)
(2) Mg-(M+m)a
mg
(2 分)
23.(9 分)(1)R1(或 C)(2 分) (2)如图 (3 分)
(3)960(2 分) 偏大 (2 分)
24.(12 分)解:(1)设离子经加速电场加速后获得的速度为 v,由动能定理得
qU1=1
2mv2 ①(2 分)
离子进入电容器后沿直线运动,有qU2
d
=Bqv ②(2 分)
得 U2=Bd 2qU1
m
③(1 分)
(2) 设 QMN 区域磁场的磁感应强度大小为 B1,离子做匀速圆周运动的速度大小为 v,半径为 R,由洛伦
兹力提供向心力得
B1qv=mv2
R
④(2 分)
得离子的运动半径 R= 2U1m
B12q
⑤(1 分)
质量为 4m 的离子在磁场中运动打在 MN 的中点处,设运动半径为 R1
则 R1= 8U1m
B12q
⑥(2 分)
设打在 M 点的离子质量为 m1,其半径 R2=1
2R1 ⑦(1 分)
又 R2= 2U1m1
B12q
解得 m1=m ⑧(1 分)
μA
2
25.(20 分)解:(1)设木板不动,电动车在板上运动的加速度为 a0。
由 L =
1
2a0t2 ①(2 分)
得 a0 = 5m/s2
此时木板使车向右运动的摩擦力 f 0= ma0 = 10N ②(1 分)
木板受车向左的反作用力 f0′ = f 0 = 10N
木板受地面向右最大静摩擦力 fm= μ (M + m)g = 5N ③(1 分)
f0′ > fm 所以木板不可能静止,将向左运动 ④(1 分)
(2)设电动车向右运动加速度为 a1,木板向左运动加速度为 a2;木板使车向右运动的摩擦力为 f,木
板受车向左的反作用力为 f′;碰前电动车速度为υ1,木板速度为υ2,碰后共同速度为υ;两者一起向右运
动 s 而停止,则
1
2a1t2 +
1
2a2t2 = L ⑤(3 分)
对木板 f′– μ (m + M )g = Ma2 ⑥(2 分)
对电动车 f= f′= m a1, ⑦(1 分)
而 υ1 = a1t ⑧(1 分)
υ2 = a2t ⑨(1 分)
两者相碰时动量守恒,以向右为正方向,有
mυ1 - Mυ2 = (m + M )υ, ⑩(3 分)
由动能定理得 - μ (m + M )gs = 0 -
1
2(m + M )υ2 ⑪(3 分)
代人数据,解得 s = 1m ⑫(1 分)
33.[物理—选修 3-3](15 分)
(1)(5 分)BCD
(2)(10 分)(i)当气缸水平放置时(如图甲)
p1= p0=1.0×105pa,V1=L1S
当汽缸口向上(如图乙)
p2= p0+ mg
S =1.1×105pa ①(2 分)
V2=L2S
由玻意耳定律 p1V1= p2V2 ②(2 分)
则 L2=20cm ③(1 分)
(ii)加热后气体做等压变化,设外界对气体做功为 W,则
W=-p2S(L1+ L0-L2) ④(2 分)
解得 W=-132J
由热力学第一定律得△U=W+Q ⑤(2 分)
解得 Q=500J ⑥(1 分)
3
34.[物理——选修 3-4](15 分)
(1)(5 分)ACD
(2)(10 分)
解:(i) B 先回到平衡位置, ①(1 分)
波长为λ = 0.2m ②(1 分)
波速为 v = λf = 1m/s ③(1 分)
t1= x1
v=7.5×10-2 s ④(1 分)
t2=
x2-λ
2
v
=6.0×10-2 s ⑤(1 分)
Δt=t1-t2=1.5×10-2 s ⑥(1 分)
(ii) 质点 A 的振动方程为 y = Asin(ωt+φ)
A = 10cm
ω = 2πf = 10π rad/s ⑦(1 分)
由(i)可知,质点 A 在 t1=7.5×10-2 s 时,位移 y1=0
代入振动方程中可得
φ = -3π
4
⑧(1 分)
所以,质点 A 的振动方程为 y = 10sin(10πt-3π
4 ) cm ⑨(2 分)
相关文档
- 河南省鲁山县第一高级中学2019-2022021-06-166页
- 甘肃省庆阳市宁县第二中学2019-2022021-06-1614页
- 辽宁师大附中2021届高三数学上学开2021-06-1611页
- 安徽省六安市第一中学2020届高三下2021-06-1625页
- 2014年天津市高考数学试卷(文科)2021-06-1624页
- 【数学】安徽省阜阳市颍上第二中学2021-06-1611页
- 2009年湖北省高考数学试卷(文科)【wo2021-06-166页
- 2020年全国统一高考数学试卷(文科)(新2021-06-167页
- 2015泉州质检3月份理数试卷2021-06-1623页
- 2019-2020学年山东省济南市历城二2021-06-166页