- 130.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
3.2 几种重要的金属化合物①
课型设置:新授课;
学习目标:回顾金属的通性;了解金属的化学性质与原子结构之间的关联;掌握金属与非金属的反应,金属与水的反应。
学习重点:Na2O2的化学性质 钠的碳酸盐的性质
学习难点:Na2O2的化学性质
学习内容(包括学法指导)
一、钠的重要化合物
1、氧化物
Na2O
Na2O2
____色固体
____色固体
_____性氧化物
与水反应的化学方程式
(a)________________________________________
与CO2反应的化学方程式
(b)_______________________________________
是否是碱性氧化物? _____
与水反应的化学方程式
(c)_______________________________________
与CO2反应的化学方程式
(d)_______________________________________
*在(c)、(d)中标出转移电子方向和数目;
*(c)、(d)反应均为_______热反应。
Na2O中,阴、阳离子个数比为1:2,每个原子最外层均达到稳定结构,电子式为:
________________
Na2O2中,阴、阳离子个数比也是1:2,每个原子最外层均达到稳定结构,电子式为:
____________
其阴离子的化学式为__________,
名称为________________。
Na2O转化为Na2O2的化学方程式为_____________________________________________________,
这表明两种氧化物中,相对稳定的是____________________。
写出Na2O2与稀盐酸反应的化学方程式___________________________________________。
保存Na2O2时,应注意密封以隔绝____________和______________。
若向盛有Na2O2粉末的试管中滴几滴酚酞试液,先出现红色(因为________________________)且有气体产生,后红色又褪去(红色酚酞是一种有机色质,因Na2O2具有_______性将其氧化为无色物质,发生褪色)。
2、碳酸盐
Na2CO3
NaHCO3
属于碳酸_____盐,
白色粉末,易溶于水(溶解度比NaHCO3更______)
属于碳酸_____盐,
白色晶体,易溶于水
向装有Na2CO3粉末的试管中滴几滴水,触摸试管底部,有________现象。
Na2CO3粉末遇水生成Na2CO3晶体(一般可以简单地认为是_______________________),该晶体在干燥的空气中逐渐失去________变为Na2CO3粉末。
向分别装有等质量Na2CO3、NaHCO3的2支试管中,滴加相同浓度的稀盐酸,产生气体更快,反应更剧烈的是________。
反应的离子方程式分别为:
(a)__________________________________ (b)_______________________________________
若将(a)处理为两步进行,离子方程式为:
(a)①___________________________________(a)②___________________________________。
*此实验可用于鉴别_____态的Na2CO3、NaHCO3
分别对Na2CO3、NaHCO3的2支试管进行加热,产生能使澄清石灰水变浑浊气体(CO2)的,是________。
产生气体的反应方程式为_____________________________________。
*此实验可用于鉴别_____态的Na2CO3、NaHCO3
若分别向Na2CO3、NaHCO3溶液中,分别滴几滴稀CaCl2溶液,出现白色沉淀的是__________,离子方程式为___________________________________________。
*此实验可用于鉴别Na2CO3、NaHCO3的_______
注意,若分别滴几滴Ca(OH)2溶液,则无法鉴别Na2CO3、NaHCO3溶液,原因是_______________。
若分别向Na2CO3、NaHCO3溶液中,滴几滴酚酞试液,溶液均显_____色,红色更深的是________。
*此实验可用于鉴别Na2CO3、NaHCO3的_______(但应控制两者的_______相同)
虽然都属于____________类,但它们的溶液都显_________性,都可以作为食用碱。
除去Na2CO3固体中的NaHCO3杂质,方法是_________________________________。
除去NaHCO3溶液中的Na2CO3杂质,方法是__________________________________________,反应的化学方程式为__________________________________________________。
不用其它任何试剂,用相互滴加的方法即可鉴别稀盐酸和NaHCO3溶液。
若立即产生气体
将____________逐渐滴加到____________________中
若起初无现象,一段时间后产生气体
将____________逐渐滴加到____________________中
4
3.2 几种重要的金属化合物②
课型设置:新授课;
学习目标:进一步认识Na2O2与H2O反应、与CO2反应的原理;学会处理Na2O2固体少量、过量不同情况下反应的计算技巧。
学习重点:Na2O2与H2O反应、与CO2反应的计算问题
学习难点:Na2O2与H2O反应、与CO2反应的计算问题
导·学·展·评·馈
学习内容(包括学法指导)
一、关于Na2O2固体的计算问题
1、(1)Na2O2与H2O反应的化学方程式为___________________________________。
18gH2O与足量的Na2O2固体充分反应后,固体增重______g。从形式上看,固体质量的增加相当于“H2O”中的 “_______”。
Na2O2与CO2反应的化学方程式为___________________________________。
44g CO2与足量的Na2O2固体充分反应后,固体增重______g。从形式上看,固体质量的增加相当于“CO2”中的 “_______”。
(2)2gH2充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。
28gCO充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。
从形式上看,O2相当于运载工具,不断地向Na2O2固体中输送形式上的“_________”、“________”
(3)A g H2和CO充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。
B g C6H12O6充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。
16 g CH4充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。
2、(1)若将1mol水蒸气、1mol CO2的混合气体,通入盛有1molNa2O2固体的密闭容器中充分反应,最终容器内各组分及其物质的量为_____________________________________________________。
析:假设水蒸气先与1molNa2O2反应,会得到_______molNaOH和__________,生成的NaOH还可以再与________反应。所以,处理水蒸气、CO2的混合气体与一定量Na2O2固体反应的计算问题时,视为__________与Na2O2固体反应,若Na2O2固体有剩余,剩余Na2O2再与_______反应。
(2)若将1mol水蒸气、1mol CO2的混合气体,通入盛有1.5molNa2O2固体的密闭容器中充分反应,最终容器内各组分及其物质的量为_____________________________________________________。
3、(1) 1molNa2O2固体和2mol NaHCO3固体置于密闭容器中加热并充分反应,反应后,容器内固体成分及物质的量为______________________________________________________________。
(2) 1molNa2O2固体和1mol NaHCO3固体置于密闭容器中加热并充分反应,反应后,容器内固体成分及物质的量为______________________________________________________________。
(3) 1molNa2O2固体和3mol NaHCO3固体置于密闭容器中加热并充分反应,反应后,容器内固体成分及物质的量为______________________________________________________________。
二、焰色反应
焰色反应是某些金属的单质或者______________(无论是固体还是溶液)在灼烧时,火焰所呈现的特殊颜色。一般认为,焰色反应中发生的变化为_______变化。
常用焰色反应检验_________元素的种类。钠元素的焰色为______色;钾元素的焰色为______色;铜元素的焰色为______色。
焰色反应使用的金属丝宜使用______(或用光亮洁净的铁丝替代),通常要求金属丝熔点较_____,本身无焰色,抗氧化性强。
观察钾元素的焰色时,需要透过______________观察。
焰色反应的步骤:
①酸洗(通常使用_________清洗金属丝)
②灼烧(灼烧至与酒精灯火焰颜色一致)
③蘸取样品
④观察焰色
⑤酸洗
做焰色反应实验时所用的铂丝,每次用完后都要( )
A.用滤纸擦干净后才能使用 B.用水多洗几次
4
C.用稀盐酸洗涤后,再灼烧到无颜色时为止D.先用稀盐酸洗涤,后用水洗涤
3.2 几种重要的金属化合物③
课型设置:新授课;
学习目标:了解铝的氧化物的化学性质,认识Al(OH)3与强酸强碱的反应,掌握Al(OH)3的两性。适当了解Al3+与AlO2-的反应。
学习重点:Al(OH)3化学性质
学习难点: Al3+、AlO2-、Al(OH)3的转化关系
学习内容(包括学法指导)
(一) AlCl3
AlCl3是易溶于水的____色固体,熔点低,属于盐类,属于_______化合物(类似______?HCl ?NaCl),其熔融态_____导电,其在水中的电离方程式为_________________________________。
(二) Al2O3
Al2O3是_______溶于水的_____色固体,熔点很高,属于_______化合物(类似______?HCl ?NaCl),其熔融态_______导电。
以熔融Al2O3为原料进行电解制得单质铝的化学方程式为:__________________________。
铝的表面形成的氧化膜成分就是Al2O3,可以用强酸或强碱除去表面铝表面的Al2O3,离子方程式分别为:Al2O3与强酸________________________________________;
Al2O3与强碱_________________________________________。
上述两个反应的产物均为_____和水,表明Al2O3是____性氧化物。
(三) Al(OH)3
Al(OH)3是____溶于水的___色固体,加热时会分解,化学方程式为___________________。实验室,常将铝盐溶液和_______混合制得白色____状Al(OH)3,离子方程式为________________________。
Al(OH)3是一种______性氢氧化物(化学式也可以写为____________),其电离方程式为:
H+ + _____________ Al(OH)3 ___OH- + ______________
Al(OH)3溶于强酸的离子方程式为____________________________________
溶于强碱的离子方程式为____________________________________
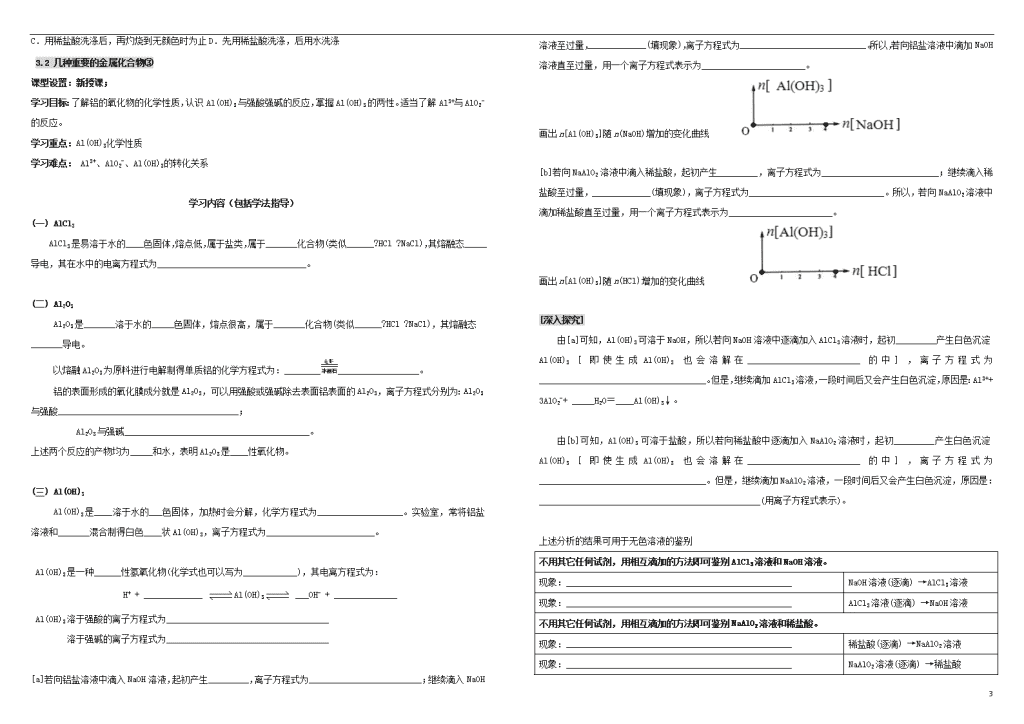
[a]若向铝盐溶液中滴入NaOH溶液,起初产生_________,离子方程式为_________________________;继续滴入NaOH溶液至过量,_____________(填现象),离子方程式为____________________________。所以,若向铝盐溶液中滴加NaOH溶液直至过量,用一个离子方程式表示为_______________________。
画出n[Al(OH)3]随n(NaOH)增加的变化曲线
[b]若向NaAlO2溶液中滴入稀盐酸,起初产生_________,离子方程式为__________________________;继续滴入稀盐酸至过量,_____________(填现象),离子方程式为______________________________。所以,若向NaAlO2溶液中滴加稀盐酸直至过量,用一个离子方程式表示为_______________________。
画出n[Al(OH)3]随n(HCl)增加的变化曲线
[深入探究]
由[a]可知,Al(OH)3可溶于NaOH,所以若向NaOH溶液中逐滴加入AlCl3溶液时,起初_________产生白色沉淀Al(OH)3 [即使生成Al(OH)3也会溶解在_________________________的中],离子方程式为_____________________________________。但是,继续滴加AlCl3溶液,一段时间后又会产生白色沉淀,原因是:Al3++ 3AlO2-+ _____H2O=____Al(OH)3↓。
由[b]可知,Al(OH)3可溶于盐酸,所以若向稀盐酸中逐滴加入NaAlO2溶液时,起初_________产生白色沉淀Al(OH)3 [即使生成Al(OH)3也会溶解在_________________________的中],离子方程式为_____________________________________。但是,继续滴加NaAlO2溶液,一段时间后又会产生白色沉淀,原因是:_________________________________________________(用离子方程式表示)。
上述分析的结果可用于无色溶液的鉴别
不用其它任何试剂,用相互滴加的方法即可鉴别AlCl3溶液和NaOH溶液。
现象:__________________________________________________
NaOH溶液(逐滴) →AlCl3溶液
现象:__________________________________________________
AlCl3溶液(逐滴) →NaOH溶液
不用其它任何试剂,用相互滴加的方法即可鉴别NaAlO2溶液和稀盐酸。
现象:__________________________________________________
稀盐酸(逐滴) →NaAlO2溶液
现象:__________________________________________________
NaAlO2溶液(逐滴) →稀盐酸
4
3.2 几种重要的金属化合物④
课型设置:新授课;
学习目标:了解铁的氧化物、铁的氢氧化物的主要性质;掌握Fe2+和Fe3+的相互转化
学习重点:Fe(OH)2的性质;Fe3+的检验
学习难点:Fe2+的检验;Fe2+和Fe3+的转化
学习内容(包括学法指导)
(一) 铁的氧化物
Fe2O3(俗称___________)是______溶于水的_____色固体,属于_____性氧化物,其与稀盐酸反应的离子方程式为______________________________________。
Fe3O4 (俗称_______________)是_______溶于水的_____色______体,不属于碱性氧化物,其与稀盐酸反应的离子方程式为________________________________________。
FeO是______溶于水的_______色固体,属于_______性氧化物,FeO与稀盐酸反应的离子方程式为______________________________;FeO溶于稀硝酸的离子方程式为_____H+ + ____ NO3- +_____FeO=
____________________________(已知还原产物为NO)。FeO不稳定,在空气中受热迅速被氧化成Fe3O4,化学方程式为____________________________________。
(二) 铁的氢氧化物
实验室通常用FeCl3溶液与NaOH溶液反应制备Fe (OH)3,离子方程式为_______________________。生成的Fe (OH)3是_______色固体,是一种_____溶的_____碱,它与稀硫酸反应的离子方程式为___________________________。Fe (OH)3受热分解反应的化学方程式:_____________________。
实验室通常用FeSO4溶液与NaOH溶液反应制备Fe (OH)2,离子方程式为_______________________。生成的Fe (OH)2是_____色______状固体,是一种_____溶的_____碱。它与稀盐酸反应的离子方程式为_________________________,它与稀硝酸的离子方程式为__________________________________。
生成的Fe (OH)2露置在空气中,迅速变为_______色,最终变为_______色,该过程的化学方程式为____________________________________________。
(三) Fe2+和Fe3+
1、鉴别两种液体分别为FeCl3溶液、FeCl2溶液,最简单的方法是: __________________________。
2、(1)向FeCl3溶液中滴加KSCN(名称_____________)溶液,溶液变为__________色,离子方程式为____________________________。可利用这一反应进行______的检验。
若向反应后的液体中,加入铁粉,充分振荡,会观察到液体_________________,原因是(用离子方程式表示)____________________________________________。
(2) 向FeCl2溶液中滴加KSCN溶液,溶液______________,再向其中滴加氯水(主要成分视为Cl2),溶液变为_______色。可以认为是发生了反应,_____Fe2+ +__ Cl2 =___________________,其生成的________(离子符号)再与__________(离子符号)结合。
由此可知,仅用KSCN溶液,_____鉴别Fe2+。鉴别Fe2+的方法是:取____________,向其中滴加KSCN溶液后___________,再加入氯水/硝酸/双氧水(等__________剂),若液体变为______色,则待测液中含有Fe2+。
综上所述,要实现如图转化中的(1) (2) (3) 需要加入氧化剂,而实现(4) (5) (6)需要加入还原剂。
相比较而言,(1)中加入氧化剂的氧化性应当强于_____,而 (2) 中加入氧化剂的氧化性应当强于______。(4)中加入还原剂的还原性应当强于__________ ,而(5) 中加入还原剂的还原性应当强于_______。
如,(1)稀盐酸、CuSO4溶液、S单质(加热)、碘单质(加热)【化学方程式_____________】
如,(2) KMnO4溶液、O2、Cl2、Br2【离子方程式________________________________】
如,(3) 硝酸、Cl2【化学方程式__________________________________】、Br2
如,(4) 活泼性强于_____的金属(Al/Zn)等
如,(5) Fe、Cu【离子方程式_______________________】、KI【离子方程式_____________________】
如,(6)___量的Al/Zn
课堂反馈
1、加热Fe (OH)2固体能得到对应价态的铁的氧化物吗?____。原因________________________。
2、存放少量FeCl2溶液溶液时为了避免其迅速变质,通常向溶液中加入_______。
3、Fe(OH) 2不稳定,空气中迅速变质。若FeSO4溶液和NaOH溶液为原料反应制取Fe(OH) 2时,为了沉淀颜色能保持较长时间,可以考虑采取如下措施:①在反应液上方___________、②事先煮沸_________溶液以减少其中的_________、③使用长胶头滴管,将滴管伸至____________________再挤出液体。
若使用如图所示装置,选用Fe、NaOH溶液、稀硫酸作反应物,则试管A中盛放的试剂为____________,试管B中盛放的试剂为_________________,引发试管A、B中溶液混合的操作是__________________________;进行此操作前的一个步骤中需要首先_________________,Fe(OH)2沉淀最终产生于试管__________中。
4
相关文档
- 2020届高考化学一轮复习化学反应速2021-07-0235页
- 2020届高考化学一轮复习晶体结构与2021-07-0211页
- 2021版化学名师讲练大一轮复习鲁科2021-07-025页
- 2020届高考化学一轮复习阿伏加德罗2021-07-026页
- 北京市2021高考化学一轮复习专题一2021-07-0216页
- 2010-2019十年高考化学真题分类汇2021-07-0240页
- 2020届高考化学一轮复习化学反应速2021-07-0217页
- 备战2021 高考化学 考点32 反应热2021-07-0214页
- 2021高考化学一轮复习专题9第2讲乙2021-07-0214页
- 2021版新高考地区选考化学(人教版)一2021-07-027页