- 1.89 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
“江淮十校”2020届高三第三次联考
化学试卷
考生注意:
1.本试卷分第Ⅰ卷和第Ⅱ卷两部分。满分300分,考试时间150分钟。
2.考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区城作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
3.做选考题时,考生须按照题目要求作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Ni-59 Cu-64
第Ⅰ卷
一、选择题:本在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关,下列观点错误的是( )
A. 硝酸铵、液氨可用作制冷剂
B. 苏打、小苏打可用作食用面碱
C. 二氧化氯、漂白粉可用作自来水的杀菌消毒剂
D. 氧化铝、二氧化硅可用作制坩埚
【答案】C
【解析】
【详解】A.液氨易液化,硝酸铵溶于水吸热,故两者可以作制冷剂;
B.苏打、小苏打溶于水都显碱性,可用作食用面碱;
C.漂白粉的消毒效果较弱,用于消毒时需要投入量大,这样容易形成氯超标的问题,一般不用作自来水的消毒剂;
D.氧化铝、二氧化硅的熔点高,可用作制坩埚;
答案选C。
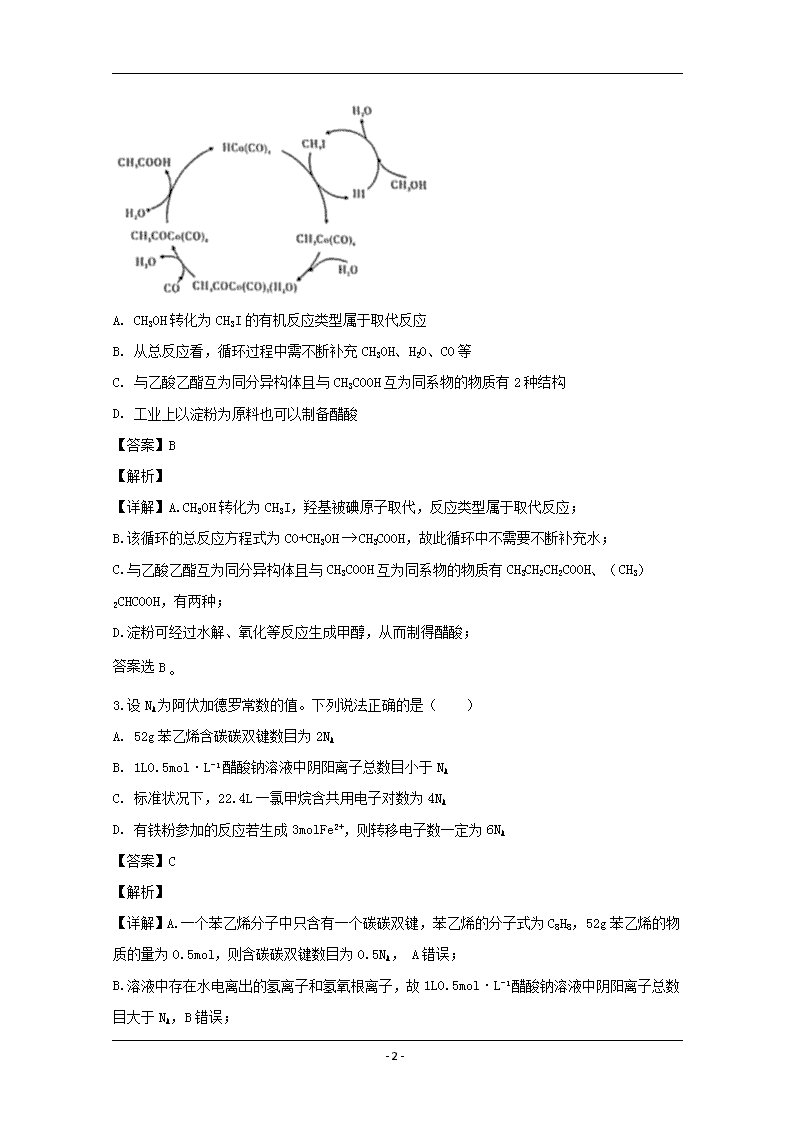
2.BASF高压法制备醋酸,所采用钴碘催化循环过程如图所示,则下列观点错误的是( )
- 18 -
A. CH3OH转化为CH3I的有机反应类型属于取代反应
B. 从总反应看,循环过程中需不断补充CH3OH、H2O、CO等
C. 与乙酸乙酯互为同分异构体且与CH3COOH互为同系物的物质有2种结构
D. 工业上以淀粉为原料也可以制备醋酸
【答案】B
【解析】
【详解】A.CH3OH转化为CH3I,羟基被碘原子取代,反应类型属于取代反应;
B.该循环的总反应方程式为CO+CH3OHCH3COOH,故此循环中不需要不断补充水;
C.与乙酸乙酯互为同分异构体且与CH3COOH互为同系物的物质有CH3CH2CH2COOH、(CH3)2CHCOOH,有两种;
D.淀粉可经过水解、氧化等反应生成甲醇,从而制得醋酸;
答案选B
3.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 52g苯乙烯含碳碳双键数目为2NA
B. 1L0.5mol·L-1醋酸钠溶液中阴阳离子总数目小于NA
C. 标准状况下,22.4L一氯甲烷含共用电子对数为4NA
D. 有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
【答案】C
【解析】
【详解】A.一个苯乙烯分子中只含有一个碳碳双键,苯乙烯的分子式为C8H8,52g苯乙烯的物质的量为0.5mol,则含碳碳双键数目为0.5NA, A错误;
B.溶液中存在水电离出的氢离子和氢氧根离子,故1L0.5mol·L-1醋酸钠溶液中阴阳离子总数目大于NA,B错误;
- 18 -
C.标况下一氯甲烷为气态,一个一氯甲烷中含有四个共用电子对,则标准状况下,22.4L一氯甲烷含共用电子对数为4NA ,C正确;
D.反应Fe+2Fe3+=3Fe2+,若生成3molFe2+,转移2mol电子,D错误;
答案选C
【点睛】苯环中不含碳碳双键也不含碳碳单键。
4.已知A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中B和D同主族,中学阶段常见物质X、Y、Z为其中的三种元素组成的化合物,且均为强电解质,当X、Y按物质的量之比为1:2反应时,有如图转化关系。下列说法正确的是( )
A. C、D、E三种元素一定位于同一周期
B. 物质X、Y、Z既含有离子键又含有共价键
C. C和D形成的化合物溶于水,其溶液显中性
D. 简单氢化物的热稳定性:D>E
【答案】A
【解析】
【分析】
根据W为二元液态化合物,推测W为水,X、Y、Z为其中的三种元素组成的化合物,且均为强电解质,X、Y按物质的量之比为1:2反应,推测X与Y的反应应为酸碱中和反应,进一步推测X为硫酸、Y为氢氧化钠,Z为硫酸钠;从而推断A为H元素、B为O元素、C为Na元素、D为S元素、E为Cl元素。
【详解】A.C为Na元素、D为S元素、E为Cl元素,位于同一周期,A正确;
B.X为硫酸,只含有共价键,B错误;
C. C和D形成的化合物为Na2S,为强碱弱酸盐溶于水显碱性,C错误;
D.非金属性Cl>S,其简单氢化物的热稳定性:HCl>H2S,D错误;
答案选A。
【点睛】同一周期从左到右,元素的非金属性逐渐增强,简单氢化物的热稳定性逐渐增强。
5.次磷酸钴[Co(H2PO2)2]广泛应用于化学电镀,工业上利用电渗析法制取次磷酸钴的原理图如图所示。
- 18 -
已知:①该装置的电极材料分别为金属钴和不锈钢。
②Co(H2PO2)2溶液在强碱性条件下通过自身催化发生氧化还原反应,实现化学镀钴。
下列说法中正确的是( )
A. 膜Ⅱ、膜Ⅲ均为阴离子交换膜
B. M电极反应为Co-2e-+2H2PO2-=Co(H2PO2)2
C. a为电源的负极
D. Co(H2PO2)2溶液化学镀钴过程中反应可能为Co2++H2PO2-+3OH=Co+HPO3-+2H2O
【答案】A
【解析】
【分析】
该装置为电解池,M为阳极,电极材料为金属钴,钴失电子生成钴离子,钴离子通过膜I进入产品室,H2PO2-通过膜Ⅱ、Ⅲ进入产品室与钴离子生成Co(H2PO2)2。
【详解】A.综上分析,膜Ⅱ、膜Ⅲ均为阴离子交换膜,A正确;
B.Co(H2PO2)2在产品室生成,不是在阳极生成,阳极的电极反应式为Co-2e-=Co2+,B错误;
C.M为阳极,应接电源的正极,故a为电源的正极,C错误;
D.离子方程式中电荷不守恒,应为Co2++H2PO2-+3OH-=Co+HPO32-+2H2O,D错误;
答案选A。
6.氨基甲酸铵(H2NCOONH4)是常用的氨化剂之一。某研究小组利用反应原理:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH<0制备氨基甲酸铵,其装置如图所示,已知:H2NCOONH4(s)白色固体,易分解、易水解。则下列观点不正确的是( )
- 18 -
A. 仪器1是恒压漏斗,该实验用于防倒吸
B. 仪器2和仪器3都可以放置NaOH固体
C. 为了完成实验,应在装置5和6之间,依次添加干燥装置和安全瓶
D. 若反应初期观察到装置6内稀硫酸溶液中产生气泡,应控制旋塞,加大浓氨水的流速
【答案】A
【解析】
【详解】A.仪器1是恒压漏斗,其作用为使漏斗内液体顺利流下,A错误;
B.浓氨水和氢氧化钠固体混合可以制氨气,氢氧化钠固体可以干燥氨气,故仪器2和仪器3都可以放置NaOH固体,B正确;
C.防止生成的氨基甲酸铵水解,或者防止氨气过量导致装置6倒吸,应在应在装置5和6之间,依次添加干燥装置和安全瓶,C正确;
D.若反应初期观察到装置6内稀硫酸溶液中产生气泡,说明二氧化碳过量,应该加快产生氨气的流速,D正确;
答案选A。
7.工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y=或],与pH的变化关系如图所示。则下列说法一定错误的是( )
A. 通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
- 18 -
B. α1=α2一定等于45°
C. 当对应溶液的pH处于1.81c(SO32-)>c(H2SO3)
D. 直线Ⅱ中M、N点一定存在c2(HSO3-)>c(SO32-)·c(H2SO3)
【答案】C
【解析】
【详解】A.通入少量二氧化硫的过程中,溶液的酸性增强,直线Ⅱ中的N点向M点移动;
B. ,则,,同理可得,故α1=α2一定等于45°;
C.由图像可知,当对应溶液的pH处于1.810,溶液中c(H2SO3)、c(SO32-)的大小无法确定;
D.由于Ka1>Ka2,,则c2(HSO3-)>c(SO32-)·c(H2SO3);
答案选C。
第Ⅱ卷(共174分)
三、非选择题:包括必考题和选考题两部分。
(一)必考题(共129分)
8.天然气是一种重要的化工原料,其中含有少量H2S羰基硫(COS),能引起催化剂中毒、化学产品质量下降和大气污染。
(1)氨水可以吸收H2S,若生成物是NH4HS,写出反应的离子方程式___。
(2)利用含Fe3+的溶液可以脱除其中的H2S。将H2S和空气按一定流速通酸性FeCl3溶液,可实现空气脱硫得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S)随时间t变化如图。
- 18 -
①t1以前,溶液中n(Fe3+)不断减小的原因是___(用离子方程式表示)。
②t1以后,溶液中n(Fe3+)基本保持不变,原因是___。此时,溶液中总反应的离子方程式可以表示为___。
(3)羰基硫的碱性水解是常用的脱硫方法,其流程如图:
①已知B是硫化钠,C是一种正盐,则B的电子式为___,C的化学式为___。
②写出反应②的离子方程式___。
③如图是反应②中,在不同反应温度下.反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图像分析可知,a点时溶液中除S2O32-外,还有___(填含硫微粒的离子符号)。
【答案】 (1). H2S+NH3·H2O=NH4++HS-+H2O (2). 2Fe3++H2S=2Fe2++S↓+2H+ (3). t1以后溶液中同时发生两个反应,Fe3+氧化吸收H2S和Fe2+被O2氧化再生Fe3+,当两个反应速率相等时,溶液中n(Fe2+)保持基本不变 (4). 2H2S+O22S↓+2H2O (5). (6). Na2CO3 (7). 2S2-+5H2OS2O32-+4H2↑+2OH- (8). SO42-
【解析】
- 18 -
【分析】
Fe3+与H2S发生氧化还原反应生成Fe2+与S,同时Fe2+被空气中氧气氧化为Fe3+;天然气中羰基硫(COS)与氢氧化钠反应生成硫化钠,是非氧化还原反应,C是一种正盐,推测C为碳酸钠;硫化钠发生氧化还原反应,生成S2O32-、SO42-等其它含硫物质。
【详解】(1)氨水中一水合氨与H2S反应中和反应,生成NH4HS,离子方程式为H2S+NH3·H2O=NH4++HS-+H2O。
(2)①由图可知,t1前n(Fe3+)迅速减小,被吸收的n(H2S)显著增加,发生的离子反应为2Fe3++H2S=2Fe2++S↓+2H+;
②t1以后溶液中同时发生两个反应,Fe3+氧化吸收H2S、Fe2+被氧气氧化再生成Fe3+,当两个反应速率相等时,溶液中n(Fe3+)基本保持不变。t1以后Fe3+起催化作用,总反应方程式为2H2S+O22S↓+2H2O。
(3)①硫化钠为离子化合物,由钠离子、硫离子构成,其电子式为,COS与氢氧化钠反应前后化合价没有变化,生成含有+4价碳元素的正盐,该正盐为碳酸钠,其反应方程式为COS+4NaOH=Na2S+Na2CO3+2H2O。
②图示说明:硫化钠溶液加热生成了Na2S2O3和氢气,发生氧化还原反应,根据得失电子守恒和电荷守恒配平,则离子方程式为2S2-+5H2OS2O32-+4H2↑+2OH-。
③根据图像可知,a点时氢气是10mol,说明反应中共有20mol电子发生转移,则根据得失电子守恒可知,3mol硫化钠分子必须提供20mol电子,全部转化为硫代硫酸钠转移12mol电子,全部转化为亚硫酸钠转移18mol电子,全部转化为硫酸钠转移24mol电子,所以a点时溶液中除S2O32-外,还有SO42-。
9.镍的抗腐蚀性佳,主要用于合金和电镀,也可用作良好的催化剂。现准确称量8g粗镍(含有少量Fe、Cu以及难与酸、碱反应的杂质)进行如下提纯。
请回答下列问题:
(1)写出稀硝酸溶解镍的离子方程式___。
- 18 -
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节pH=5.5,继续加热煮沸5min,加热过程中补充适量的水保持溶液的体积不变,静止一段时间后,过滤出Fe2O3、FeO(OH)。
①写出煮沸过程中生成FeO(OH)的离子方程式___。
②控制溶液的pH,可利用___。
a.pH试纸 b.石蕊指示剂 c.pH计
③为了得到纯净的溶液B,还需要加入以下物质___(填字母)进行除杂。(已知:Ksp(CuS)=8.8×10-36;Ksp(NiS)=3.2×10-19;Ksp[Cu(OH)2]=2.2×10-20;Ksp[Ni(OH)2]=5.4×10-16)
a.NaOH b.Na2S C.H2S d.NH3·H2O
(3)在快速搅拌下缓慢向溶液B中滴加12%的H2C2O4溶液,溶液中即可析出NiC2O4·2H2O,搅拌下煮沸2min冷却。操作X包括:过滤、洗涤和烘干,采用如图的装置进行过滤(备注:该图是一个通过水泵减压过滤的装置)。这种抽滤其优点是___,装置B的主要作用是___,若实验过程中发现倒吸现象,应采取的措施是___。
(4)在该生产过程中需要纯净的H2。若实验室要制备纯净的H2,发生装置不可以选择___(选填代号)。
(5)用电子天平称取0.5000g的NiO样品,加入一定体积的6mol/L的盐酸恰好完全溶解,将所得到的溶液配制成250mL的溶液。取出20mL加入锥形瓶,按照如下滴定原理进行沉淀滴定,最终得到干燥的固体mg,则镍元素的质量分数为___。(写出表达式即可)
[一定条件下丁二酮肟(,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2
- 18 -
的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
【答案】 (1). 3Ni+8H++2NO3-=3Ni2++2NO+4H2O (2). Fe3++2H2OFeO(OH)↓+3H+ (3). c (4). c (5). 速度快 (6). 安全瓶 (7). 旋开K (8). B (9). ×100% (10). 生成沉淀质量大,称量误差小,分析结果准确度高
【解析】
【分析】
粗镍与稀硝酸反应,生成镍离子、铁离子、铜离子等,经过净化、除杂,溶液B为硝酸镍溶液,加入H2C2O4生成NiC2O4·2H2O,经过操作X过滤、洗涤和烘干得到NiC2O4·2H2O晶体,在空气中加热生成三氧化二镍,再加热生成NiO,NiO与氢气发生氧化还原反应生成纯镍。
【详解】(1)镍与硝酸反应成Ni2+、NO和水,离子方程式为3Ni+8H++2NO3-=3Ni2++2NO+4H2O。
(2)①将溶液A煮沸,调节pH=5.5,继续加热煮沸5min,铁离子水解生成FeO(OH),离子方程式为Fe3++2H2OFeO(OH)↓+3H+。
②实验中要准备测量溶液的pH,只有pH计可以。
③为了得到纯净的溶液B,需要除去Cu2+,又不能减少Ni2+,由溶度积常数可知,CuS的溶解度最小,且远远小于NiS的溶解度,能实现很好的分离,故选择H2S。
(3)由于水流的作用,使漏斗下端的压强小于外界大气压,可以加速过滤的速度;装置B的主要作用是安全瓶;若实验过程中发生倒吸现象,先旋开旋塞K,恢复常压后关闭抽水泵。
(4)实验室制氢气采用锌与稀硫酸反应,不需要加热,装置B为加热制气装置,不符合题意,答案选B。
(5)NiO与盐酸反应生成Ni2+,取250mL中的20mL溶液用丁二酮肟滴定Ni2+发生反Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,得到干燥的固体mg,则Ni(C4N2H7O2)2的质量为mg,其中镍元素的质量为 ;则0.5g样品中镍元素的质量为 ,镍元素的质量分数为×100%。
- 18 -
Ni2+与丁二酮肟反应生成的沉淀质量大,称量误差小,分析结果准确度高,故选用丁二酮肟有机沉淀剂。
10.氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)汽车尾气中常含有碳烟、CO、NO等有害物质,尾气中含有碳烟的主要原因为___。
(2)已知298K和101kPa条件下,有如下反应:
反应①:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
反应②:N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol-1
若反应CO2(g)+N2(g)⇌C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为___kJ·mol-1。
(3)在常压下,已知反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH(298K)=-113.0kJ·mol-1,ΔS(298K)=-145.3J/(mol·K),据此可判断该反应在常温下___(填“能”或“不能”)自发进行。
(4)向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),NO和N2的物质的量变化如表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1kPa、p2kPa。
物质的量/mol
T1℃
T2℃
0
5min
10min
15min
20min
25min
30min
NO
2.0
1.16
0.80
0.80
0.50
0.40
0.40
N2
0
0.42
0.60
0.60
0.75
0.80
0.80
①0~10min内,以NO表示的该反应速率v(NO)=___kPa·min-1。
②第15min后,温度调整到T2,数据变化如表所示,则p1___p2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,再次达平衡时NO的体积百分含量为___。
(5)为探究温度及不同催化剂对反应2NO(g)+2CO(g)+⇌N2(g)+2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示:
- 18 -
①在催化剂乙作用下,图中M点对应的速率(对应温度400℃)v正___v逆(填“>”、“<”或“=”),其理由为___。
②温度高于400℃,NO转化率降低的原因可能是___。
【答案】 (1). 燃料燃烧不充分 (2). 2a-574 (3). 能 (4). 0.06p1 (5). > (6). 20% (7). > (8). 相同温度下,曲线乙的转化率低于曲线甲的转化率,说明M点不是平衡点,反应仍向正反应进行 (9). 温度升高催化剂活性降低
【解析】
【分析】
燃料燃烧不充分生成碳烟,燃料燃烧产生NO等有害物质,若∆H-T∆S<0则反应能自发进行;由表格数据可知,T1℃时10min后反应达到平衡,T2℃时25min后反应达到平衡,密闭容器中压强的大小由气体分子数和分子间隔决定;由(5)题图可知,随温度升高相同时间内NO的转化率先升高后降低。
【详解】(1)尾气中含有碳烟的主要原因为燃料燃烧不充分。
(2)若反应CO2(g)+N2(g)⇌C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的逆反应活化能为2a kJ·mol-1,根据盖斯定律:①-②可得C(s)+2NO(g)⇌CO2(g)+N2(g) ΔH=-574 kJ·mol-1,故反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为(2a-574)kJ·mol-1。
(3)满足自发进行的条件是:ΔH-TΔS=-113.0 kJ·mol-1-T(-145.310-3) kJmol-1·K-1<0,则T<777.7K,故该反应在常温下能自发进行。
(4)①该反应反应前后气体总物质的量不变,故0~10min内,容器的总压强保持不变,平衡是NO(g)的分压为,以NO表示的该反应速率v(NO)=。
②第15min后,温度调整到T2,从表格查得NO的物质的量减少,N2
- 18 -
的增加,平衡正向移动,由于正反应为放热反应,改变条件为降温,气体的总的物质的量不变,温度越低,压强越小,则p1>p2。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,该反应前后气体分子数不变,加入反应混合物前后构成等效平衡,达平衡时NO的体积百分含量为。
(5)①在催化剂乙作用下,相同温度下,曲线乙的转化率低于曲线甲的转化率,说明M点不是平衡点,反应仍向正反应进行,则v正>v逆。
②温度升高催化剂活性降低,催化效率降低,则在相同时间内测得NO转化率降低。
(二)选考题
11.Cu(In1-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]___;Ga、In、Se,第一电离能从大到小顺序为___。
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是___。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是___。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为___。
(4)SeO32-的立体构型为___;SeO2中硒原子采取杂化类型是___。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
①CuS晶体中,相邻的两个铜离子间的距离为___pm。
②Cu2S晶体中,S2-的配位数为___。
③Cu2S晶体的密度为ρ=___g·cm-3(列出计算式即可)。
- 18 -
【答案】 (1). 4d105s25p1 (2). Se>Ga>In (3). 硅原子半径大于碳,硅原子的原子轨道肩并肩重叠程度小,形成三键、三键不稳定 (4). 组成、结构相似、四氯化硅的相对分子质量较大 (5). [Ga(NH3)4Cl2]Cl (6). 三角锥形 (7). sp2 (8). a (9). 8 (10).
【解析】
【分析】
Ga与In同主族,Se与Ga同周期;碳与硅同主族,碳原子半径小于硅原子半径;硒原子的价层电子数为4,其中为1个孤对电子对、3个成键电子对;CuS晶胞中S2-位于晶胞的顶点和面心上,铜离子位于体内,配位数为4。
【详解】(1)镓原子的质子数为49,电子排布是为1s22s22p63s23p63d104s24p64d105s25p1,简写为[Kr] 4d105s25p1;Ga与In同主族,Se与Ga同周期,同一主族从上到下第一电离能逐渐减小,同周期从左到右第一电离能逐渐增大,则第一电离能从大到小顺序为Se>Ga>In。
(2)碳碳双键、碳碳叁键都有键,硅原子的半径大于碳原子,硅原子的原子轨道肩并肩重叠程度小于碳原子,键不稳定。四氯化硅、四氟化硅都是分子构成的物质,组成、结构相似,四氯化硅的相对分子质量大于四氟化硅,故四氯化硅的分子间作用力较大,沸点较高。
(3)向上述某配合物的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2,说明该配合物内界和外界中含氯离子的个数比为2:1,由于Ga3+的配位数为6,则该配合物的化学式为[Ga(NH3)4Cl2]Cl。
(4)SeO32-中硒原子的价层电子对数为4,其中为1个孤对电子对、3个成键电子对,故它的立体构型为三角锥形;二氧化硒分子中硒原子价层有3个电子对,采取sp2杂化。
(5)①由题意可知,铜离子位于互不相邻的四面体中心,因此相邻的两个铜离子间的距离为a pm。
②铜离子配位数为4,根据化学式为Cu2S,得出S2-的配位数为8。
③Cu2S晶体中含有8个铜离子、4个硫离子,故晶体的密度为ρ=
g·cm-3。
12.某研究小组以苯乙烯和乙烯为主要原料,设计出医药中间体G的合成路线如图:
- 18 -
已知RCOOHRCOClRCOOR’。
(1)B中含氧官能团的名称为___;D的结构简式为___。
(2)乙烯的某种同系物的化学名称为“甲基丙烯”,则甲基丙烯的结构简式为___。
(3)B能通过分子间脱水生成有机物X,X可用于香料,其结构中含有三个六元环状结构,则B转化为X的化学方程式:___。
(4)M是G的同分异构体,符合下列结构和性质的芳香族化合物M共有___种(不考虑立体异构)。
①1molM与银氨溶液反应最多能得4molAg;
②苯环上有四个取代基,其相对位置为;
③核磁共振氢谱为5组峰,且峰面积为2:2:2:2:1;
④M能发生消去反应。
写出M发生消去反应的化学方程式:___(一例即可)。
(5)设计出以甲苯为原料制备B的合成路线(无机试剂任选,已知:RCHO,RCNRCOOH)___。
合成路线常用的表示方式为:AB……目标产物。
【答案】 (1). 羟基、羧基 (2). CH3COOH (3). (CH3)2C=CH2 (4). 2+2H2O (5). 4 (6). +H2O或
- 18 -
+NaCl+2H2O (7).
【解析】
【分析】
根据已知条件可知,F生成G、D生成E的反应机理与已知相同,推测F为;乙烯与水加成反应生成乙醇,乙醇氧化生成乙酸,D为乙酸,E为CH3COCl;B与E生成F,推测B的结构简式为,则苯乙烯先发生加成反应生成A,A再经过氧化、取代生成B。
【详解】(1)综上分析,B中含氧官能团的名称为羟基、羧基;D的结构简式为CH3COOH。
(2)根据名称可知,甲基丙烯的结构简式为(CH3)2C=CH2。
(3)当羟基和羧基在同一个碳原子上时,B发生分子间脱水的酯化反应生成六元环酯,化学方程式为2+2H2O。
(4)M是芳香族化合物,结构中含有苯环,1molM与银氨溶液反应最多能得4molAg,说明结构中含有两个醛基;苯环上有四个取代基,其相对位置为,核磁共振氢谱为5组峰,且峰面积为2:2:2:2:1并能发生消去反应,满足条件的M的结构简式有
,共4种;发生消去反应的化学方程式为+H2O或+NaCl+2H2O。
- 18 -
(5)B为,逆推可知,甲苯通过取代反应生成,再经过取代反应生成,氧化生成苯甲醛,苯甲醛发生与已知相同反应机理的反应生成B,具体合成路线为:
。
- 18 -
- 18 -
相关文档
- 【衡水点睛大联考】2015届高三第三2021-07-026页
- 数学理卷·2017届山西省临汾一中、2021-07-0110页
- 安徽省皖南八校2020届高三第三次联2021-07-0122页
- 数学文卷·2017届江西省高三第三次2021-07-0110页
- 陕西省2020届高三第三次联考理科数2021-07-0120页
- 安徽省江淮十校2021届高三数学(理)上2021-06-3013页
- 甘肃省白银市靖远县2019届高三第三2021-06-3017页
- 安徽省江淮十校2020届高三第三次联2021-06-3010页
- 2019届广东省六校高三第三次联考理2021-06-2510页
- 数学理卷·2017届安徽省江淮十校高2021-06-2412页