- 1.11 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 氢原子光谱和玻尔的原子结构模型
[学习目标定位] 1.了解原子结构模型的演变历程和玻尔的原子结构模型的内容。2.知道基态、激发态和原子光谱等概念,认识原子光谱分析的应用。
一、原子结构模型的演变
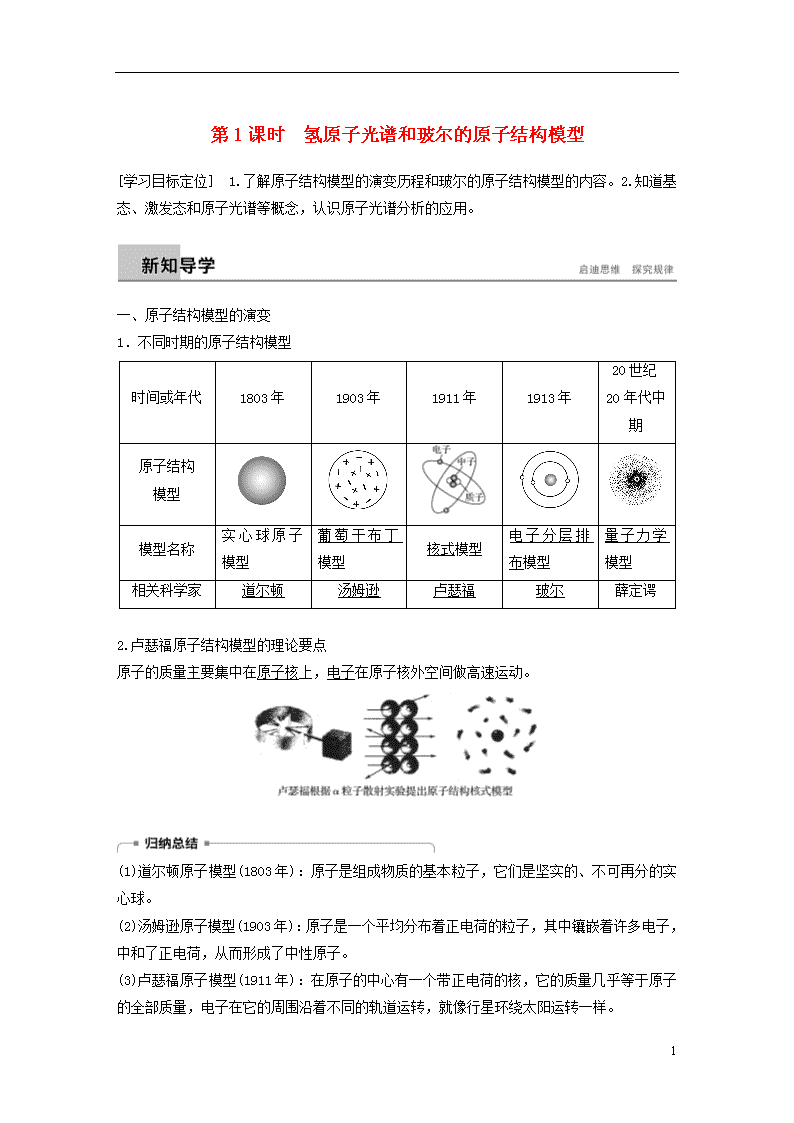
1.不同时期的原子结构模型
时间或年代
1803年
1903年
1911年
1913年
20世纪20年代中期
原子结构
模型
模型名称
实心球原子模型
葡萄干布丁模型
核式模型
电子分层排布模型
量子力学模型
相关科学家
道尔顿
汤姆逊
卢瑟福
玻尔
薛定谔
2.卢瑟福原子结构模型的理论要点
原子的质量主要集中在原子核上,电子在原子核外空间做高速运动。
(1)道尔顿原子模型(1803年):原子是组成物质的基本粒子,它们是坚实的、不可再分的实心球。
(2)汤姆逊原子模型(1903年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
(3)卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
9
(4)玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
(5)原子结构的量子力学模型(20世纪20年代中期):现代物质结构学说。
例1 如图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆逊的观点的是( )
A.①②③ B.③①②
C.③②① D.②①③
答案 B
解析 卢瑟福提出了原子的核式模型,道尔顿认为原子是一个实心的球体,汤姆逊发现了电子,并提出了原子的“葡萄干布丁”模型。
例2 下列关于原子结构模型的说法中,正确的是( )
A.道尔顿的原子结构模型将原子看作实心球,故不能解释任何问题
B.汤姆逊“葡萄干布丁”原子结构模型成功地解释了原子中的正、负粒子是可以稳定共存的
C.卢瑟福核式原子结构模型指出了原子核和核外电子的质量关系、电性关系及占有体积的关系
D.玻尔电子分层排布原子结构模型引入了量子化的概念,能够成功解释所有的原子光谱
答案 C
解析 道尔顿的原子理论成功地解释了质量守恒定律等规律,A项不正确;汤姆逊“葡萄干布丁”原子结构模型提出了正、负电荷的共存问题,但同时认为在这样微小的距离上有着极大的作用力,电子会被拉进去并会碰撞在带正电的核心上,B项不正确;卢瑟福通过α粒子散射实验提出了核式原子结构模型,散射实验的结果能够分析出原子核和核外电子的质量关系、电性关系及占有体积的关系,C项正确;玻尔电子分层排布原子结构模型只引入了一个量子数,只能够解释氢原子光谱,而不能解释比较复杂的原子光谱,D项不正确。
二、氢原子光谱和玻尔的原子结构模型
1.光谱及其分类
(1)含义:利用仪器将物质吸收的光或发射的光的波长和强度分布记录下来,就得到所谓的光谱。
(2)分类
①连续光谱:若光谱是由各种波长的光所组成,且相近的波长差别极小而不能分辨,则这种光谱为连续光谱。例如,阳光形成的光谱即为连续光谱。
②线状光谱:若光谱是由具有特定波长的、彼此分立的谱线组成,则所得光谱为线状光谱。
9
(3) 氢原子光谱特点
氢原子光谱是线状光谱。
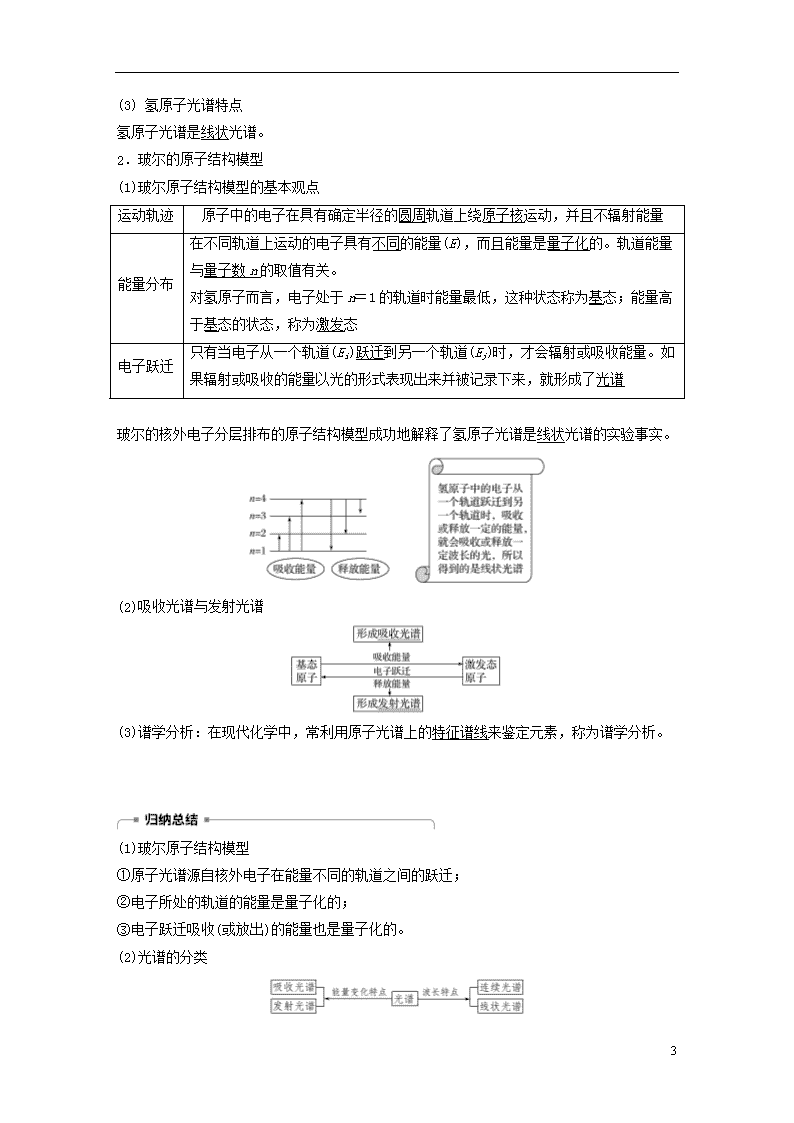
2.玻尔的原子结构模型
(1)玻尔原子结构模型的基本观点
运动轨迹
原子中的电子在具有确定半径的圆周轨道上绕原子核运动,并且不辐射能量
能量分布
在不同轨道上运动的电子具有不同的能量(E),而且能量是量子化的。轨道能量与量子数n的取值有关。
对氢原子而言,电子处于n=1的轨道时能量最低,这种状态称为基态;能量高于基态的状态,称为激发态
电子跃迁
只有当电子从一个轨道(Ei)跃迁到另一个轨道(Ej)时,才会辐射或吸收能量。如果辐射或吸收的能量以光的形式表现出来并被记录下来,就形成了光谱
玻尔的核外电子分层排布的原子结构模型成功地解释了氢原子光谱是线状光谱的实验事实。
(2)吸收光谱与发射光谱
(3)谱学分析:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为谱学分析。
(1)玻尔原子结构模型
①原子光谱源自核外电子在能量不同的轨道之间的跃迁;
②电子所处的轨道的能量是量子化的;
③电子跃迁吸收(或放出)的能量也是量子化的。
(2)光谱的分类
9
例3 玻尔理论不能解释( )
A.氢原子光谱为线状光谱
B.氢原子的可见光区谱线
C.在有外加磁场时氢原子光谱有多条谱线
D.在一给定的稳定轨道上,运动的核外电子不辐射能量
答案 C
解析 玻尔理论是针对原子的稳定存在和氢原子光谱为线状光谱的事实提出的。有外加磁场时氢原子有多条谱线,玻尔的原子结构模型已无法解释这一现象,必须借助量子力学加以解释。
特别提醒
玻尔理论中只引入一个量子数n,只能解释氢原子光谱是线状光谱。若要解释更复杂的原子光谱,需引入更多的量子数。
例4 对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
答案 A
解析 在电流作用下,基态氖原子的电子吸收能量跃迁到较高的轨道,变为激发态原子,这一过程要吸收能量,不会发出红光;而电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,从而产生红光,故A项正确。
易错警示
焰色反应、物质燃烧或高温下发光等都与原子核外电子的跃迁有关,而化学反应中的颜色变化与原子核外电子的跃迁无关。
9
1.最早成功解释了氢原子光谱为线状光谱的原子结构模型是( )
A.卢瑟福原子结构模型
B.玻尔原子结构模型
C.量子力学模型
D.汤姆逊原子结构模型
答案 B
解析 玻尔的原子结构模型最早成功解释了氢原子光谱是线状光谱;汤姆逊“葡萄干布丁”原子结构模型只解释了原子中存在电子的问题;卢瑟福原子结构模型是根据α粒子散射实验提出来的,解决了原子核的问题(带正电的部分集中在一个核上);量子力学模型是在量子力学理论的基础上提出的,能解释复杂的原子光谱现象。
2.首次将量子化概念应用到原子结构,并解释了原子的稳定性的科学家是( )
A.道尔顿 B.门捷列夫
C.玻尔 D.卢瑟福
答案 C
解析 道尔顿、门捷列夫、玻尔和卢瑟福的主要贡献分别是原子学说、元素周期律、原子轨道理论和原子的核式模型。丹麦科学家玻尔引入量子化观点,提出电子在一定轨道上运动的原子结构模型。
3.下列说法正确的是( )
A.氢原子光谱是元素的所有光谱中最简单的光谱
B.“量子化”就是不连续的意思,微观粒子运动均有此特点
C.玻尔理论不但成功解释了氢原子光谱,而且还推广到其他原子光谱
D.原子中电子在具有确定半径的圆周轨道上像火车一样高速运动着
答案 A
解析 氢原子光谱是元素的所有光谱中最简单的光谱;原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的轨道的能量是“量子化”的,其他微粒如分子、离子等无此特点;玻尔理论成功地解释了氢原子光谱,但对多电子原子的光谱却难以解释;原子中电子没有确定的半径,原子半径是电子运动的“区域”。
4.为揭示氢原子光谱是线状光谱这一事实,玻尔提出了核外电子的分层排布理论,下列说法中,不符合这一理论的是( )
A.电子绕核运动具有特定的半径和能量
B.在一给定的稳定轨道上,运动的核外电子不辐射能量
C.电子跃迁时,会吸收或放出特定的能量
D.揭示氢原子光谱存在多条谱线
答案 D
9
解析 玻尔的原子结构模型只能解释氢原子光谱是线状光谱,要解释氢原子光谱的多重谱线,需用量子力学理论来解释。
5.元素K的焰色反应呈紫色,其中紫色对应的辐射波长为( )
A.404.4 nm B.553.5 nm
C.589.2 nm D.670.8 nm
答案 A
解析 紫色波长介于400~435 nm之间,只有A符合。
6.用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:______________________________________________
________________________________________________________________________。
答案 燃烧时,电子获得能量,从能量较低的轨道向能量较高的轨道跃迁,跃迁到能量较高的轨道的电子处于一种不稳定的状态,它随即就会跃达到能量较低的轨道,并向外界以光能的形式释放能量
解析 焰火在燃烧时产生五颜六色的光,是因为金属原子的核外电子发生了从能量较低的轨道向能量较高的轨道跃迁,然后电子再从能量较高的轨道回到能量较低的轨道,此过程中释放能量,放出的能量以光能的形式释放,所以看到了不同颜色的光(电子跃迁时产生了发射光谱)。
[对点训练]
题组1 原子结构模型的演变史
1.在物质结构研究的历史上,首先提出原子是一个实心球体的是( )
A.汤姆逊 B.卢瑟福
C.道尔顿 D.玻尔
答案 C
解析 道尔顿在1803年提出原子是坚实的,不可再分的实心球。依次出现汤姆逊原子模型、卢瑟福原子模型、玻尔原子模型。
2.首先提出原子结构模型并开始涉及原子内部结构的科学家是( )
A.卢瑟福 B.玻尔
C.汤姆逊 D.道尔顿
答案 C
解析 汤姆逊“葡萄干布丁”模型开始涉及原子内部的结构。卢瑟福提出原子结构的核式模型;玻尔建立了核外电子分层排布的原子结构模型;道尔顿建立了原子学说。
3.关于原子模型的演变过程,正确的是( )
9
A.汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
B.汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型
C.道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型
D.道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
答案 D
题组2 氢原子光谱及玻尔原子结构模型
4.在实验室中用下列装置可以得到氢原子光谱,实验证明该光谱为线状光谱,该光谱的发现在原子结构的认识过程中,有极为重要的意义,根据它产生了( )
A.卢瑟福核式原子模型
B.汤姆逊“葡萄干布丁”模型
C.玻尔核外电子分层排布模型
D.原子结构的量子力学模型
答案 C
解析 玻尔的原子结构模型是为了解释氢原子光谱为线状光谱而不是连续光谱而提出的。
5.原子光谱是线状光谱,是由不连续的谱线组成的,这表明( )
A.原子发射的光是单色光
B.白光可以由多种单色光组成
C.在原子中只有某些电子能够跃迁产生光谱
D.原子中的电子可以处于某些特定的能量状态,即电子的能量是量子化的
答案 D
解析 光谱分为连续光谱和线状光谱,无论是单色光还是白光,都是连续光谱,原子光谱是线状光谱,也就是由具有特定频率的光形成的谱线。原子光谱之所以产生这种特定的谱线,是由于电子的能量是量子化的,电子跃迁的始态和终态的能量差也是量子化的。
6.元素Na的焰色反应呈黄色,其中黄色对应的辐射波长为( )
A.404.4 nm B.553.5 nm
C.589.2 nm D.670.8 nm
答案 C
解析 黄色波长介于589.0~589.6 nm之间,只有C符合。
7.元素Na的焰色反应呈黄色,从能量变化的角度其光谱类型属于( )
A.发射光谱 B.吸收光谱
9
C.连续光谱 D.线状光谱
答案 A
解析 焰色反应是待测物的金属元素吸收能量后,原子中的电子发生跃迁变为激发态,而激发态不稳定,释放能量变为较低能量的激发态或基态,产生发射光谱。
题组3 基态与激发态原子
8.同一原子的基态和激发态相比较,正确的是( )
①基态时的能量比激发态时高 ②基态时比较稳定
③基态时的能量比激发态时低 ④激发态时比较稳定
A.①② B.②③
C.①④ D.③④
答案 B
解析 对同一原子,基态时比较稳定,基态时的能量比激发态时低,②③正确,①④错误。
9.下列说法正确的是( )
A.自然界中的所有原子都处于基态
B.同一原子处于激发态时的能量一定高于基态时的能量
C.无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D.激发态原子的能量较高,极易失去电子,表现出较强的还原性
答案 B
解析 自然界中的原子有的处于基态,有的处于激发态,A项错误;同一种原子处于激发态时的能量一定高于基态时的能量,若原子种类不同,则不一定如此,B项正确,C项错误;激发态原子的能量较高,容易跃迁到能量较低的激发态或基态,能量降低,激发态原子若要失去电子,仍必须再吸收能量,失去电子难易程度需根据原子的具体情况而定,有的激发态原子易失去电子,有的激发态原子难失去电子,D项错误。
10.下图中所发生的现象与电子的跃迁无关的是( )
答案 D
解析 燃放烟火、霓虹灯、燃烧蜡烛等获得的光能都是电子跃迁时能量以光的形式释放出来导致的,而平面镜成像则是光线反射的结果。
9
11.下列对焰色反应的描述正确的是( )
A.焰色反应是单质的性质
B.焰色反应是化学变化
C.焰色反应是金属原子失去电子时吸收能量产生的现象
D.焰色反应是金属原子或离子中的电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将能量以光的形式释放出来的现象
答案 D
解析 焰色反应是金属原子或离子中的电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将能量以光的形式释放出来的现象,变化过程中并没有新物质生成,是物理变化,而不是化学变化。
12.下列说法不能用玻尔的原子结构模型解释的是( )
A.氢原子光谱为线状光谱
B.在一定的稳定轨道上,运动的核外电子不能发射电磁波
C.氢原子中处于激发态的电子能量高
D.氢原子在可见光区形成紫色谱线时说明电子从基态跃迁到激发态
答案 D
解析 原子核外电子从激发态跃迁到基态时才会形成发射光谱,D项符合题意。
[综合强化]
13.回答下列问题:
(1)日光等白光经棱镜折射后产生的是________光谱。原子光谱是________光谱。
(2)吸收光谱是________的电子跃迁为________的电子产生的,此过程中电子________能量;发射光谱是________的电子跃迁为________的电子产生的,此过程中电子________能量。
答案 (1)连续 线状 (2) 基态 激发态 吸收 激发态 基态 释放
14.(1) 1861年德国人基尔霍夫(G.R.Kirchhoff)和本生(R.W.Bunsen)研究锂云母的某谱时,发现在深红区有一新线,从而发现了铷元素,他们研究的是___________________________。
(2)含有钾元素的盐的焰色反应为______色。许多金属盐都可以发生焰色反应,其原因是________________________________________________________________________
________________________________________________________________________。
答案 (1)原子光谱
(2)紫 激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量
9
相关文档
- 人教版高中化学选修五 1_1 有机化2021-07-0293页
- 人教版高中化学选修五 1_2有机化合2021-07-0231页
- 2020高中化学 第三章 金属及其化合2021-07-024页
- 2020高中化学第一章认识有机化合物2021-07-027页
- 高中化学必修二知识点归纳总结(2022021-07-0223页
- 初高中化学衔接27物质间的相互转化2021-07-0235页
- 高中化学第3章水溶液中的离子平衡2021-07-026页
- 高中化学 电解质溶液中离子浓度的2021-07-024页
- 2021届高三化学一轮复习高中化学综2021-07-0211页
- 2019-2020学年高中化学课时作业102021-07-028页