- 2.07 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
机密★启用前
华大新高考联盟名校2020年5月高考预测考试
文科综合能力测试 化学部分
本试题卷共12页,47题(含选考题)。全卷满分300分。考试用时150分钟。
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号填写在答题卡上,并将准考证号条形码贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.填空题和解答题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。答案写在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
5.考试结束后,请将答题卡,上交。
可能用到的相对原子质量:H1 C12 O16 S32 K39 Cr52 Fe56 Zn65
一、选择题:本题共13题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.国家卫健委高级别专家李兰娟院士在记者会上透露:新型冠状病毒怕酒精,不耐高温,56℃持续30分钟就死亡了。乙醚、75%酒精(医用酒精)、含氯的消毒剂、过氧乙酸等均可有效灭活病毒。下列有关说法正确的是
A.乙醚与乙醇互为同分异构体
B.可以用工业酒精代替医用酒精使用
C.过氧乙酸是高效消毒剂,过氧乙酸与苯酚混合使用可增强消毒效果
D.84消毒液是以次氯酸钠(NaClO)为有效成分的消毒液,一般需稀释后再使用
8.下列实验操作会导致结果偏低的是
A.用标准的盐酸滴定氨水时,用酚酞作指示剂
B.用润湿的pH试纸测定1 mol/L氯化铵溶液的pH
C.用18.4 mol/L浓硫酸配制1 mol/L稀硫酸,用量筒量取浓硫酸,倒出浓硫酸后,未将量筒洗涤并收集洗涤液
- 14 -
D.配制一定物质的量浓度的溶液,用胶头滴管定容时,俯视容量瓶刻度线
9.三溴苯酚在一定条件可发生如下转化生成M,M是一种具有优良光学性能的树脂。下列说法正确的是
A.上述反应的反应类型为加成反应
B.与三溴苯酚官能团种类和数目都相同的芳香族化合物还有5种
C.1 mol M与足量氢气加成,一般最多可消耗5 mol氢气
D.M在水中有良好的溶解性
10.最近,科学家发现一种高能盐,该盐由X、Y、Z、M四种原子序数依次增大的短周期元素组成,其化学式为(Y5)6(X3Z)3(YX4)4M。该盐的两种阳离子均为10电子离子,分别是由X与Y、X与Z组成。化合物XM是18电子分子。下列说法错误的是
A.X与Y、X与Z还分别可形成10电子分子
B.该盐中存在离子键、极性共价键和非极性共价键
C.该盐的阴离子均可破坏水的电离平衡
D.四种元素所形成的简单离子的半径由大到小为M>Y>Z>X
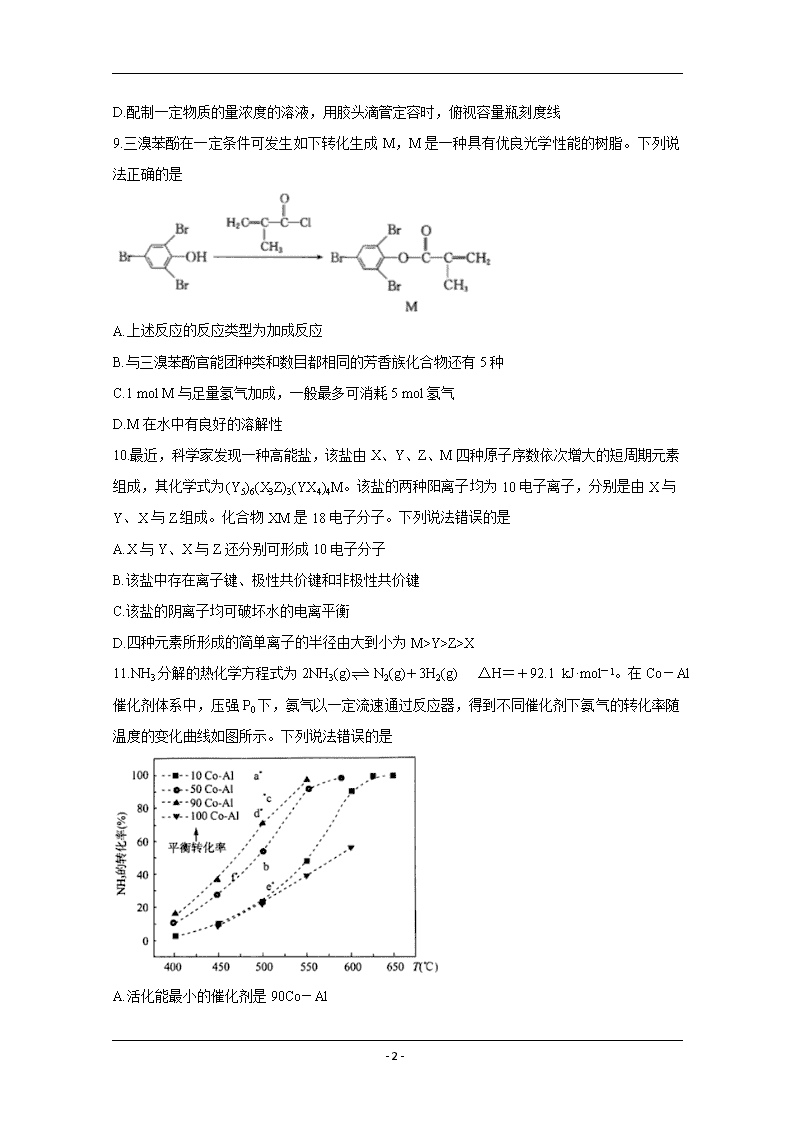
11.NH3分解的热化学方程式为2NH3(g)N2(g)+3H2(g) △H=+92.1 kJ·mol-1。在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。下列说法错误的是
A.活化能最小的催化剂是90Co-Al
- 14 -
B.如果增大气体流速,则b点对应的点可能为e
C.温度为T时,向体积为1 L的恒容容器中加入0.8 mol NH3和0.1 mol H2,达到平衡时,NH3的转化率为75%,则平衡常数K=7.5
D.在两个体积均为V L的绝热密闭容器中分别投入①2 mol NH3,②3 mol H2和1 mol N2,达到平衡时,NH3的体积分数相同
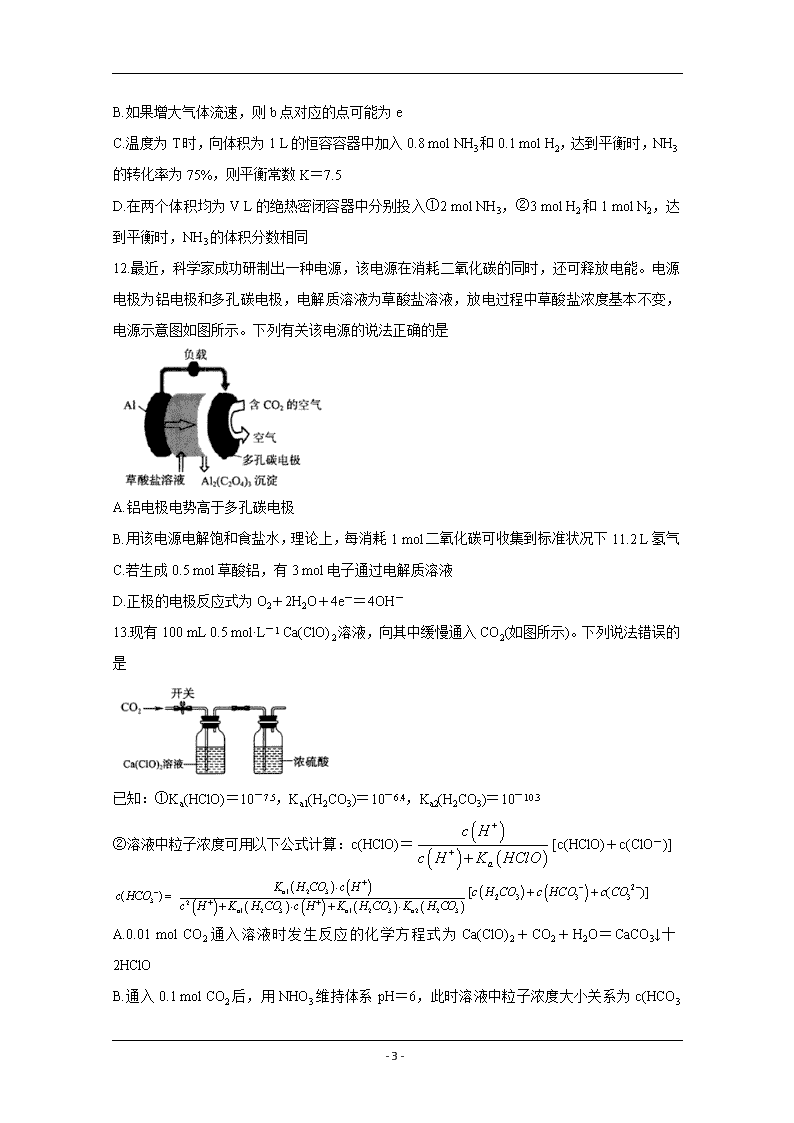
12.最近,科学家成功研制出一种电源,该电源在消耗二氧化碳的同时,还可释放电能。电源电极为铝电极和多孔碳电极,电解质溶液为草酸盐溶液,放电过程中草酸盐浓度基本不变,电源示意图如图所示。下列有关该电源的说法正确的是
A.铝电极电势高于多孔碳电极
B.用该电源电解饱和食盐水,理论上,每消耗1 mol二氧化碳可收集到标准状况下11.2 L氢气
C.若生成0.5 mol草酸铝,有3 mol电子通过电解质溶液
D.正极的电极反应式为O2+2H2O+4e-=4OH-
13.现有100 mL 0.5 mol·L-1 Ca(ClO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是
已知:①Ka(HClO)=10-7.5,Ka1(H2CO3)=10-6.4,Ka2(H2CO3)=10-10.3
②溶液中粒子浓度可用以下公式计算:c(HClO)=[c(HClO)+c(ClO-)]
A.0.01 mol CO2通入溶液时发生反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓十2HClO
B.通入0.1 mol CO2后,用NHO3维持体系pH=6,此时溶液中粒子浓度大小关系为c(HCO3
- 14 -
-)>c(HClO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(14分)
某草酸亚铁水合物A可用于制作照相显影剂、制药等。下面是对该化合物的制备及分析的实验方案。请回答下列问题。
(1)硫酸亚铁的制备及收集纯净的氢气:将2.00 g铁粉(含少量FeS及其他难溶性杂质)放入150 mL锥形瓶中,加入25 mL 3 mol/L H2SO4,水浴加热。反应完毕趁热过滤,反应装置如下图所示(每个装置限用一次)。
①使用以上装置完成实验,指出装置连接顺序: 。
A.②反应完毕后趁热过滤的目的是 。
(2)草酸亚铁水合物A的制备:将滤液转移至事先已盛有50 mL 1 mol/L H2C2O4溶液的250 mL烧杯中,搅拌下加热至沸腾,一段时间后得到淡黄色沉淀(其主要成分为A)。
①已知A中铁的质量分数为31%,其化学式为 。
②3.6 g A在无氧条件下加热,最终得到1.44 g固体化合物,试写出该过程中发生反应的化学方程式: 。
③若对实验方案中的硫酸加入量略作调整,可以得到更高产率的A,试用化学平衡的相关知识分析,并指出该调整是增加还是减少硫酸的量: 。
(3)草酸亚铁水合物A纯度的测定:称取m g产物于100 mL烧杯中,用2 mol/L H2SO4溶解,转移至250 mL容量瓶中并用2 mol/L H2SO4定容。移取25.00 mL溶液至250 mL锥形瓶中,微热后用浓度为c mol/L的标准高锰酸钾溶液滴定,平行测定三次,平均消耗滴定剂V mL(假设杂质不参与滴定反应)。
①写出滴定过程中发生反应的离子方程式: 。
- 14 -
②列出表示产物中A的纯度的计算式: 。
27.(14分)
铬矿是冶金、国防、化工等领域不可缺少的矿产资源,其中的铬铁矿是唯一可开采的铬矿石。工业上常用铬铁矿(主要含Fe2O3、FeO和Cr2O3,还含有MgO、Al2O3、SiO2等杂质)为原料制备重铬酸钾和三氧化二铁,其流程如图所示。
已知常见离子开始生成沉淀和沉淀完全的pH如下表所示。
请回答下列问题:
(1)铬铁矿与熔融NaOH和NaClO3的反应是在坩埚中进行的,可用作此坩埚材料的是 。
A.镍 B.刚玉(Al2O3) C.陶瓷 D.石英
(2)写出铬铁矿中的Cr2O3与熔融NaOH和NaClO3反应的化学方程式: 。由于在该过程中铁元素会大量转变为NaFeO2,所以加水的作用为 (用离子方程式表示)。
(3)“滤渣2”的主要成分为 (填化学式)。
(4)利用化学平衡移动原理解释调节pH2约至4.5的原因是 ;再向其中加入KCl固体,蒸发浓缩至液体表面有晶膜产生,冷却结晶,过滤得到粗重铬酸钾晶体。为获得高纯度重铬酸钾晶体,可采取 (填操作名称)。
(5)调节pH3的范围为 。
(6)已知铬铁矿中铁、铬元素的质量比为14:13。上述流程中铁元素转化为Fe2O3的利用率为60%,提取铬元素的转化率为90%,如果得到Fe2O3的质量为32 t,则可以制备K2Cr2O7的质量为 t(结果保留1位小数)。
28.(15分)
- 14 -
二氧化硫的污染臭名昭著,含硒的化学药物却有望迎来美名。某环保车间将含SO2、NOx烟气经O3预处理后用CaSO3水悬浮液吸收。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
NO(g)+O2(g)=NO2(g) △H=-58.2 kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6 kJ·mol-1
(1)实验表明,在常温下反应:3NO(g)+O3(g)=3NO2(g)正向自发,试说明原因: 。
(2)将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示,试写出反应I的离子反应方程式: ,反应II的离子方程式: 。
(3)用CaSO3水悬浮液处理二氧化氮,若在吸收液中加入Na2SO4溶液,能提高NO2的吸收速率,其主要原因是 ;达到平衡后,溶液中c(SO32-)= [用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示]。
(4)氮的氧化物还可以通过电解法处理获得氮气和氧气,电解质为固体氧化物陶瓷,据图写出阴极的电极反应方程式: 。
(5)已知SeO2与SO2的混合烟气用水吸收可制得单质硒,过滤得粗硒,硒的部分物理性质如下表所示。某工艺采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是 。
(6)最近我国学者锁定COVID-19的新靶点Mpro蛋白酶,通过先进筛选手段,在FDA批准的已上市和临床实验药物中,发现老药Ebselen()在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3
- 14 -
,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为 µM,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为 。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
海洋是元素的摇篮,海水中含有大量卤族元素。NaCl晶胞结构示意图如下所示(晶胞边长为a nm)。
(1)元素Na的价电子被激发到相邻高能级后形成的激发态Na原子,其价电子轨道表示式为 。
(2)除了NaCl,Cl元素还能形成多种价态的化合物,如NaClO、NaClO2、NaClO3、NaClO4,这四种钠盐对应的酸的酸性依次增强,试解释HClO4的酸性强于HClO3的原因: 。
(3)在适当条件下,电解NaCl水溶液可制得NaClO3。
①NaCl水溶液中存在的微粒间作用力有 (填序号)。
A.离子键 B.极性键 C.配位键 D.氢键
②根据价层电子对互斥理论,预测ClO3-的空间构型为 ,写出一个ClO3-的等电子体的化学符号: 。
(4)在NaCl晶体中,Na+位于Cl-所围成的正 面体的体心,该多面体的边长是 nm。
- 14 -
(5)Na+半径与Cl-半径的比值为 (保留小数点后3位,=1.414)。
36.[化学——选修5:有机化学基础](15分)
一种常用的镇静、麻醉药物I,其合成路线如下。
已知:①B、C互为同分异构体;
其中R、R2代表烃基或氢原子,R1、R3代表烃基。回答下列问题。
(1)试剂a为溴代物,其名称为 ,G中官能团的名称为 ,G→H的反应类型为 。
(2)I的结构简式为 。
(3)写出B+C→D的化学方程式: 。
(4)设计实验区分B、D,所选用的试剂为 。
(5)已知羟基与碳碳双键直接相连的结构不稳定,同一个碳原子上连接多个羟基的结构不稳定,满足下列要求的D的所有同分异构体共有 种,写出其中互为顺反异构物质的结构简式: 。
a.能发生银镜反应; b.能发生水解反应; c.能使Br2的CCl4溶液褪色; d.能与Na反应。
(6)参照上述合成路线,请写出以CH2BrCH2CH2Br、CH3OH、CH3ONa为原料(无机试剂任选),制备的合成路线: 。
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -
相关文档
- 华大新高考联盟名校2020年5月份高2021-06-3012页
- 华大新高考联盟名校2020届高三高考2021-06-233页
- 华大新高考联盟名校2020年5月份高2021-06-2311页
- 华大新高考联盟名校2020届高三高考2021-06-154页
- 华大新高考联盟名校2020年5月份高2021-06-0916页
- 湖北省华大新高考联盟名校2020届高2021-06-0629页
- 华大新高考联盟名校2020年5月份高2021-06-0516页
- 华大新高考联盟名校2020年5月份高2021-05-2712页
- 华大新高考联盟名校2020年5月份高2021-05-2412页
- 华大新高考联盟名校2020年5月份高2021-05-1920页