- 288.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电化学基础
一、原电池工作原理
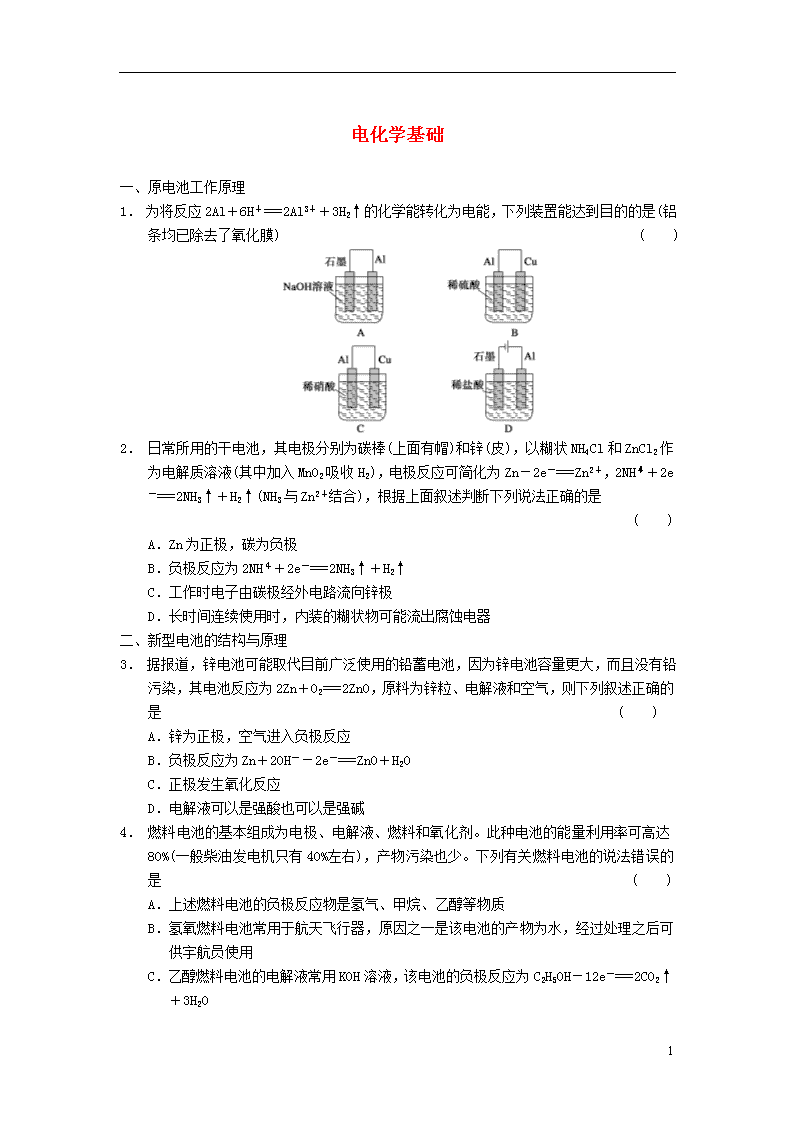
1. 为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜) ( )
2. 日常所用的干电池,其电极分别为碳棒(上面有帽)和锌(皮),以糊状NH4Cl和ZnCl2作为电解质溶液(其中加入MnO2吸收H2),电极反应可简化为Zn-2e-===Zn2+,2NH+2e-===2NH3↑+H2↑(NH3与Zn2+结合),根据上面叙述判断下列说法正确的是
( )
A.Zn为正极,碳为负极
B.负极反应为2NH+2e-===2NH3↑+H2↑
C.工作时电子由碳极经外电路流向锌极
D.长时间连续使用时,内装的糊状物可能流出腐蚀电器
二、新型电池的结构与原理
3. 据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是 ( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2OH--2e-===ZnO+H2O
C.正极发生氧化反应
D.电解液可以是强酸也可以是强碱
4. 燃料电池的基本组成为电极、电解液、燃料和氧化剂。此种电池的能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是 ( )
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解液常用KOH溶液,该电池的负极反应为C2H5OH-12e-===2CO2↑+3H2O
6
D.甲烷碱性燃料电池的正极反应为O2+2H2O+4e-===4OH-
5. LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为FePO4+LiLiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是 ( )
A.可加入硫酸以提高电解液的导电性
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量增加
D.放电时电池正极反应为FePO4+Li++e-===LiFePO4
三、电解原理及其应用
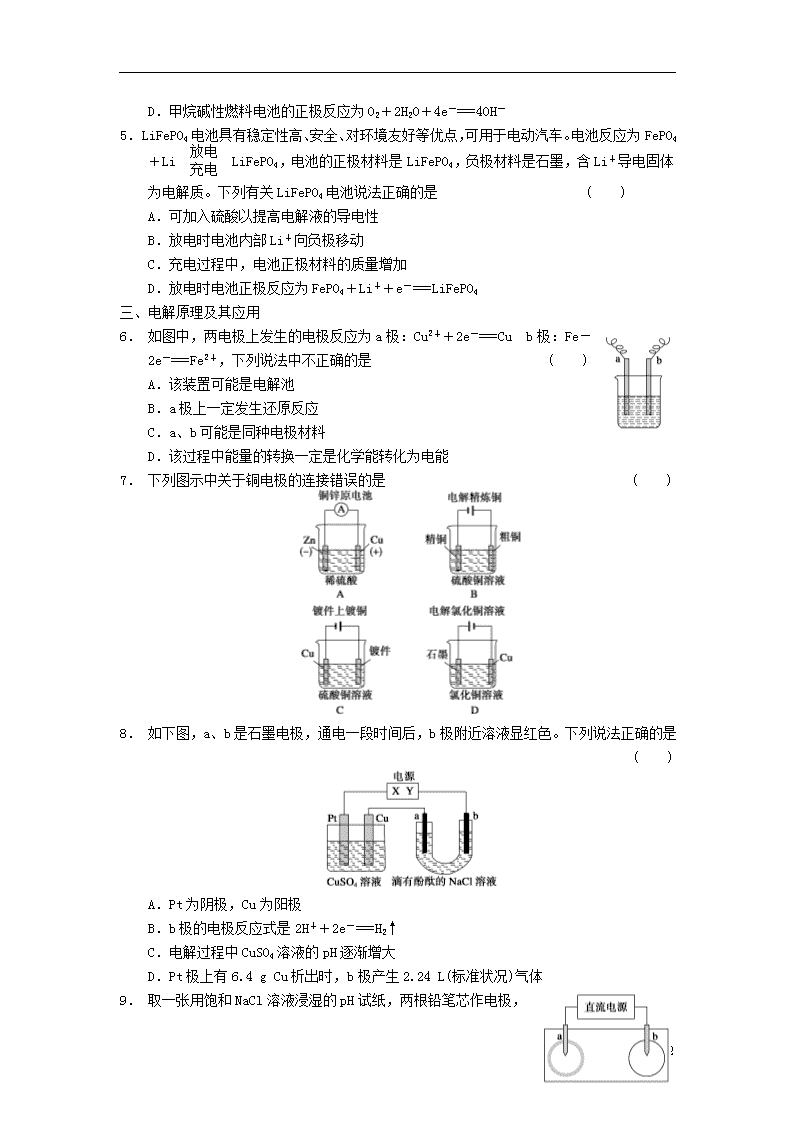
6. 如图中,两电极上发生的电极反应为a极:Cu2++2e-===Cu b极:Fe-
2e-===Fe2+,下列说法中不正确的是 ( )
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
7. 下列图示中关于铜电极的连接错误的是 ( )
8. 如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
( )
A.Pt为阴极,Cu为阳极
B.b极的电极反应式是2H++2e-===H2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
9. 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,
6
接通直流电源,一段时间后,发现a电极与试纸接触处出现一
个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误
的是 ( )
A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
10.下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原状况的是( )
电解质溶液
阳极
阴极
加入的物质
A
NaCl溶液
碳
铁
盐酸
B
NaOH溶液
碳
碳
水
C
硫酸铜溶液
铜
碳
硫酸铜
D
硫酸
铁
碳
H2O
四、金属的腐蚀与防护
11.有关金属腐蚀的论述,正确的是 ( )
A.金属的腐蚀一定伴有电流产生
B.Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀
C.发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀
D.发生电化学腐蚀时都有能量的转变,且被腐蚀的金属总是失电子
12.下列叙述不正确的是 ( )
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-===4OH-
D.工业上电解饱和食盐水的阳极反应:2Cl--2e-===Cl2↑
13.下列各种方法中,能对金属起到防止或减缓腐蚀作用的是 ( )
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A.①②③④ B.①③④⑤
C.①②④⑤ D.全部
14.下列有关金属腐蚀与防护的说法不正确的是 ( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.海轮外壳连接锌块以保护外壳不受腐蚀
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
五、电化学基础知识综合应用
15.图中的A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
6
(1)电源A中a点为________极。
(2)滤纸B上发生的总反应方程式为________________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应
为_______________________________________________________________________,
电极f上发生的反应为______________________________________________________,
槽中盛放的电镀液可以是________或__________(只要求填两种电解质溶液)。
16.铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
(1)①某原电池装置如下图所示,右侧烧杯中的电极反应式为
________________________________________________________________________,
左侧烧杯中的c(Cl-)________(填“增大”、“减小”或“不变”)。
②已知下图甲、乙两池的总反应式均为Fe+H2SO4===FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(2)装置丙中,易生锈的是______点(填“a”或“b”)。装置丁中可观察到的实验现象是
________________________________________________________________________。
17.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得丙中K2SO4的质量分数为10.47%,乙中c电极质量增加。据此回答问题:
6
(1)电源的N端为________极;
(2)电极b上发生的电极反应为______________________________________________;
(3)列式计算电极b上生成的气体在标准状况下的体积:_______________________;
(4)电极c的质量变化是________g。
6
答案
1.B 2.D 3.B 4.C 5.D 6.D 7.C 8.B 9.D 10.B 11.D 12.A 13.D 14.B
15.(1)正 (2)2NaCl+2H2OH2↑+Cl2↑+2NaOH
(3)Zn-2e-===Zn2+ Zn2++2e-===Zn
ZnSO4溶液 ZnCl2溶液
16.(1)①2H++2e-===H2↑ 增大
②甲池中:左——Fe,右——C
乙池中:左——Fe,右——C
(2)a 铁屑表面生成红棕色锈斑,试管内液面上升
17.(1)正 (2)4OH--4e-===2H2O+O2↑
(3)水减少的质量:100 g×=4.5 g 生成O2的体积:××22.4 L·mol-1=2.8 L (4)16
6
相关文档
- 化学第四章电化学基础第3节电解池2021-07-025页
- 2019届二轮复习电化学基础作业(全国2021-07-0213页
- 2018届二轮复习电化学基础课件(48张2021-07-0248页
- 高考化学一轮复习电化学基础训练题2021-05-145页
- 高考化学第二轮复习学案电化学基础2021-05-1420页
- 2010高考化学试题分类汇编电化学基2021-05-146页
- 高考化学基于阶段目标达成的电化学2021-05-1423页
- 高考化学试题分类解析汇编电化学基2021-05-138页
- 高考化学一轮复习电化学基础说课教2021-05-133页
- 2014高考化学专题复习训练电化学基2021-05-134页