- 275.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第四章 第三节 第 2 课时
一、选择题
1.关于电解 NaCl 水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入 KI 溶液,溶液呈黄色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
解析:用石墨作电极电解饱和氯化钠溶液,发生的反应是 2NaCl+2H2O =====电解
2NaOH+
H2↑+Cl2↑,故电解一段时间后电解液呈碱性。电解时,阳极发生氧化反应:2Cl--2e-
===Cl2↑,在阳极附近的溶液中滴入 KI 溶液时,发生反应 2I-+Cl2===2Cl-+I2,故溶液呈
黄色;阴极发生还原反应:2H++2e-===H2↑,因而阴极附近的溶液呈碱性,滴入酚酞试
液变红。
答案:B
2.关于电解法精炼铜的下列说法正确的是( )
A.粗铜作阳极,纯铜作阴极,硫酸铜为电解质溶液
B.纯铜作阳极,粗铜作阴极,硫酸铜为电解质溶液
C.电解结束后,溶液中 Cu2+浓度不变
D.电解结束后,溶液中 Cu2+浓度变大
解析:电解精炼铜时,粗铜作阳极,纯铜作阴极,CuSO4 为电解质溶液,因粗铜中活泼
金属失电子形成的阳离子如 Zn2+,会逐渐代替 Cu2+,故 c(Cu2+)将会有所减小。
答案:A
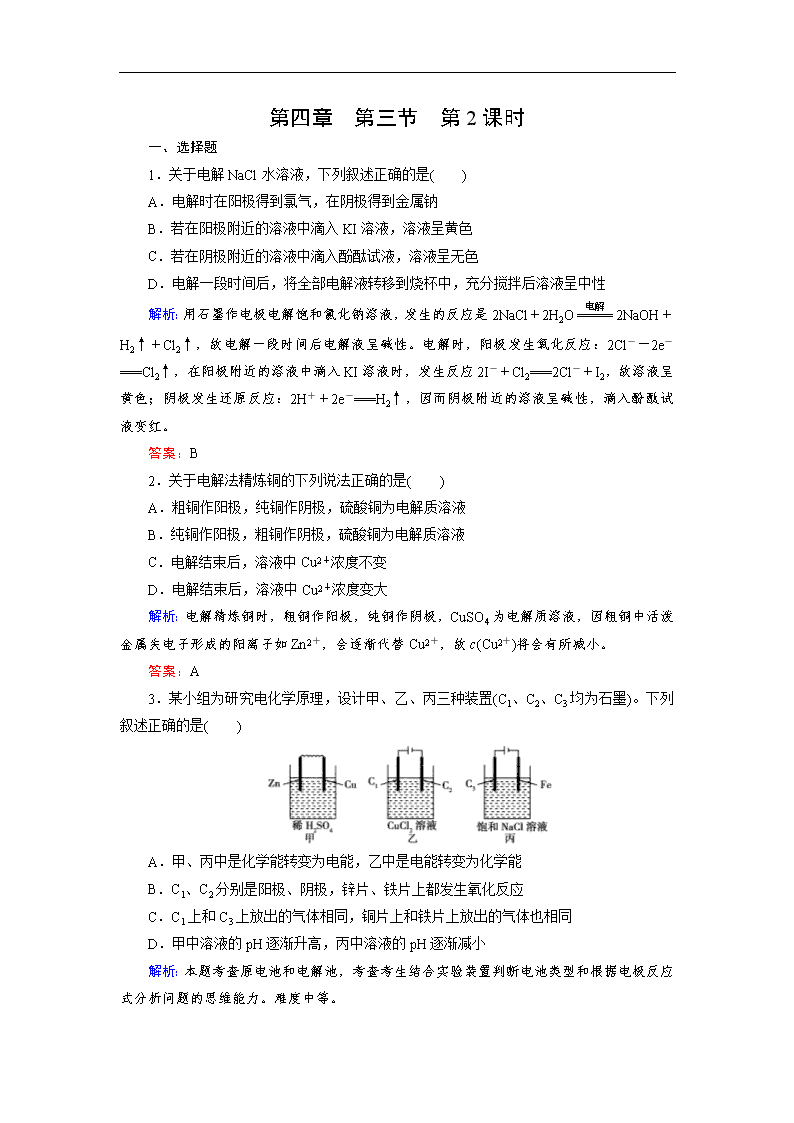
3.某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3 均为石墨)。下列
叙述正确的是( )
A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2 分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1 上和 C3 上放出的气体相同,铜片上和铁片上放出的气体也相同
D.甲中溶液的 pH 逐渐升高,丙中溶液的 pH 逐渐减小
解析:本题考查原电池和电解池,考查考生结合实验装置判断电池类型和根据电极反应
式分析问题的思维能力。难度中等。
A 项,甲图为原电池,将化学能转化为电能,乙、丙为电解池,将电能转化为化学能;
B 项,C1、C2 分别做电解池的阳极和阴极,原电池中 Zn 和 Cu 分别为负极和正极,分别发
生氧化反应和还原反应;C 项,C1 和 C3 上均为 Cl-失电子被氧化生成 Cl2,甲中 Cu 片和丙
中 Fe 片上均生成 H2;D 项,甲中不断消耗 H+,溶液的 pH 升高,丙中生成 NaOH 溶液,pH
也逐渐升高。
答案:C
4.Cu2O 是一种半导体材料,基于绿色化学理念设计的制取 Cu2O 的电解池示意图如图
所示,电解总反应为 2Cu+H2O 电解,Cu2O+H2↑。
下列说法正确的是( )
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成
解析:石墨作阴极,阴极上是溶液中的 H+反应,电极反应为 2H++2e-===H2↑,A 选
项正确;由电解总反应可知,Cu 参加了反应,所以 Cu 作电解池的阳极,发生氧化反应,B
选项错误;阳极与电源的正极相连,C 选项错误;阳极反应为 2Cu+2OH--2e-===Cu2O+
H2O,当有 0.1 mol 电子转移时,有 0.05 mol Cu2O 生成,D 选项错误。
答案:A
5.以 KCl 和 ZnCl2 混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后对铁制品失去保护作用
解析:电镀过程中 Zn 与电源正极相连,若给原电池充电,则 Zn 应接电源负极,A 错
误;导线中通过的电子,在阴极均被 Zn2+得到,所以通过的电子与锌析出的物质的量成正
比,B 错误;只要电流恒定,阴阳极得失电子的速率不变,所以电解反应速率不变,C 正确;
镀锌层破损后,Zn 比铁活泼,Zn 作负极,Fe 作正极,Fe 被保护,D 错误。
答案:C
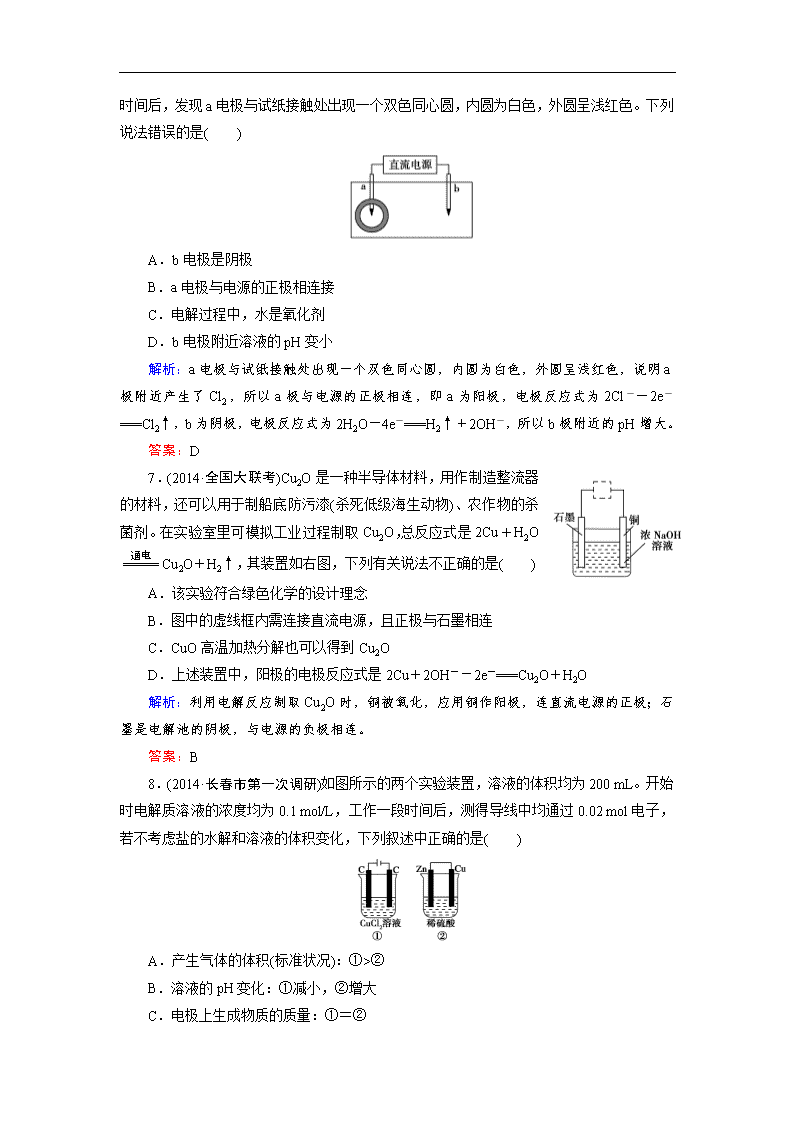
6.取一张用饱和 NaCl 溶液浸湿的 pH 试纸,两根铅笔芯作电极,接通直流电源,一段
时间后,发现 a 电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。下列
说法错误的是( )
A.b 电极是阴极
B.a 电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b 电极附近溶液的 pH 变小
解析:a 电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色,说明 a
极附近产生了 Cl2,所以 a 极与电源的正极相连,即 a 为阳极,电极反应式为 2Cl--2e-
===Cl2↑,b 为阴极,电极反应式为 2H2O-4e-===H2↑+2OH-,所以 b 极附近的 pH 增大。
答案:D
7.(2014·全国大联考)Cu2O 是一种半导体材料,用作制造整流器
的材料,还可以用于制船底防污漆(杀死低级海生动物)、农作物的杀
菌剂。在实验室里可模拟工业过程制取 Cu2O,总反应式是 2Cu+H2O
=====通电
Cu2O+H2↑,其装置如右图,下列有关说法不正确的是( )
A.该实验符合绿色化学的设计理念
B.图中的虚线框内需连接直流电源,且正极与石墨相连
C.CuO 高温加热分解也可以得到 Cu2O
D.上述装置中,阳极的电极反应式是 2Cu+2OH--2e-===Cu2O+H2O
解析:利用电解反应制取 Cu2O 时,铜被氧化,应用铜作阳极,连直流电源的正极;石
墨是电解池的阴极,与电源的负极相连。
答案:B
8.(2014·长春市第一次调研)如图所示的两个实验装置,溶液的体积均为 200 mL。开始
时电解质溶液的浓度均为 0.1 mol/L,工作一段时间后,测得导线中均通过 0.02 mol 电子,
若不考虑盐的水解和溶液的体积变化,下列叙述中正确的是( )
A.产生气体的体积(标准状况):①>②
B.溶液的 pH 变化:①减小,②增大
C.电极上生成物质的质量:①=②
D.电极反应式:①中阳极 2Cl--2e-===Cl2↑,②中负极 2H++2e-===H2↑
解析:本题考查考生对原电池和电解池原理的理解和掌握,意在考查考生的分析和判断
能力。①的阳极反应:2Cl--2e-===Cl2↑,导线中通过 0.02 mol 电子时,V(Cl2)=n(Cl2)Vm
=0.01 mol×22.4 L/mol=0.224 L,②中的正极反应为:2H++2e-===H2↑,导线中通过 0.02
mol 电子时,V(H2)=n(H2)Vm=0.01 mol×22.4 L/mol=0.224 L,所以产生气体的体积:①=
②,A 项错误;①相当于电解 CuCl2 本身,生成的 Cl2 与 H2O 反应,从而使溶液 pH 减小,②
相当于 Zn 和稀 H2SO4 中的 H+反应,所以 H+减少,酸性减弱,溶液 pH 增大,B 项正确;
由以上分析可知,m(Cl2)=n(Cl2)M(Cl2)=0.01 mol×71 g/mol=0.71 g,阴极反应:Cu2++2e
-===Cu,导线中通过 0.02 mol 电子时,m(Cu)=n(Cu)M(Cu)=0.01 mol×64 g/mol=0.64 g,
所以①电极上生成物质的质量为 0.71 g+0.64 g=1.35 g,由以上分析可知,m(H 2)=
n(H2)M(H2)=0.01 mol×2 g/mol=0.02 g,所以②电极上生成物质的质量为 0.02 g,①>②,C
项错误;②中负极:Zn-2e-===Zn2+,D 项错误。
答案:B
9.某溶液中含有溶质 NaCl 和 H2SO4,它们的物质的量之比为 3∶1。用石墨作电极电
解溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是( )
A.阴极只析出 H2
B.阳极先析出 Cl2,后析出 O2
C.电解最后阶段为电解水
D.溶液 pH 不断增大,最后为 7
解析:电解质溶液中,n(Na+)∶n(Cl-)∶n(SO2-4 )=3∶3∶1,开始电解产生 H2 和 Cl2,
同时生成 OH-中和 H2SO4,且生成 OH-多,最后相当于电解水,因而 pH>7,阴极只生成
H2。三个阶段分别为电解 HCl、NaCl、H2O。
答案:D
10.将 KCl 和 CuSO4 两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶
液 pH 随时间 t 变化的曲线如图所示,则下列说法正确的是( )
A.整个过程中两电极反应 2Cl--2e-===Cl2↑、2H++2e-===H2↑不可能同时发生
B.电解至 C 点时,往电解质溶液中加入适量 CuCl2 固体,即可使电解质溶液恢复至原
来的浓度
C.AB 段表示电解过程中 H+被还原,pH 增大
D.原混合溶液中 KCl 和 CuSO4 浓度之比恰好为 2∶1
解析:图像分为三段,因此整个电解过程也有三个过程。第一个过程相当于电解 CuCl2
溶液,CuCl2 水解呈酸性,随着电解的进行,浓度减小,酸性减弱,pH 增大,C 项错误;第
二个过程相当于电解 CuSO4 溶液,因产物中不断生成 H2SO4,故酸性不断增强,pH 减小;
第三个过程相当于电解水。若原混合溶液中 KCl 和 CuSO4 浓度之比恰好为 2∶1,则达 B 点
时 CuCl2 消耗完,接着只电解水,则与图像不符,D 项错误;根据 B→C,溶液的 pH 明显
下降,说明 B 点时 Cl-已耗完,而 Cu2+过量,继续电解,水量减少,由此可判断 B 项错误;
综上分析可知 A 项正确。
答案:A
二、非选择题
11.如右图所示中的 A 为直流电源,B 为浸透饱和氯化钠溶液和酚酞
试液的滤纸,C 为电镀槽,接通电路后,发现 B 上的 c 点显红色,请填
空:
(1)电源 A 上的 a 为________极。
(2)滤纸 B 上发生的总化学反应方程式为:_______________________。
(3)欲在电镀槽中实现在铁上镀锌,接通 K 点,使 c、d 两点短路,则电极 e 上发生的反
应为________,电极 f 上发生的反应为________,槽中盛放的电镀液可以是________溶液或
________溶液(只要求填两种电解质溶液)。
解析:根据 c 点酚酞变红,则该极的反应为 2H++2e-===H2↑,即该极为阴极,与电
源的负极相连,所以 a 点是正极。(2)滤纸 B 上发生的总反应方程式为 2NaCl+2H2O =====电解
H2↑+Cl2↑+2NaOH。(3)c、d 两点短路后,e 为阳极,反应为 Zn-2e -===Zn2+。阴极上
镀锌,则阴极反应为 Zn2++2e-===Zn。电解液用含镀层离子的电解质,所以可用 ZnSO4 溶
液或 Zn(NO3)2 溶液等。
答案:(1)正
(2)2NaCl+2H2O =====电解
H2↑+Cl2↑+2NaOH
(3)Zn-2e-===Zn2+ Zn2++2e-===Zn
ZnSO4 Zn(NO3)2
12.(2014·江苏昆山检测)现在工业上主要采用离子交换膜法电解饱和食盐水制取 H 2、
Cl2、NaOH。请回答下列问题:
(1)在电解过程中,与电源正极相连的电极的电极反应式为________________________。
(2)电解之前食盐水需要精制,目的是除去粗盐中含有的 Ca2+、Mg2+、SO 2-4 等杂质离
子,使用的试剂有:
a.Na2CO3 溶液
b.Ba(OH)2 溶液
c.稀盐酸
其合理的加入顺序为________(填试剂序号)。
(3)如果在容积为 10 L 的离子交换膜电解槽中,1 min 内在阳极可产生 11.2 L(标准状
况)Cl2,这时溶液的 pH 是(设体积维持不变)________________________。
解析:(1)与电源正极相连的电极为阳极,Cl-放电。
(2)为了除尽杂质,除杂剂要稍过量,所以要考虑后加的试剂能够将前面加入的过量试
剂也除去,最后加入的物质可依靠其特性如挥发性而除去。
(3)由 2NaCl+2H2O =====电解
2NaOH+Cl2↑+H2↑可知:
n(NaOH)=2n(Cl2)=2× 11.2 L
22.4 L·mol-1=1 mol,
c(OH-)=c(NaOH)=1 mol
10 L =0.1 mol/L 所以溶液的 pH=13。
答案:(1)2Cl--2e-===Cl2↑
(2)bac
(3)13
13.(2014·温州高二检测)25 ℃时,用石墨电极电解 2.0 L 0.5 mol·L-1 CuSO4 溶液。5 min
后,在一个石墨电极上有 6.4 g Cu 生成。
试回答下列问题:
(1)发生氧化反应的是________极,电极反应为__________________________________
________________________________________________________________________。
(2)若电解后溶液的体积不变,则电解后溶液的 pH 为________。
(3)若将溶液恢复到与电解前一样,则需加入________mol 的________。
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差________g,电解
液的 pH________(填“变小”、“变大”或“不变”)。
解析:(1)n(CuSO4)=2.0 L×0.5 mol·L-1=1.0 mol,而在阴极析出的 Cu 为 64 g
64 g·L-1=0.1
mol,故 CuSO4 未完全电解,阳极发生氧化反应,电极反应为 4OH--4e-===2H2O+O2↑。
(2)总反应:
2CuSO4+2H2O =====电解
2Cu + O2↑ + 2H2SO4
2 2 2 1 2
0.1 mol 0.1 mol 0.1 mol 0.05 mol 0.1 mol
所以电解后 c(H+)=0.1 mol × 2
2.0 L =0.1 mol·L-1。
故 pH=-lg0.1=1。
(3)电解后生成的 0.1 mol Cu 和 0.05 mol O2 脱离该体系,即相当于 0.1 mol CuO,因此若
将溶液复原,则应加入 0.1 mol CuO。
(4)此时为电镀池,阳极:Cu-2e-===Cu2+,阴极:Cu2++2e-===Cu,因此若阴极上
析出 6.4 g 铜,则阳极溶解 6.4 g 铜,电解后两铜片质量差为 6.4 g+6.4 g=12.8 g,而电解液
的 pH 不变。
答案:(1)阳 4OH--4e-===2H2O+O2↑
(2)1
(3)0.1 CuO
(4)12.8 不变
14.(2014·福建龙岩高二期中)右图由莫菲滴管改装成的微型电解装
置。
(1)若用该装置来电解含 3 mol NaCl 和 1 mol H2SO4 的混合溶液,已
知 a、b 两极均为石墨。当从导管口收集到 44.8 L(标准状况下)氢气时,阳
极生成的气体及对应的物质的量________。
(2)若 b 极是铜锌合金,a 极是纯铜,电解质溶液中含有足量的 Cu2+,通电一段时间后,
若 b 极恰好全部溶解,此时 a 极质量增加 7.68 g,溶液质量增加 0.03 g,则合金中 Cu、Zn
的物质的量之比为________。
解析:(1)生成 44.8 L H2,转移 4 mol 电子,则阳极将生成 1.5 mol Cl2 和 0.25 mol O2。
(2)a 极增加 7.68 g Cu,其物质的量为 0.12 mol,由得失电子守恒可知,b 极 Cu、Zn 的
物质的量之和为 0.12 mol,溶液中部分 Cu2+变成 Zn2+,即:
Cu2+ ~ Zn2+ Δm
64 g 65 g 1 g
溶液质量增加 0.03 g,可知 Zn 的物质的量为 0.03 mol,所以 Cu、Zn 的物质的量之比为
0.09∶0.03,即 3∶1。
答案:(1)1.5 mol Cl2,0.25 mol O2
(2)3∶1
15.(2014·江门模拟)蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电和
放电时发生的反应是 NiO2+Fe+2H2O ― ― →充电
Fe(OH)2+Ni(OH)2,用该蓄电池电解(阴、阳
极均为惰性电极)M(NO3)x 溶液时,若此蓄电池工作一段时间后消耗 0.36 g 水。
(1)电解时,电解池的阳极应连接________(填序号)。
A.NiO2 B.Fe
C.Fe(OH)2 D.Ni(OH)2
(2)电解 M(NO3)x 溶液时某一极质量增加了 m g,金属 M 的相对原子质量的计算式为
________(用 m、x 表示)。
(3)此蓄电池电解含有 0.01 mol CuSO4 和 0.01 mol NaCl 的混合溶液 100 mL,转移相同量
的电子时,阳极产生气体________L(标准状况),电解后溶液加水稀释至 1 L,溶液的 pH 为
________。
解析:(1)电解池的阳极应连原电池的正极,故连 NiO2。
(2)蓄电池工作时,消耗 0.36 g 水,通过 0.02 mol 电子,由电子守恒知mx
M =0.02,M=50mx。
(3)通过电子 0.02 mol,首先产生 0.005 mol Cl2,转移电子的物质的量为 0.01 mol,然后
发生 4OH--4e-===2H2O+O2↑,产生 O2 为0.02 mol-0.01 mol
4 =0.0025 mol,V 气=(0.002
5 mol+0.005 mol)×22.4 L/mol=0.168 L。产生 n(H+)=0.0025 mol×4=0.01 mol,c(H+)=0.01
mol/L,pH=2。
答案:(1)A
(2)50mx
(3)0.168 2
相关文档
- 人教版高中化学选修4练习:第一章章2021-07-055页
- 人教版高中化学选修4练习:第三章第2021-07-0510页
- 人教版高中化学选修4练习:第二章第2021-07-0310页
- 人教版高中化学选修4练习:专题讲座(2021-07-033页
- 人教版高中化学选修4练习:专题讲座(2021-07-036页
- 人教版高中化学选修4练习:第三章第2021-07-0312页
- 人教版高中化学选修4练习:第四章第2021-07-0310页
- 人教版高中化学选修4练习:专题讲座(2021-07-026页
- 人教版高中化学选修4练习:专题讲座(2021-07-024页
- 人教版高中化学选修4练习:模块综合2021-07-0214页