- 1.34 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
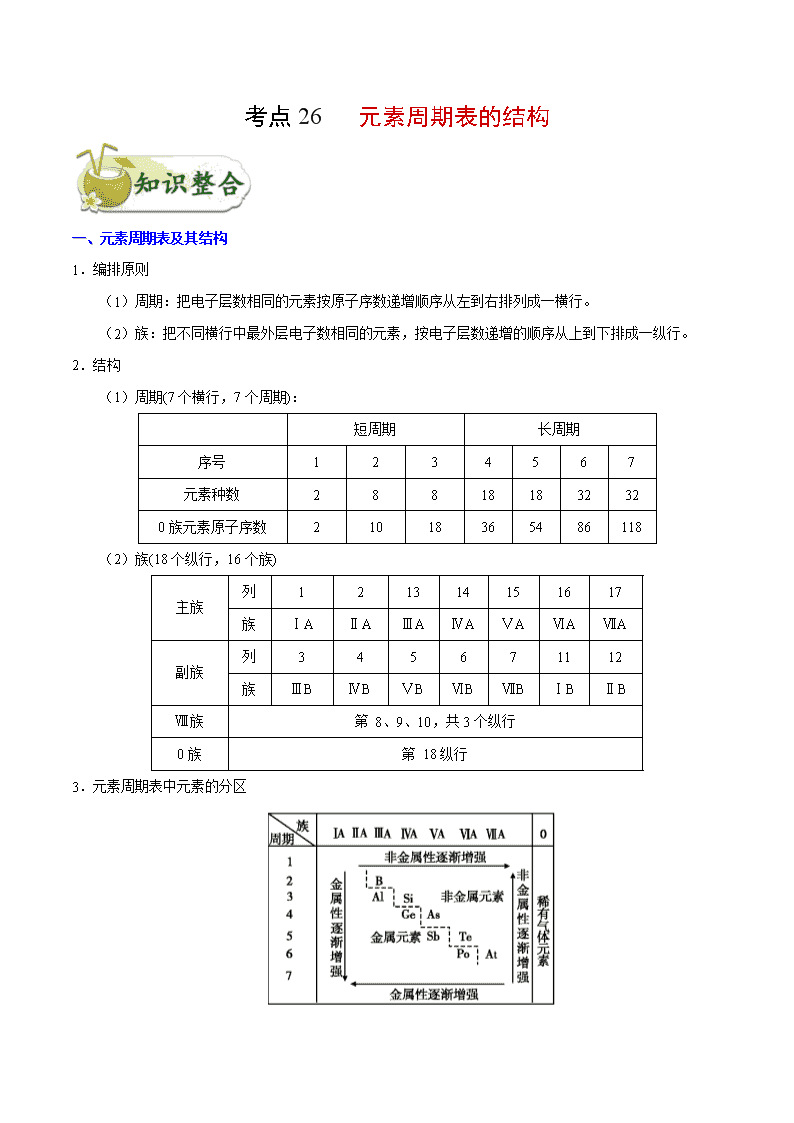
考点 26 元素周期表的结构
一、一、元素周期表及其结构
1.编排原则
(1)周期:把电子层数相同的元素按原子序数递增顺序从左到右排列成一横行。
(2)族:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序从上到下排成一纵行。
2.结构
(1)周期(7 个横行,7 个周期):
短周期 长周期
序号 1 2 3 4 5 6 7
元素种数 2 8 8 18 18 32 32
0 族元素原子序数 2 10 18 36 54 86 118
(2)族(18 个纵行,16 个族)
主族
列 1 2 13 14 15 16 17
族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
副族
列 3 4 5 6 7 11 12
族 ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB
Ⅷ族 第 8、9、10,共 3 个纵行
0 族 第 18 纵行
3.元素周期表中元素的分区
4.元素周期表中必记的 4 个关系
(1)常见的四组等量关系
①核电荷数=质子数=原子序数;
②核外电子层数=周期序数;
③主族序数=最外层电子数=最高正价;
④非金属元素:最低负价=最高正价−8。
(2)同主族元素的原子序数差的关系
①位于过渡元素左侧的主族元素,即第ⅠA、第ⅡA 族,同主族、邻周期元素原子序数之差为上一周期
元素所在周期所含元素种数;
②位于过渡元素右侧的主族元素,即第ⅢA~第ⅦA 族,同主族、邻周期元素原子序数之差为下一周期
元素所在周期所含元素种数。例如,氯和溴的原子序数之差为 35−17=18(溴所在第四周期所含元素的种数)。
(3)同周期第ⅡA 族和第ⅢA 族元素原子序数差的关系
周期序数 1 2 3 4 5 6 7
原子序数差 无 1 1 11 11 25 25
原因 —— 增加了过渡元素
增加了过渡元素和
镧系或锕系元素
(4)奇偶关系
①原子序数是奇数的主族元素,其所在主族序数必为奇数;
②原子序数是偶数的主族元素,其所在主族序数必为偶数。
二、元素周期表的应用
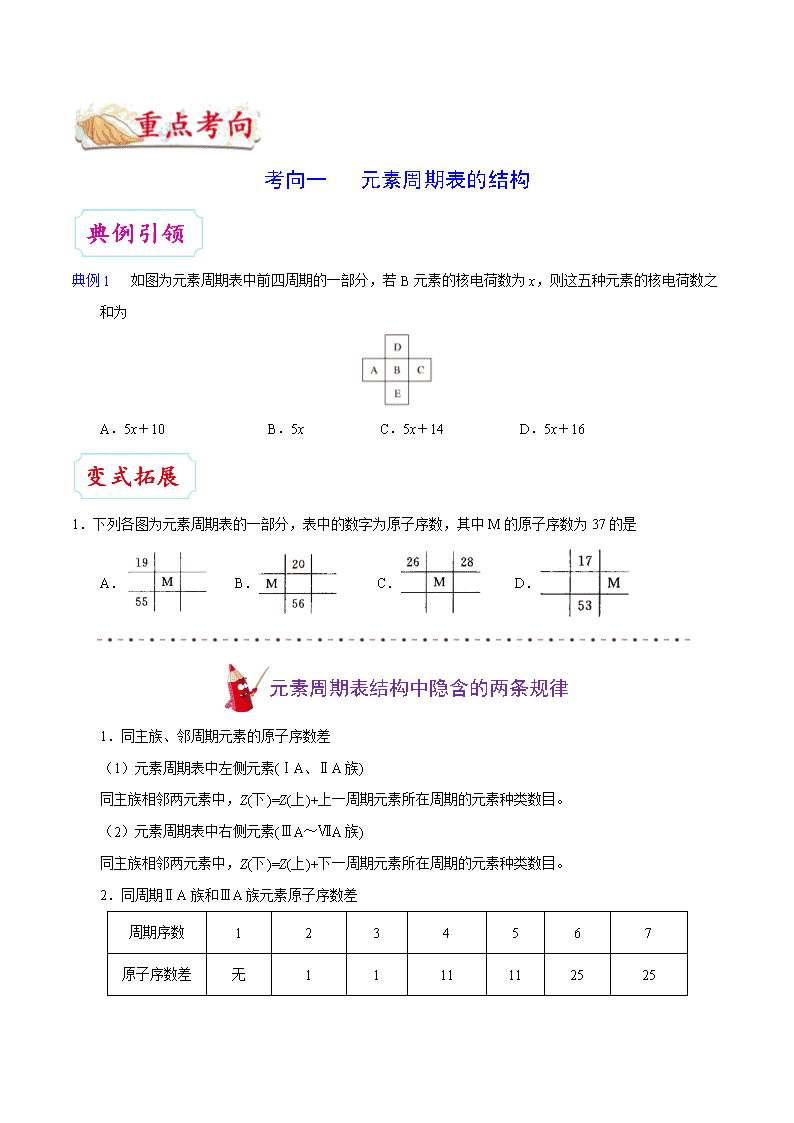
考向一 元素周期表的结构
典例 1 如图为元素周期表中前四周期的一部分,若 B 元素的核电荷数为 x,则这五种元素的核电荷数之
和为
A.5x+10 B.5x C.5x+14 D.5x+16
1.下列各图为元素周期表的一部分,表中的数字为原子序数,其中 M 的原子序数为 37 的是
A. B. C. D.
元素周期表结构中隐含的两条规律
1.同主族、邻周期元素的原子序数差
(1)元素周期表中左侧元素(ⅠA、ⅡA 族)
同主族相邻两元素中,Z(下)=Z(上)+上一周期元素所在周期的元素种类数目。
(2)元素周期表中右侧元素(ⅢA~ⅦA 族)
同主族相邻两元素中,Z(下)=Z(上)+下一周期元素所在周期的元素种类数目。
2.同周期ⅡA 族和ⅢA 族元素原子序数差
周期序数 1 2 3 4 5 6 7
原子序数差 无 1 1 11 11 25 25
原因 增加了过渡元素
增加了过渡元素和
镧系或锕系元素
考向二 元素位置的确定
典例 2 A、B、C 均为短周期元素,它们在周期表中的位置如图所示,已知 B、C 元素的原子序数之和是
A 元素原子序数的 4 倍,则 A、B、C 符合的一组是
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D.C、Al、P
2.下列说法正确的是
A.原子序数之差为 2 的两种元素不可能位于同一主族
B.D−核外有 36 个电子,则元素 D 位于第四周期第ⅦA 族
C.位于同一主族的甲、乙两种元素,甲的原子序数为 x,则乙的原子序数可能为 x+4
D.位于同一周期的甲、乙两种元素,甲位于第ⅠA 族,原子序数为 x,乙位于第ⅢA 族,则乙原子序数
可能为 x+19
利用稀有气体元素确定主族元素位置
第一~第七周期稀有气体元素的原子序数依次为:2、10、18、36、54、86、118。
确定主族元素在周期表中位置的方法:原子序数−最邻近的稀有气体元素的原子序数=ΔZ。
例如:①35 号元素(相邻近的是 36Kr),则 35−36=−1,故周期数为四,族序数为 8−|−1|=7,即第四周期
第ⅦA 族,即溴元素;②87 号元素(相邻近的是 86Rn),则 87−86=1,故周期数为 7,族序数为 1,即第七周
期第ⅠA 族,即钫元素。
1.元素周期表中的前 4 周期,两两相邻的 5 种元素如图所示,若 B 元素的核电荷数为 a。下列说法正确的
是
A.B、D 的原子序数之差可能为 2
B.E、B 的原子序数之差可能是 8、18 或 32
C.5 种元素的核电荷数之和为 5a+10
D.A、E 的原子序数之差可能是 7
2.下列有关元素周期表及应用叙述正确的是
A.周期表中的族分为主族、副族、0 族和第Ⅷ族,共 18 个族
B.凡单原子形成的离子,其核外电子排布一定符合 0 族元素原子的核外电子排布
C.俄罗斯专家首次合成了 176
116 X 原子,116 号元素位于元素周期表中第七周期第ⅥA 族
D.根据主族元素最高正价与族序数的关系,推出卤族元素最高正价都是+7
3.W、X、Y、Z 四种短周期元素在元素周期表中的相对位置如图所示,X 的最高价氧化物对应的水化物既
能溶于氢氧化钠溶液又能溶于硫酸,由此可知( )
W
X Y Z
A.Y 的最高价氧化物不溶于任何酸 B.Y 元素的单质可用于制作太阳能电池
C.Z 元素氧化物对应水化物的酸性一定强于 Y D.Z 元素单质在化学反应中只表现氧化性
4.A、B 分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数。①若 A
为ⅡA 族,其质量数为 X,则 B 的质子数为 Y;②若 A 为ⅣA 族,其质子数为 m,则 B 质量数为 n,则
Y 和 n 的值是
A.( 2
X +18)和(2m+18) B.( 2
X +8)和(2m+18)
C.( 2
X +8)和(2m+36) D.( 2
X +18)和(2m+36)
5.19 世纪中叶,门捷列夫总结了如表所示的元素化学性质的变化情况。请回答:
(1)门捷列夫的突出贡献是 (填字母,下同)。
A.提出了原子学说 B.提出了分子学说
C.发现了元素周期律 D.发现了能量守恒定律
(2)该表变化表明 。
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.ⅠA 族元素的金属性一定比同周期ⅡA 族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从ⅢA 族的硼到ⅦA 族的砹连接的一条折线,我们能从分界线附近
找到 。
A.耐高温材料 B.耐腐蚀材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子 283
116 X ,它属于 116 号元素(元素符号暂用 X 代替),下列关于它
的推测正确的是 。
A.这种原子的中子数为 167
B.这种元素位于元素周期表的第 6 周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合
6.下面是元素周期表的一部分,参照元素①~⑧在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________________。
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中
一种化合物的电子式:________________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为________________。
1.[2019北京] 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院
士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)
同周期。下列说法不正确的是
A.In 是第五周期第ⅢA 族元素
B.11549In 的中子数与电子数的差值为 17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
2.[2019·4 月浙江选考]2019 年是门捷列夫提出元素周期表 150 周年。根据元素周期律和元素周期表,下列
推断不合理的是
A.第 35 号元素的单质在常温常压下是液体
B.位于第四周期第ⅤA 族的元素为非金属元素
C.第 84 号元素的最高化合价是+7
D.第七周期 0 族元素的原子序数为 118
3.[2018·全国Ⅰ]主族元素 W、X、Y、Z 的原子序数依次增加,且均不大于 20。W、X、Z 最外层电子数之
和为 10;W 与 Y 同族;W 与 Z 形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的
是
A.常温常压下 X 的单质为气态
B.Z 的氢化物为离子化合物
C.Y 和 Z 形成的化合物的水溶液呈碱性
D.W 与 Y 具有相同的最高化合价
4.[2016·全国Ⅱ]a、b、c、d 为短周期元素,a 的原子中只有 1 个电子,b2−和 C+离子的电子层结构相同,d
与 b 同族。下列叙述错误的是
A.a 与其他三种元素形成的二元化合物中其化合价均为+1
B.b 与其他三种元素均可形成至少两种二元化合物
C.c 的原子半径是这些元素中最大的
D.d 和 a 形成的化合物的溶液呈弱酸性
5.[2015·全国Ⅱ]原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1、6、7、1。a−的电子
层结构与氦相同,b 和 c 的次外层有 8 个电子,c−和 d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性次序为 c>b>a
B.a 和其他 3 种元素均能形成共价化合物
C.d 和其他 3 种元素均能形成离子化合物
D.元素 a、b、c 各自最高和最低化合价的代数和分别为 0、4、6
相关文档
- 2020届高考化学二轮复习元素及其化2021-07-058页
- 2020届高考化学一轮复习化学实验方2021-07-0510页
- 江苏省2020高考化学二轮复习专题题2021-07-059页
- 2020届高考化学一轮复习(山东专用)化2021-07-0520页
- 2021高考化学全国通用一轮习题:第十2021-07-0510页
- 2020届高考化学一轮复习化学与可持2021-07-0513页
- 天津专用2020高考化学二轮复习热点2021-07-057页
- 2020版高考化学一轮复习物质的量 2021-07-0512页
- 2020届高考化学一轮复习(山东专用) 2021-07-0532页
- 2021版高考化学一轮复习核心素养微2021-07-058页